烃的含氧衍生物《醇》教学课件
图片预览






文档简介
课件26张PPT。
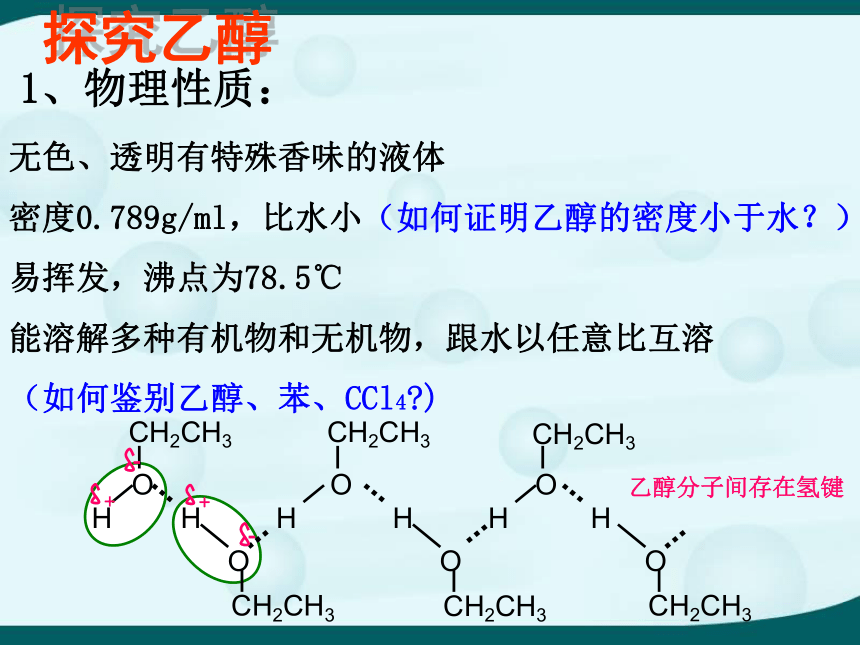
烃的含氧衍生物第二单元 醇乙醇分子间存在氢键无色、透明有特殊香味的液体
密度0.789g/ml,比水小(如何证明乙醇的密度小于水?)
易挥发,沸点为78.5℃
能溶解多种有机物和无机物,跟水以任意比互溶
(如何鉴别乙醇、苯、CCl4?)1、物理性质:探究乙醇作燃料 —— 飞机、汽车、火锅、酒精灯等作消毒剂 —— 医用酒精等2 、乙醇的用途:制酒精型饮料 —— 啤酒、红酒等工业制取乙酸
工业酒精约含乙醇96%(体积分数),
无水酒精含乙醇99.5%以上
啤酒含酒精3%—5%
葡萄酒含酒精10%—20%,
黄酒含酒精8%—15%,
白酒含酒精38%—70% 各 类 酒 精思考 ⑴如何区分乙醇溶液和无水乙醇?取少量酒精,加入无水硫酸铜,
若出现蓝色,则证明是乙醇溶液.⑵如何实现由乙醇溶液向无水乙醇转化? 乙醇溶液 无水乙醇
(96%) (99.5%) 加CaO生成Ca(OH)2
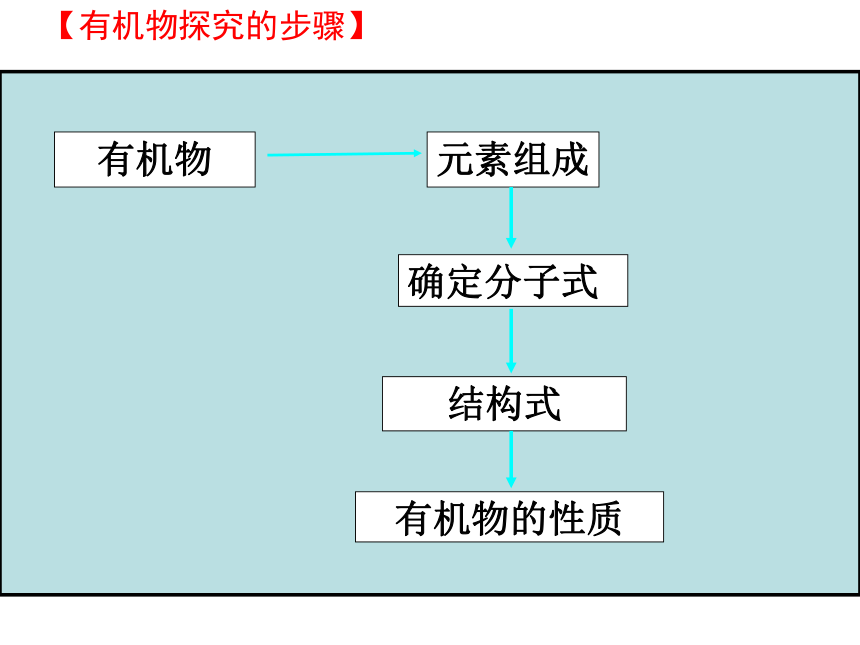
蒸馏学生表演【有机物探究的步骤】有机物元素组成有机物的性质结构式
确定分子式学生表演【探究会让你更接近物质的真相】你将如何通过探究,得到乙醇的结构?乙醇一、探究乙醇的结构学生表演【你想到了吗?】元素分析仪【你想到了吗?】学生表演乙醇的质谱图29100%060%20%503020质谱法:学生表演【你想到了吗?】乙醇的红外光谱图
分子中有三种基团(依次为-OH、-CH3、-CH2)红外光谱学生表演【小结】元素组成有机物的性质结构式
确定分子式现代仪器分析传统实验分析学生表演乙醚的核磁共振谱图显示分子中只有一种氢原子乙醇的核磁共振谱图
显示分子中有三种氢原子H的核磁共振谱图学生表演【鉴别】烧杯1: 乙醇
烧杯2: 水
烧杯3: 乙醚分别加入钠块,观察现象【只有实验才是检验化学知识的最高法庭】沉在底部无Na的密度大于乙醇。钠与乙醇缓慢反应,放出氢气。沉在底部无不反应学生表演【乙醇的结构】学生表演【知识回顾】乙醇的化学性质1)、乙醇与钠反应2CH3CH2OH+2Na → 2CH3CH2ONa+H2↑2)、乙醇的酯化反应注意:
①酯化反应本质取代反应,该反应为可逆反应
②浓硫酸的作用:催化剂和吸水剂。
③断键:酸脱羟基,醇脱氢。 学生表演【知识回顾】3)、乙醇的氧化反应(1)燃烧反应(2) 催化氧化(3) 强氧化剂(被酸性高锰酸钾或酸性重铬酸钾氧化)学生表演【知识应用】判断是否酒后驾车的方法三氧化铬硫酸铬3CH3CH2OH+2K2Cr2O7+8H2SO4→
3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O
(橙红色)(绿色)学生表演【物质间是互相联系和转化的】二、探究乙醇的性质实验探究二实验探究三学生表演【只有实验才是检验化学知识的最高法庭】探究案例二乙醇与氢卤酸的反应下面的实验可以帮助我们认识乙醇与氢卤酸的反应。
1.组装如图所示装置。在试管I中依次加入2 mL蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3 g 溴化钠粉末,在试管II中注入蒸馏水,烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却,观察并描述实验现象。1、你怎样证明试管II中收集到的就是卤代烃?2、试管I中液体为什么会发黄?3. 浓硫酸的作用是什么?学生表演【实验原理】乙醇与氢卤酸的反应NaBr + H2SO4 = NaHSO4 + HBr 学生表演【只有实验才是检验化学知识的最高法庭】下列活动能帮助我们认识乙醇的脱水反应。
1.完成如图所示实验,在试管中放入石棉绒并注入2 mL 95%乙醇,将石棉绒露出液面,给试管加热,将生成的气体经过水洗后,用排水集气法收集。2.研究证实,氧化铝在该反应中作催化剂。请根据上述实验和信息,参考前面的探究案例,提出一个合适的探究课题,展开对该反应的研究。请设计探究方案,将你的方案与同学们交流。3.经过探究,你能判断出乙醇所发生的反应是什么类型吗?探究案例三
认识乙醇的脱水反应
学生表演【实验原理】乙醇的脱水反应 H H
H―C―C―H
H OH浓硫酸
170 ℃学生表演【总结规律让我们举一反三】①与活泼金属反应
②与氢卤酸反应
③ --催化氧化
④分子内脱水
⑤分子间脱水 分子结构:
物理性质:
化学性质:
反应中乙醇断键位置?乙醇官能团-OH谢谢!
密度0.789g/ml,比水小(如何证明乙醇的密度小于水?)
易挥发,沸点为78.5℃
能溶解多种有机物和无机物,跟水以任意比互溶
(如何鉴别乙醇、苯、CCl4?)1、物理性质:探究乙醇作燃料 —— 飞机、汽车、火锅、酒精灯等作消毒剂 —— 医用酒精等2 、乙醇的用途:制酒精型饮料 —— 啤酒、红酒等工业制取乙酸
工业酒精约含乙醇96%(体积分数),
无水酒精含乙醇99.5%以上
啤酒含酒精3%—5%
葡萄酒含酒精10%—20%,
黄酒含酒精8%—15%,
白酒含酒精38%—70% 各 类 酒 精思考 ⑴如何区分乙醇溶液和无水乙醇?取少量酒精,加入无水硫酸铜,
若出现蓝色,则证明是乙醇溶液.⑵如何实现由乙醇溶液向无水乙醇转化? 乙醇溶液 无水乙醇
(96%) (99.5%) 加CaO生成Ca(OH)2
蒸馏学生表演【有机物探究的步骤】有机物元素组成有机物的性质结构式
确定分子式学生表演【探究会让你更接近物质的真相】你将如何通过探究,得到乙醇的结构?乙醇一、探究乙醇的结构学生表演【你想到了吗?】元素分析仪【你想到了吗?】学生表演乙醇的质谱图29100%060%20%503020质谱法:学生表演【你想到了吗?】乙醇的红外光谱图
分子中有三种基团(依次为-OH、-CH3、-CH2)红外光谱学生表演【小结】元素组成有机物的性质结构式
确定分子式现代仪器分析传统实验分析学生表演乙醚的核磁共振谱图显示分子中只有一种氢原子乙醇的核磁共振谱图
显示分子中有三种氢原子H的核磁共振谱图学生表演【鉴别】烧杯1: 乙醇
烧杯2: 水
烧杯3: 乙醚分别加入钠块,观察现象【只有实验才是检验化学知识的最高法庭】沉在底部无Na的密度大于乙醇。钠与乙醇缓慢反应,放出氢气。沉在底部无不反应学生表演【乙醇的结构】学生表演【知识回顾】乙醇的化学性质1)、乙醇与钠反应2CH3CH2OH+2Na → 2CH3CH2ONa+H2↑2)、乙醇的酯化反应注意:
①酯化反应本质取代反应,该反应为可逆反应
②浓硫酸的作用:催化剂和吸水剂。
③断键:酸脱羟基,醇脱氢。 学生表演【知识回顾】3)、乙醇的氧化反应(1)燃烧反应(2) 催化氧化(3) 强氧化剂(被酸性高锰酸钾或酸性重铬酸钾氧化)学生表演【知识应用】判断是否酒后驾车的方法三氧化铬硫酸铬3CH3CH2OH+2K2Cr2O7+8H2SO4→
3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O
(橙红色)(绿色)学生表演【物质间是互相联系和转化的】二、探究乙醇的性质实验探究二实验探究三学生表演【只有实验才是检验化学知识的最高法庭】探究案例二乙醇与氢卤酸的反应下面的实验可以帮助我们认识乙醇与氢卤酸的反应。
1.组装如图所示装置。在试管I中依次加入2 mL蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3 g 溴化钠粉末,在试管II中注入蒸馏水,烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却,观察并描述实验现象。1、你怎样证明试管II中收集到的就是卤代烃?2、试管I中液体为什么会发黄?3. 浓硫酸的作用是什么?学生表演【实验原理】乙醇与氢卤酸的反应NaBr + H2SO4 = NaHSO4 + HBr 学生表演【只有实验才是检验化学知识的最高法庭】下列活动能帮助我们认识乙醇的脱水反应。
1.完成如图所示实验,在试管中放入石棉绒并注入2 mL 95%乙醇,将石棉绒露出液面,给试管加热,将生成的气体经过水洗后,用排水集气法收集。2.研究证实,氧化铝在该反应中作催化剂。请根据上述实验和信息,参考前面的探究案例,提出一个合适的探究课题,展开对该反应的研究。请设计探究方案,将你的方案与同学们交流。3.经过探究,你能判断出乙醇所发生的反应是什么类型吗?探究案例三
认识乙醇的脱水反应
学生表演【实验原理】乙醇的脱水反应 H H
H―C―C―H
H OH浓硫酸
170 ℃学生表演【总结规律让我们举一反三】①与活泼金属反应
②与氢卤酸反应
③ --催化氧化
④分子内脱水
⑤分子间脱水 分子结构:
物理性质:
化学性质:
反应中乙醇断键位置?乙醇官能团-OH谢谢!
