《化学反应中的能量变化》教学课件
图片预览





文档简介
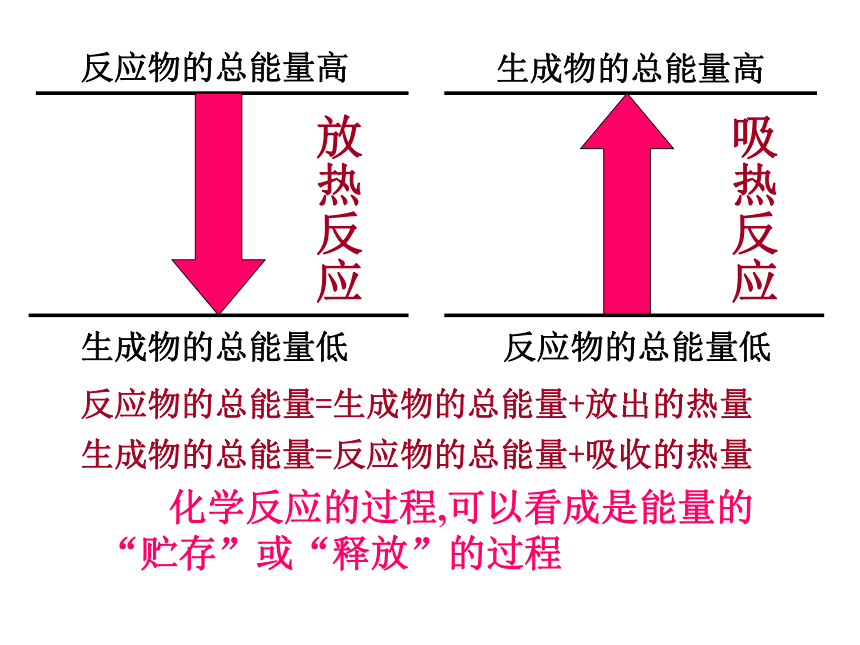
课件22张PPT。化学反应中的能量变化 一.化学反应中的能量变化,通常表现为热量的变化。 其它:电能/光能/功等吸热反应放热反应化学上把有热量放出的化学反应叫做放热反应。化学上把吸收热量的化学反应叫做吸热反应。反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应吸热反应反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量 化学反应的过程,可以看成是能量的“贮存”或“释放”的过程远古时代,燃烧这一最早被利用的氧化还原反应促进了人类的进化。
地球上,植物通过光合作用每年储存了大约1017 kJ 能量,同时将1010 t 碳转化为碳水化合物。
人体中氧通过与血红蛋白的结合形成氧合血红蛋白,并在需要时缓慢释放,氧化葡萄糖,放出能量。
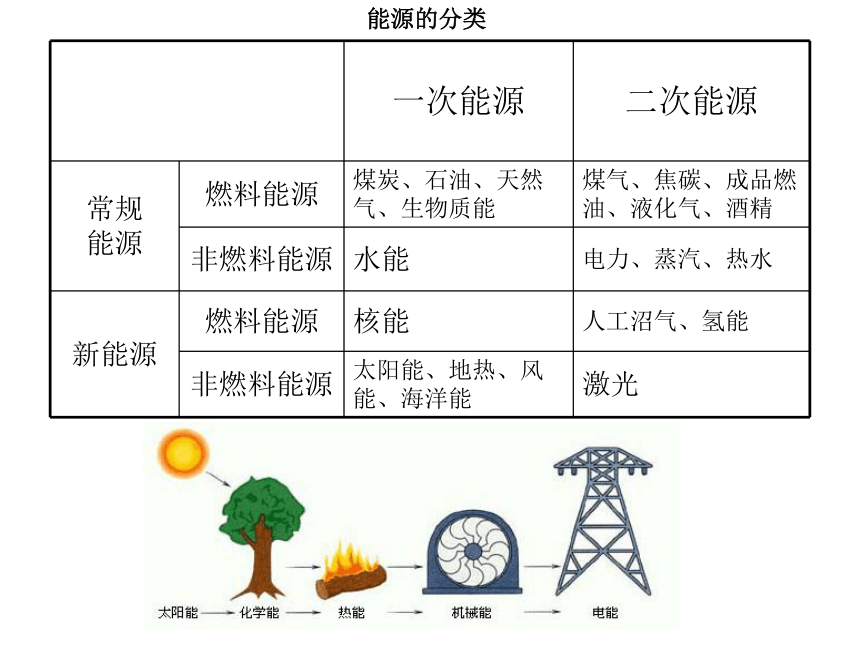
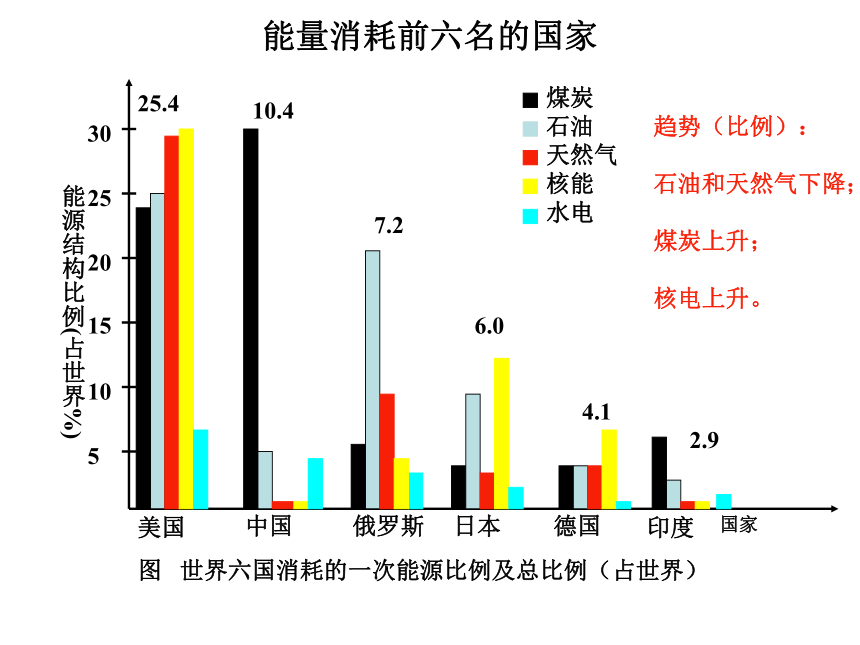
现代社会,金属冶炼、高能燃料和众多化工产品的合成都涉及氧化还原反应和能量变化。能源的分类能量消耗前六名的国家图 世界六国消耗的一次能源比例及总比例(占世界)趋势(比例):
石油和天然气下降;
煤炭上升;
核电上升。二、燃料的充分燃烧1.人类当前所需能源的主要来源是化石燃料――煤、石油、天然气。
2.人类应当树立节能意识:
(1)化石燃烧无法再生;
(2)提高燃烧效率,节约能源。
3.使燃料充分燃烧的措施:
(1)通入充足且适量的空气;
(2)固体燃料粉碎、液体燃料喷雾以增大燃料与空气的接触面。
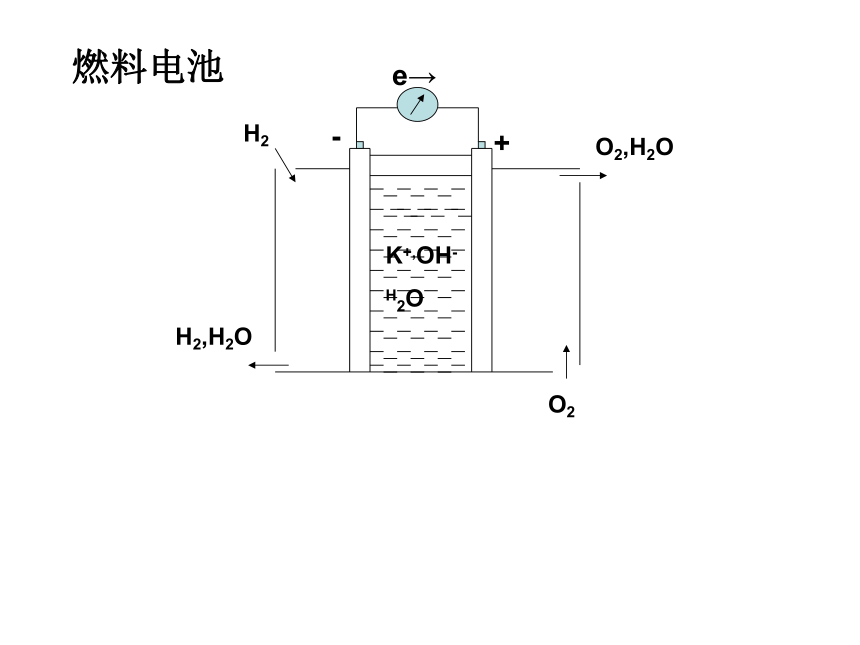
4.煤炭的气化和液化,既防止污染,又提高燃烧效率。 新能源的开发 1.燃料电池,2.氢能,
3.太阳能, 4.风能,
5.生物能、 6.核能、
7.地热能、 8.潮汐能等 燃料电池锂锰电池:锂离子电池:碱性(Zn-MnO2)电池(一次性)图 太阳能电池图 氢弹爆炸图 秦山核电厂外景秦山核电站二期工程施工现场 鸟 瞰 一 期 沸腾炉接触法制硫酸例:在同温、同压下,比较下列反应放出热量Q1、Q2的大小A:2H2(g)+O2(g)=2H2O(g)+Q1
2H2(g)+O2(g)=2H2O(l)+Q2分析:反应物的状态,数量和生成物的数量都相同,但由于气态水转化为液态要放出一定数量的热量∴Q2>Q1B: S(g)+O2(g)=SO2(g)+Q1
S(S)+O2(g)=SO2(g)+Q2两式数量相同,S由固态吸收热量转化为气态,在氧化燃烧生成SO2。其放出热量的总和小于由气态S直接燃烧所放出的热量C: C(S)+1/2O2(g)=CO(g)+Q1
C(S)+O2(g)=CO2(g)+Q2固态C氧化为CO,释放出热量Q1,CO是气体燃料,和O2反应生成CO2,又释放热量Q3,两次释放热量的总和Q1+Q3,等于固态C氧化为气态CO2释放的热量Q2,∴Q2>Q1D: H2(g)+Cl2(g)=2HCl(g)+Q1
1/2H2(g)+1/2Cl2(g)= HCl(g)+Q2状态相同,但数量后式仅是前式的一半,释放的热量也应是前式的一半,Q2<Q112g石墨与O2反应生成CO2放出393.51KJ热量; 12g金刚石与O2反应生成CO2放出395.41KJ热量,试比较,石墨与金刚石哪个稳定?比较相同状态、相同数量的金刚石和石墨,与O2完全反应,生成相同状态、相同数量的CO2,金刚石释放出的热量更多,说明金刚石具有的总能量高,不稳定例题2:三.燃烧热和中和热若2.6 g 乙炔(C2H2,气态)完全燃烧生成液态水和CO2(g)时放热130 kJ。则乙炔燃烧的热化学方程式为 C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=-1300 kJ/mol2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ; ΔH=-2600 kJ/mol 在101 kPa时,1 mol 物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。1.燃烧热如:C CO2(g)、H H2O(l)、S SO2(g)
Cl HCl(g)
分析以下几个热化学方程式,哪个是表示固态碳和气态氢气燃烧时的燃烧热的?为什么?
A.C(s)+O2(g)=CO(g);ΔH=-110.5 kJ/mol
B.C(s)+O2(g)=CO2(g);ΔH=-393.5 kJ/mol
C.2H2(g)+O2(g)=2H2O(l);ΔH=-571.6 kJ/mol
D.H2(g)+O2(g)=H2O(g);ΔH=-241.8 kJ/mol解析: A项 C(s)燃烧未生成稳定氧化物CO2(g),故其反应热不能叫燃烧热;B项符合燃烧热的定义;C项H2虽然转变成了稳定的氧化物H2O(l),但由于其反应热表示的是2 mol H2 完全燃烧时的热量变化,故不能叫燃烧热;D项参加燃烧的H2虽然是1 mol,但其生成H2O(g),而不是H2O(l),故它的反应热也不为H2的燃烧热。 在稀溶液中,酸跟碱发生中和反应而生成1 mol H2O,这时的反应热叫做中和热。2.中和热 在书写物质在溶液中发生化学反应的方程式时,我们常用aq来表示稀溶液,稀溶液是指溶于大量水的离子。中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离的吸热所伴随的热效应。例.写出下列反应的热化学方程式:
实验测得:(1)1 L 1 mol/L 稀盐酸跟1 L 1 mol/L NaOH溶液起中和反应放出57.3 kJ热量。
(2)1 L 1 mol/L KOH 溶液中和1 L 1 mol/L HNO3溶液,放出57.3 kJ的热量。
(3)1 L 1 mol/L H2SO4溶液与2 L 1 mol/L NaOH 溶液完全反应,放出114.6 kJ的热量。(1)NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);H=-57.3 kJ/mol
(2)KOH(aq)+HNO3(aq)=KNO3(aq)+H2O(l);ΔH=-57.3 kJ/mol
(3)2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l);
ΔH=-114.6 kJ/mol反应①②的反应热和中和热均为57.3 kJ/mol
反应③的反应热为114.6 kJ/mol,中和热为57.3 kJ/mol因为中和热要求反应生成的H2O为1 mol,而反应(3)生成H2O为2 mol,故其中和热应为反应热的二分之一。若是有弱酸和弱碱参加的中和反应,能用上式表示吗?其中和热的数值还为57.3 kJ/mol吗?若不是,偏大还是偏小?答案:不能;中和热的数值不为57.3 kJ/mol,
一般偏小(因为弱电解质的电离多为吸热)。四.盖斯定律1. 盖斯定律:1840 G.H.Hess(瑞士科学家)
不管化学反应是一步完成或分几步完成,这个过程的热效应是相同的,即总反应的热效应等于各步反应的热效应之和。2.应用条件:注意:
① 某化学反应是在等压(或等容)下一步完成的,在分步完成时,各分步也要在等压(或等容)下进行;
② 要消去某同一物质时,不仅要求物质的种类相同,其物质的聚集状态也相同。
例 :求反应 C(石墨)+1/2 O2(g) ? CO(g) 的反应热?
始态 C(石墨)+O2(g) ? 终态 CO2(g)
CO(g) + 1/2O2
已知: C(石墨) + O2(g) ? CO2(g) ?
?rHm? = - 393.5 kJ·mol-1
CO(g) +1/2O2(g) ? CO2(g) ?
?rHm? 2 = - 283.0 kJ·mol-1
则? - ?得:C(石墨)+1/2 O2(g) ? CO(g) 的?rHm? 1 为:
?rHm? = ?rHm? 1 - ?rHm? 2 = -110.5 kJ·mol-1
地球上,植物通过光合作用每年储存了大约1017 kJ 能量,同时将1010 t 碳转化为碳水化合物。
人体中氧通过与血红蛋白的结合形成氧合血红蛋白,并在需要时缓慢释放,氧化葡萄糖,放出能量。
现代社会,金属冶炼、高能燃料和众多化工产品的合成都涉及氧化还原反应和能量变化。能源的分类能量消耗前六名的国家图 世界六国消耗的一次能源比例及总比例(占世界)趋势(比例):
石油和天然气下降;
煤炭上升;
核电上升。二、燃料的充分燃烧1.人类当前所需能源的主要来源是化石燃料――煤、石油、天然气。
2.人类应当树立节能意识:
(1)化石燃烧无法再生;
(2)提高燃烧效率,节约能源。
3.使燃料充分燃烧的措施:
(1)通入充足且适量的空气;
(2)固体燃料粉碎、液体燃料喷雾以增大燃料与空气的接触面。
4.煤炭的气化和液化,既防止污染,又提高燃烧效率。 新能源的开发 1.燃料电池,2.氢能,
3.太阳能, 4.风能,
5.生物能、 6.核能、
7.地热能、 8.潮汐能等 燃料电池锂锰电池:锂离子电池:碱性(Zn-MnO2)电池(一次性)图 太阳能电池图 氢弹爆炸图 秦山核电厂外景秦山核电站二期工程施工现场 鸟 瞰 一 期 沸腾炉接触法制硫酸例:在同温、同压下,比较下列反应放出热量Q1、Q2的大小A:2H2(g)+O2(g)=2H2O(g)+Q1
2H2(g)+O2(g)=2H2O(l)+Q2分析:反应物的状态,数量和生成物的数量都相同,但由于气态水转化为液态要放出一定数量的热量∴Q2>Q1B: S(g)+O2(g)=SO2(g)+Q1
S(S)+O2(g)=SO2(g)+Q2两式数量相同,S由固态吸收热量转化为气态,在氧化燃烧生成SO2。其放出热量的总和小于由气态S直接燃烧所放出的热量C: C(S)+1/2O2(g)=CO(g)+Q1
C(S)+O2(g)=CO2(g)+Q2固态C氧化为CO,释放出热量Q1,CO是气体燃料,和O2反应生成CO2,又释放热量Q3,两次释放热量的总和Q1+Q3,等于固态C氧化为气态CO2释放的热量Q2,∴Q2>Q1D: H2(g)+Cl2(g)=2HCl(g)+Q1
1/2H2(g)+1/2Cl2(g)= HCl(g)+Q2状态相同,但数量后式仅是前式的一半,释放的热量也应是前式的一半,Q2<Q112g石墨与O2反应生成CO2放出393.51KJ热量; 12g金刚石与O2反应生成CO2放出395.41KJ热量,试比较,石墨与金刚石哪个稳定?比较相同状态、相同数量的金刚石和石墨,与O2完全反应,生成相同状态、相同数量的CO2,金刚石释放出的热量更多,说明金刚石具有的总能量高,不稳定例题2:三.燃烧热和中和热若2.6 g 乙炔(C2H2,气态)完全燃烧生成液态水和CO2(g)时放热130 kJ。则乙炔燃烧的热化学方程式为 C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=-1300 kJ/mol2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ; ΔH=-2600 kJ/mol 在101 kPa时,1 mol 物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。1.燃烧热如:C CO2(g)、H H2O(l)、S SO2(g)
Cl HCl(g)
分析以下几个热化学方程式,哪个是表示固态碳和气态氢气燃烧时的燃烧热的?为什么?
A.C(s)+O2(g)=CO(g);ΔH=-110.5 kJ/mol
B.C(s)+O2(g)=CO2(g);ΔH=-393.5 kJ/mol
C.2H2(g)+O2(g)=2H2O(l);ΔH=-571.6 kJ/mol
D.H2(g)+O2(g)=H2O(g);ΔH=-241.8 kJ/mol解析: A项 C(s)燃烧未生成稳定氧化物CO2(g),故其反应热不能叫燃烧热;B项符合燃烧热的定义;C项H2虽然转变成了稳定的氧化物H2O(l),但由于其反应热表示的是2 mol H2 完全燃烧时的热量变化,故不能叫燃烧热;D项参加燃烧的H2虽然是1 mol,但其生成H2O(g),而不是H2O(l),故它的反应热也不为H2的燃烧热。 在稀溶液中,酸跟碱发生中和反应而生成1 mol H2O,这时的反应热叫做中和热。2.中和热 在书写物质在溶液中发生化学反应的方程式时,我们常用aq来表示稀溶液,稀溶液是指溶于大量水的离子。中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离的吸热所伴随的热效应。例.写出下列反应的热化学方程式:
实验测得:(1)1 L 1 mol/L 稀盐酸跟1 L 1 mol/L NaOH溶液起中和反应放出57.3 kJ热量。
(2)1 L 1 mol/L KOH 溶液中和1 L 1 mol/L HNO3溶液,放出57.3 kJ的热量。
(3)1 L 1 mol/L H2SO4溶液与2 L 1 mol/L NaOH 溶液完全反应,放出114.6 kJ的热量。(1)NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);H=-57.3 kJ/mol
(2)KOH(aq)+HNO3(aq)=KNO3(aq)+H2O(l);ΔH=-57.3 kJ/mol
(3)2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l);
ΔH=-114.6 kJ/mol反应①②的反应热和中和热均为57.3 kJ/mol
反应③的反应热为114.6 kJ/mol,中和热为57.3 kJ/mol因为中和热要求反应生成的H2O为1 mol,而反应(3)生成H2O为2 mol,故其中和热应为反应热的二分之一。若是有弱酸和弱碱参加的中和反应,能用上式表示吗?其中和热的数值还为57.3 kJ/mol吗?若不是,偏大还是偏小?答案:不能;中和热的数值不为57.3 kJ/mol,
一般偏小(因为弱电解质的电离多为吸热)。四.盖斯定律1. 盖斯定律:1840 G.H.Hess(瑞士科学家)
不管化学反应是一步完成或分几步完成,这个过程的热效应是相同的,即总反应的热效应等于各步反应的热效应之和。2.应用条件:注意:
① 某化学反应是在等压(或等容)下一步完成的,在分步完成时,各分步也要在等压(或等容)下进行;
② 要消去某同一物质时,不仅要求物质的种类相同,其物质的聚集状态也相同。
例 :求反应 C(石墨)+1/2 O2(g) ? CO(g) 的反应热?
始态 C(石墨)+O2(g) ? 终态 CO2(g)
CO(g) + 1/2O2
已知: C(石墨) + O2(g) ? CO2(g) ?
?rHm? = - 393.5 kJ·mol-1
CO(g) +1/2O2(g) ? CO2(g) ?
?rHm? 2 = - 283.0 kJ·mol-1
则? - ?得:C(石墨)+1/2 O2(g) ? CO(g) 的?rHm? 1 为:
?rHm? = ?rHm? 1 - ?rHm? 2 = -110.5 kJ·mol-1
