化学:2.2.4《镁的提取及应用》课件(苏教版必修1)
文档属性
| 名称 | 化学:2.2.4《镁的提取及应用》课件(苏教版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-09-29 00:00:00 | ||
图片预览








文档简介
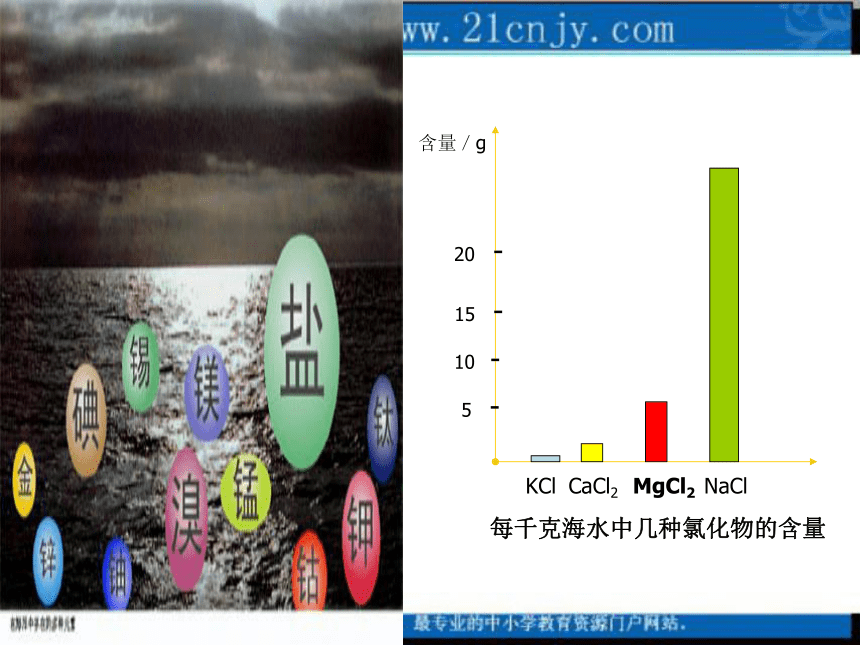
课件28张PPT。镁的提取及应用专题二 从海水获得的化学物质第四节 镁的提取与应用镁合金仪器箱用镁合金做车架的捷安特自行车奥迪轿车镁合金外壳思考:1.海水是一种混合溶液,其中主要含有哪 些离子?Cl- Na+ Mg2+ Ca2+ SO42- K+……2.结合海水资源的特点,我们从海水中提取镁到底有没有实际意义?在提取过程中又可能会面临怎样的困难?思考:1、如何实现Mg2+ 的富集和分离?可以加入一种试剂使Mg2+ 沉淀2、是不是直接往海水中加沉淀剂?不是,因为海水中的Mg 2+ 的浓度很小,直接加沉淀剂不利于Mg 2+ 的沉淀,而且会增大沉淀剂的用量,我们可以先将海水浓缩,再加沉淀剂3、从综合角度考虑选用哪种试剂作沉淀剂好?Ca(OH)2思考:如何由贝壳制得氢氧化钙?贝壳(CaCO3)CaOCa(OH)21、从沉淀效果看,澄清石灰水比氢氧化钠效果差得多,如何解决这一矛盾?3、如何制得无水MgCl2 ?4、由MgCl2 到Mg究竟用还原法还是电解法好?思考:用石灰乳代替石灰水先加盐酸反应,再浓缩得MgCl2?6H2O晶体,然后再将MgCl2?6H2O晶体在HCl气氛中加热脱水即可得无水MgCl2 由于镁本身比较活泼,用还原法比较困难,工业上常使用电解熔融的氯化镁得到镁2、请设计由Mg(OH)2到Mg的可能途径。思考:电解产生的Cl2怎么处理?总结:从海水中获得化学物质的方法溴、碘Cl2一、镁的提取原理:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2 Mg+Cl2↑ CaCO3 CaO+CO2↑
CaO+H2O=Ca(OH)2 CaOMg(OH)2MgCl2?6H2OMgCl2MgMg(OH)2+2HCl=MgCl2+2H2O
探究一:取一小段除去氧化膜的镁条投入盛有一定量稀盐酸的试管中;
现象:
结论或化学方程式: 镁条逐渐溶解,有大量气体产生 Mg+2HCl=MgCl2+H2↑探究二:取一小段除去氧化膜的镁条投入滴有酚酞的水中;
现象:
结论或化学方程式: 有气体产生,滴有酚酞的水溶液变红(但比钠与水反应缓和得多)探究三:取一根除去氧化膜的镁条,点燃后插入充满CO2的的集气瓶中。
现象:
结论或化学方程式: 燃着的镁条在CO2中继续燃烧,发出耀眼的白光,生成白色固体,在集气瓶的内壁有黑色固体附着四、Mg条与氮气的反应镁的性质与原子结构的关系Mg易失2e-Mg2+因此:镁很活泼,可与活泼的非金属、酸等物质反应镁的化性归纳1、与O2反应常温:生成氧化膜 (发生钝化)3、与水反应Mg+2H2O(热水)== Mg(OH)2↓+H2↑中强碱,能使酚酞变红4、与氧化物反应S+2MgO若Mg过量:5、与非氧化性酸反应:稀H2SO4 稀HCl、H3PO4Mg+2H+=Mg2++H2↑与氧化性酸发生复杂的反应(HNO3、浓H2SO4)6、与盐溶液反应(置换较不活泼的金属)Mg +Cu2+ = Mg2++Cu 镁的物性:银白色金属光泽,密度小合金:金属与金属或非金属熔合在一起形成且有金属特性的混合物特性:熔点低于任何一组分镁的主要用途:1、制合金
2、制耐火材料(MgO)熔点高
3、植物叶绿素组成成分1、海水中含的MgCl2是Mg的重要来源之一,从海水中提镁,可按如下步骤进行:
(1)将贝壳制成石灰乳
(2)在引入的海水中加入石灰乳、沉降、过滤、洗涤沉淀物
(3)将沉淀物与盐酸反应、结晶、过滤、干燥产物
(4)将产物熔融后电解
关于提取镁,下列说法中不正确的是( )
A、此法的优点之一是原料来源丰富
B、进行(1)、(2)、(3)步的目的是从海水中提取MgCl2
C、第四步会产生氯气
D、以上过程中涉及到复分解反应、化合反应和置换反应D2、分析镁在空气中的燃烧产物,肯定不存在的物质是 ( )
A、C B、 MgO C、MgCO3 D、Mg3N2
CMg+Br2=MgBr24、镁粉在焰火、闪光粉、鞭炮中是不可缺少的
原料,工业制造镁粉是将镁蒸气在某冷却剂中冷
却,下列可作为冷却剂的是( )
①空气 ②O2 ③Ar
④H2 ⑤N2 ⑥H2O
5、三份等物质的量的金属镁分别在足量的
①氧气,②氮气,③二氧化碳中充分燃烧,
反应后所得固体质量由大到小的顺序是
(填序号) 。
Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2 Mg+Cl2↑ CaCO3 CaO+CO2↑
CaO+H2O=Ca(OH)2 CaOMg(OH)2MgCl2?6H2OMgCl2MgMg(OH)2+2HCl=MgCl2+2H2O
探究一:取一小段除去氧化膜的镁条投入盛有一定量稀盐酸的试管中;
现象:
结论或化学方程式: 镁条逐渐溶解,有大量气体产生 Mg+2HCl=MgCl2+H2↑探究二:取一小段除去氧化膜的镁条投入滴有酚酞的水中;
现象:
结论或化学方程式: 有气体产生,滴有酚酞的水溶液变红(但比钠与水反应缓和得多)探究三:取一根除去氧化膜的镁条,点燃后插入充满CO2的的集气瓶中。
现象:
结论或化学方程式: 燃着的镁条在CO2中继续燃烧,发出耀眼的白光,生成白色固体,在集气瓶的内壁有黑色固体附着四、Mg条与氮气的反应镁的性质与原子结构的关系Mg易失2e-Mg2+因此:镁很活泼,可与活泼的非金属、酸等物质反应镁的化性归纳1、与O2反应常温:生成氧化膜 (发生钝化)3、与水反应Mg+2H2O(热水)== Mg(OH)2↓+H2↑中强碱,能使酚酞变红4、与氧化物反应S+2MgO若Mg过量:5、与非氧化性酸反应:稀H2SO4 稀HCl、H3PO4Mg+2H+=Mg2++H2↑与氧化性酸发生复杂的反应(HNO3、浓H2SO4)6、与盐溶液反应(置换较不活泼的金属)Mg +Cu2+ = Mg2++Cu 镁的物性:银白色金属光泽,密度小合金:金属与金属或非金属熔合在一起形成且有金属特性的混合物特性:熔点低于任何一组分镁的主要用途:1、制合金
2、制耐火材料(MgO)熔点高
3、植物叶绿素组成成分1、海水中含的MgCl2是Mg的重要来源之一,从海水中提镁,可按如下步骤进行:
(1)将贝壳制成石灰乳
(2)在引入的海水中加入石灰乳、沉降、过滤、洗涤沉淀物
(3)将沉淀物与盐酸反应、结晶、过滤、干燥产物
(4)将产物熔融后电解
关于提取镁,下列说法中不正确的是( )
A、此法的优点之一是原料来源丰富
B、进行(1)、(2)、(3)步的目的是从海水中提取MgCl2
C、第四步会产生氯气
D、以上过程中涉及到复分解反应、化合反应和置换反应D2、分析镁在空气中的燃烧产物,肯定不存在的物质是 ( )
A、C B、 MgO C、MgCO3 D、Mg3N2
CMg+Br2=MgBr24、镁粉在焰火、闪光粉、鞭炮中是不可缺少的
原料,工业制造镁粉是将镁蒸气在某冷却剂中冷
却,下列可作为冷却剂的是( )
①空气 ②O2 ③Ar
④H2 ⑤N2 ⑥H2O
5、三份等物质的量的金属镁分别在足量的
①氧气,②氮气,③二氧化碳中充分燃烧,
反应后所得固体质量由大到小的顺序是
(填序号) 。
