化学:3.2.3《ph的应用》课件(新人教版选修4)
文档属性
| 名称 | 化学:3.2.3《ph的应用》课件(新人教版选修4) |  | |
| 格式 | rar | ||
| 文件大小 | 199.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-09-29 12:11:00 | ||
图片预览






文档简介
课件19张PPT。第二节 水的电离和溶液的酸碱性
(Ⅲ)3东外高二化学备课组 2009.9.9三、有关pH 的计算——1.简单计算(单一溶液)2、下列溶液在常温下酸性最强的是 ( )
A、pH=4的溶液
B、1L 溶液里溶有22.4mL(STP)HCl的溶液
C、c(OH-) =10-12mol/L的溶液
D、 c(H+) =10-3mol/L的溶液3、pH=0的溶液,下列叙述正确的是 ( )
A、是酸性最强的溶液 B、与0.5mol/L H2SO4溶液中c(H+)相同
C、 c(H+) =0的溶液 D、与1mol/L CH3COOH溶液中c(H+)同1、甲溶液的pH=3,乙溶液的pH=1,则甲溶液中c(H+)与乙溶液中c(H+)之比为 ( )
A、100 B、1/100 C、3 D、1/3pH相差a,c(H+)相差10aCBB4、某温度下,纯水中c(H+)=2×10-7mol/L。
则此时纯水中的c(OH-) =___________mol/L;
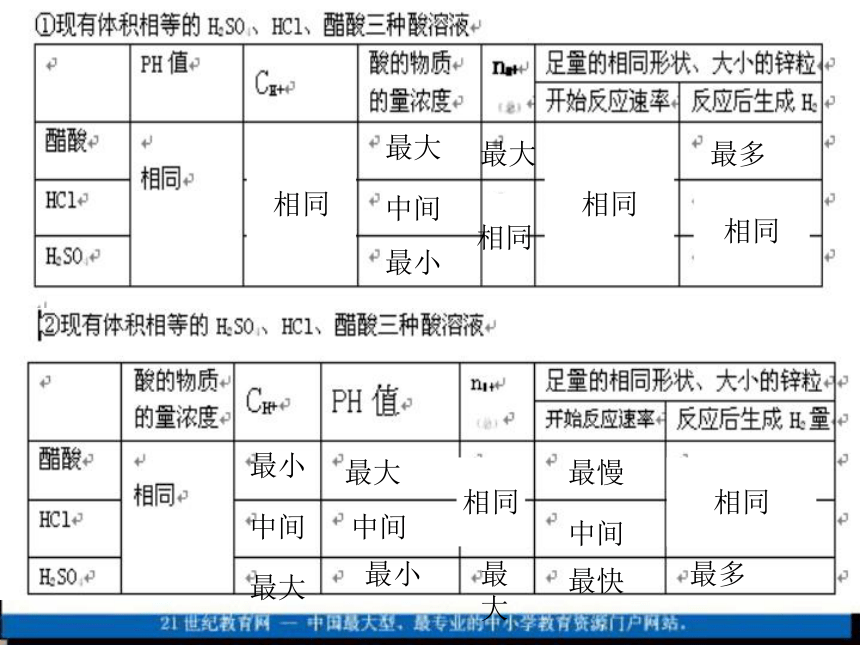
滴入盐酸使c(H+) =5 ×10-6mol/L,则c(OH-) =_________mol/L。2×10-78×10-95、0.1mol/L盐酸、硫酸、醋酸pH大小关系如何?
pH(醋酸) > pH(盐酸 ) > pH(硫酸)
pH=1 的盐酸、硫酸、醋酸中[H+]、物质的量浓度关系如何?
[H+]相等;
物质的量浓度:[弱]>[一元强]>[多元强](酸或碱均符合) 相同最大最小中间相同最大相同最多相同最大最小中间最大最小中间相同最大最慢最快中间相同最多(一)酸的稀释:
在25℃时,pH=5的盐酸稀释到原来的10倍,pH值等于多少?
如果稀释到1000倍后, pH值又等于多少呢?pH=-lg[H+]= -lg(10—5/10)=-lg10—6=6三、溶液的稀释关键:
1、抓住氢离子进行计算!
2、当酸提供的[H+]很小时,
不能忽略水电离出的[H+]
1. 将pH=5的醋酸溶液稀释。
① 稀释10倍,求pH值(范围)
(5,6)
② 要使醋酸的pH值由5 变到 6,加水稀释____10倍(填< 、> 、=)
>练习2、有相同pH的三种酸HX、HY、HZ的溶液,稀释相同倍数后,pH的变化值依次增大,则HX、HY、HZ的酸性由强到弱的顺序是 ( )
A、HX. HY. HZ B、HZ. HY. HX
C、HX. HZ. HY D、HY. HZ. HXB3、pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH值与溶液体积V的关系如图所示。下列说法正确的是:
A、B两酸溶液的物质的量浓度一定相等
稀释后,A溶液的酸性比B溶液强
a=5时,A是强酸,B是弱酸
若A、B都是弱酸,则5>a>2C、D2)、 碱的稀释 在25℃时,pH=9的NaOH溶液稀释到10倍,pH值等于多少?[OH—] =10—5/10≈10—6pH=-lg[H+]=-lgKW / [OH—]=-lg10—8=8向100mL纯水中加入1滴(0.05mL)0. 2mol/LBa(OH)2溶液,pH变为多少了?关键:
1、抓住氢氧跟离子进行计算!(先求OH-,在转换成H+ )
在25℃时,pH=9的NaOH溶液稀释到1000倍后, pH值为多少?pH=11的氨水稀释到pH=10,则NH3·H2O的电离平衡向_______方向移动,所得氨水的物质的量浓度 (填大于、小于或等于)原溶液浓度的1/10。2、当碱提供的[OH-]很小时,不能忽略水电离出的[OH-]1)强酸与强酸混合在25℃时,pH=1的盐酸溶液1L与pH=4的盐酸溶液1000L混合,混合后溶液的pH值等于多少?关键:
1、抓住氢离子进行计算!
2、当相加、减的两个量相差100倍以上时,小的可忽略三、有关pH 的计算——3.溶液的混合pH=-lg[H+]=-lg[(1×10—1+1000×10—4)/(1+1000)]=-lg[2×10—4 ]=4-lg2=3.7pH=2的盐酸和pH=4的盐酸溶液等体积混合后,所得溶液的pH= 。
pH=2的盐酸和pH=5的硫酸溶液等体积混合后,所得溶液的pH= 。两种pH值不同的强酸等体积混合时
△pH≥2时, pH混=pH小+0.3
pH=3的盐酸和pH=4的硫酸溶液体积比按1∶1混合后溶液的pH= 。△pH=1 时,pH混=pH小+0. 262.32.33.262)强碱与强碱混合例:将pH=8的氢氧化钠溶液与pH=10的氢氧化钠溶液等体积混合后,溶液中的氢离子浓度最接近于 ( )
A、 mol·L-1 B、 mol·L-1
C、(10-8+10-10)mol·L-1 D、2×10-10 mol·L-1 [OH-]=( 1 × 10—6 +1×10—4) / (1+1) ≈ 5×10-5 mol/L =10 - lg2=-lg(10-14/ 5×10-5 )= 9.7=-lg(2×10-10 )关键:抓住OH- 进行计算!再转化为H+D[H+]= =10-14/ (5×10-5 ) = 2×10-10 mol·L-1 pH值呢?2)强碱与强碱混合1、pH=13 的Ba(OH)2 溶液与pH=10的NaOH溶液体积比按1∶1混合后的pH值______。
两种pH值不同的强碱等体积混合时
△pH≥2 时, pH混=pH大 - 0.3
△pH=1 时, pH混= pH大 - 0.26 2、pH=13 的NaOH溶液与pH=12的NaOH溶液体积比按1∶1混合后的pH值______。12 . 7412 . 73)强酸与强碱混合—— 一般中和在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L
的NaOH溶液混合后,溶液的pH值等于多少?关键:酸过量抓住氢离子进行计算!NaOH+HCl=NaCl+H2O0.060.04pH=-lg[H+]= -lg0.02/ (0.1+0.1)= - lg10 -1 =1在25℃时,100ml 0.4mol/L的盐酸与等体积0.6mol/L的NaOH溶液混合后,溶液的pH值等于多少?碱过量抓住氢氧跟离子进行计算!NaOH+HCl = NaCl+H2O0.060.04pH= 13
把pH=12 的NaOH溶液V1 和 pH=2的HCl溶液V2混合后,溶液呈中性。则V1:V2= _________;
把pH=11的NaOH溶液V1 和 pH=2的HCl溶液V2混合后,溶液呈中性。则V1:V2= _________;
把pH=13 的NaOH溶液V1 和 pH=2的HCl溶液V2混合后,溶液呈中性。则V1:V2= _________; 强酸(pHa)与强碱(pHb)混合呈中性 , 体积比与pH之和(X)关系
pHa+pHb=14 ,两溶液中[H+]=[OH-],Va: Vb=1;
pHa+pHb<14 , 两溶液中 [H+]>[OH-], Va: Vb=1: 10 14-X < 1;
pHa+pHb>14,两溶液中[H+] <[OH-], Va: Vb=10X-14: 1 >1。3)强酸与强碱混合—— 规律技巧1 ∶ 110 ∶ 11 ∶ 101、 25℃时将pH=2的H2SO4溶液和pH=10的NaOH溶液相混合,混和后溶液pH=7,H2SO4溶液和NaOH溶液的体积比为 ( )
A、1∶10 B、1∶20 C、1∶9 D、1∶1002、25℃时,将某强酸和某强碱溶液按10∶1的体积比混合溶液恰好呈中性,则混合前此强酸与强碱溶液的pH之和是 ( )
A、12 B、13 C、14 D、15练习DD2、中和相同体积、相同pH值的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同物质的量浓度的盐酸的体积分别为V1、V2、V3,则三者关系为 : ( )
A、V1>V2>V3 B、V1 C、V1 反应?
醋酸过量,使得溶液呈酸性D再见
(Ⅲ)3东外高二化学备课组 2009.9.9三、有关pH 的计算——1.简单计算(单一溶液)2、下列溶液在常温下酸性最强的是 ( )
A、pH=4的溶液
B、1L 溶液里溶有22.4mL(STP)HCl的溶液
C、c(OH-) =10-12mol/L的溶液
D、 c(H+) =10-3mol/L的溶液3、pH=0的溶液,下列叙述正确的是 ( )
A、是酸性最强的溶液 B、与0.5mol/L H2SO4溶液中c(H+)相同
C、 c(H+) =0的溶液 D、与1mol/L CH3COOH溶液中c(H+)同1、甲溶液的pH=3,乙溶液的pH=1,则甲溶液中c(H+)与乙溶液中c(H+)之比为 ( )
A、100 B、1/100 C、3 D、1/3pH相差a,c(H+)相差10aCBB4、某温度下,纯水中c(H+)=2×10-7mol/L。
则此时纯水中的c(OH-) =___________mol/L;
滴入盐酸使c(H+) =5 ×10-6mol/L,则c(OH-) =_________mol/L。2×10-78×10-95、0.1mol/L盐酸、硫酸、醋酸pH大小关系如何?
pH(醋酸) > pH(盐酸 ) > pH(硫酸)
pH=1 的盐酸、硫酸、醋酸中[H+]、物质的量浓度关系如何?
[H+]相等;
物质的量浓度:[弱]>[一元强]>[多元强](酸或碱均符合) 相同最大最小中间相同最大相同最多相同最大最小中间最大最小中间相同最大最慢最快中间相同最多(一)酸的稀释:
在25℃时,pH=5的盐酸稀释到原来的10倍,pH值等于多少?
如果稀释到1000倍后, pH值又等于多少呢?pH=-lg[H+]= -lg(10—5/10)=-lg10—6=6三、溶液的稀释关键:
1、抓住氢离子进行计算!
2、当酸提供的[H+]很小时,
不能忽略水电离出的[H+]
1. 将pH=5的醋酸溶液稀释。
① 稀释10倍,求pH值(范围)
(5,6)
② 要使醋酸的pH值由5 变到 6,加水稀释____10倍(填< 、> 、=)
>练习2、有相同pH的三种酸HX、HY、HZ的溶液,稀释相同倍数后,pH的变化值依次增大,则HX、HY、HZ的酸性由强到弱的顺序是 ( )
A、HX. HY. HZ B、HZ. HY. HX
C、HX. HZ. HY D、HY. HZ. HXB3、pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH值与溶液体积V的关系如图所示。下列说法正确的是:
A、B两酸溶液的物质的量浓度一定相等
稀释后,A溶液的酸性比B溶液强
a=5时,A是强酸,B是弱酸
若A、B都是弱酸,则5>a>2C、D2)、 碱的稀释 在25℃时,pH=9的NaOH溶液稀释到10倍,pH值等于多少?[OH—] =10—5/10≈10—6pH=-lg[H+]=-lgKW / [OH—]=-lg10—8=8向100mL纯水中加入1滴(0.05mL)0. 2mol/LBa(OH)2溶液,pH变为多少了?关键:
1、抓住氢氧跟离子进行计算!(先求OH-,在转换成H+ )
在25℃时,pH=9的NaOH溶液稀释到1000倍后, pH值为多少?pH=11的氨水稀释到pH=10,则NH3·H2O的电离平衡向_______方向移动,所得氨水的物质的量浓度 (填大于、小于或等于)原溶液浓度的1/10。2、当碱提供的[OH-]很小时,不能忽略水电离出的[OH-]1)强酸与强酸混合在25℃时,pH=1的盐酸溶液1L与pH=4的盐酸溶液1000L混合,混合后溶液的pH值等于多少?关键:
1、抓住氢离子进行计算!
2、当相加、减的两个量相差100倍以上时,小的可忽略三、有关pH 的计算——3.溶液的混合pH=-lg[H+]=-lg[(1×10—1+1000×10—4)/(1+1000)]=-lg[2×10—4 ]=4-lg2=3.7pH=2的盐酸和pH=4的盐酸溶液等体积混合后,所得溶液的pH= 。
pH=2的盐酸和pH=5的硫酸溶液等体积混合后,所得溶液的pH= 。两种pH值不同的强酸等体积混合时
△pH≥2时, pH混=pH小+0.3
pH=3的盐酸和pH=4的硫酸溶液体积比按1∶1混合后溶液的pH= 。△pH=1 时,pH混=pH小+0. 262.32.33.262)强碱与强碱混合例:将pH=8的氢氧化钠溶液与pH=10的氢氧化钠溶液等体积混合后,溶液中的氢离子浓度最接近于 ( )
A、 mol·L-1 B、 mol·L-1
C、(10-8+10-10)mol·L-1 D、2×10-10 mol·L-1 [OH-]=( 1 × 10—6 +1×10—4) / (1+1) ≈ 5×10-5 mol/L =10 - lg2=-lg(10-14/ 5×10-5 )= 9.7=-lg(2×10-10 )关键:抓住OH- 进行计算!再转化为H+D[H+]= =10-14/ (5×10-5 ) = 2×10-10 mol·L-1 pH值呢?2)强碱与强碱混合1、pH=13 的Ba(OH)2 溶液与pH=10的NaOH溶液体积比按1∶1混合后的pH值______。
两种pH值不同的强碱等体积混合时
△pH≥2 时, pH混=pH大 - 0.3
△pH=1 时, pH混= pH大 - 0.26 2、pH=13 的NaOH溶液与pH=12的NaOH溶液体积比按1∶1混合后的pH值______。12 . 7412 . 73)强酸与强碱混合—— 一般中和在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L
的NaOH溶液混合后,溶液的pH值等于多少?关键:酸过量抓住氢离子进行计算!NaOH+HCl=NaCl+H2O0.060.04pH=-lg[H+]= -lg0.02/ (0.1+0.1)= - lg10 -1 =1在25℃时,100ml 0.4mol/L的盐酸与等体积0.6mol/L的NaOH溶液混合后,溶液的pH值等于多少?碱过量抓住氢氧跟离子进行计算!NaOH+HCl = NaCl+H2O0.060.04pH= 13
把pH=12 的NaOH溶液V1 和 pH=2的HCl溶液V2混合后,溶液呈中性。则V1:V2= _________;
把pH=11的NaOH溶液V1 和 pH=2的HCl溶液V2混合后,溶液呈中性。则V1:V2= _________;
把pH=13 的NaOH溶液V1 和 pH=2的HCl溶液V2混合后,溶液呈中性。则V1:V2= _________; 强酸(pHa)与强碱(pHb)混合呈中性 , 体积比与pH之和(X)关系
pHa+pHb=14 ,两溶液中[H+]=[OH-],Va: Vb=1;
pHa+pHb<14 , 两溶液中 [H+]>[OH-], Va: Vb=1: 10 14-X < 1;
pHa+pHb>14,两溶液中[H+] <[OH-], Va: Vb=10X-14: 1 >1。3)强酸与强碱混合—— 规律技巧1 ∶ 110 ∶ 11 ∶ 101、 25℃时将pH=2的H2SO4溶液和pH=10的NaOH溶液相混合,混和后溶液pH=7,H2SO4溶液和NaOH溶液的体积比为 ( )
A、1∶10 B、1∶20 C、1∶9 D、1∶1002、25℃时,将某强酸和某强碱溶液按10∶1的体积比混合溶液恰好呈中性,则混合前此强酸与强碱溶液的pH之和是 ( )
A、12 B、13 C、14 D、15练习DD2、中和相同体积、相同pH值的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同物质的量浓度的盐酸的体积分别为V1、V2、V3,则三者关系为 : ( )
A、V1>V2>V3 B、V1
醋酸过量,使得溶液呈酸性D再见
