化学:3.2.1《水的电离》课件(新人教版选修4)
文档属性
| 名称 | 化学:3.2.1《水的电离》课件(新人教版选修4) |  | |
| 格式 | rar | ||
| 文件大小 | 181.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-09-29 12:11:00 | ||
图片预览





文档简介
课件13张PPT。1第二节 水的电离和溶液的酸碱性
(Ⅰ)2019/2/26一、水的电离H2O + H2O H3O+ + OH-[定性讨论]
纯水中有哪些微粒?
H2O 、 H+ 、 OH-
作为弱电解质,水的电离平衡受哪些外界因素影响?
温度、离子浓度(H+、OH-)等影响[定量讨论]阅读教材P45
思考1:纯水中c(H+)与c(OH-)大小有何关系?
思考2:在25℃下, c(H+) 、 c(OH-)等于多少?
说明水的电离程度如何?
由水电离出的H+、OH-的物质的量相等 25℃时,水电离出来的 c(H+) = c(OH-)=10-7mol/L
水是一种极弱的电解质(通常的电流表无法检验其中离子)。 室温下 1L(55.6mol)水中,只有10—7mol 水发生电离
55.6 :10—7 = n :1 n = 55.6×107KW——水的离子积常数例、水是一种极弱的电解质,在室温下,平均每n个分子只有1个分子发生电离,则n值是:
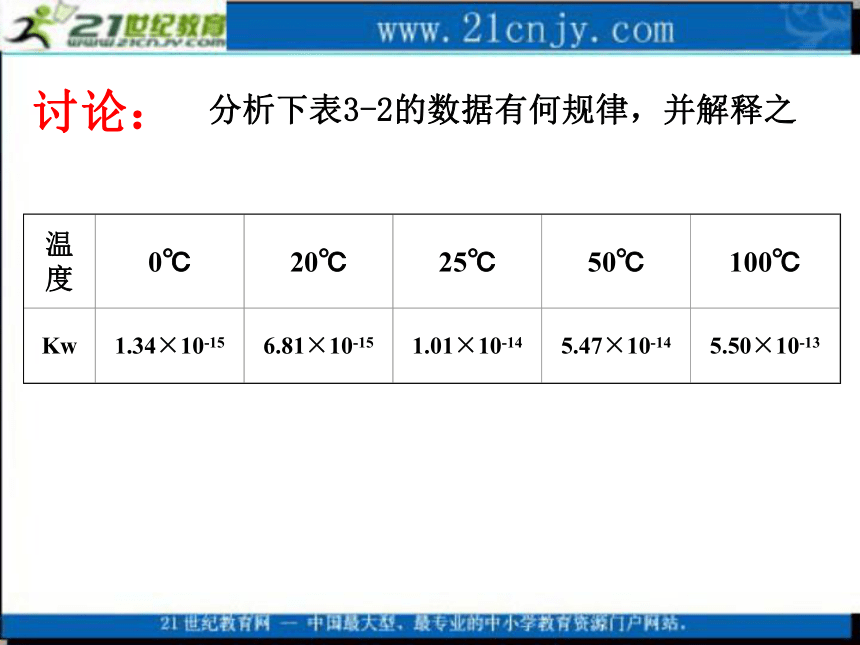
A、10-14 B、55.6×107 C、107 D、55.61.水是一种极弱的电解质,能微弱的电离:c(H+) . c(OH-) = K 电离×c(H2O) = Kw分析下表3-2的数据有何规律,并解释之 讨论:2.水的离子积常数Kw= c(H+) . c(OH-)1)表达式:注:常数无单位KW 叫做水的离子积常数,简称水的离子积。2)影响KW的因素KW只与温度有关(与浓度无关):温度升高, KW值增大任何水溶液中都存在Kw = c(H+) . c(OH-)
如:KW25℃ = 1.0×10-14
KW100℃= 55.0×10-14 25℃ 时纯水 KW = c(H+) . c(OH-) =1.0×10—14讨论:对常温下的纯水进行下列操作,完成下表: 中性→↑↑=↑酸性←↑↓>不变碱性←↓↑<不变小结:加入酸或碱都抑制水的电离☆升高温度,Kw增大。
☆温度不变,加入溶质对水的电离平衡及KW的影响。
加入酸或碱对水的电离有什么影响?(促进还是抑制?)
加入酸或碱对Kw有什么影响呢?
酸碱由于电离产生H+或OH-,能抑制水的电离,使水的电离程度减小,但KW不变。练习:水的电离平衡的移动← ↑ ↓ —
→ ↓ ↑ —
— — — —
→ ↑ ↑ ↑2.水的电离过程为H2O H+ + OH-,在不同温度下其离子积为 :
KW25℃=1×10-14, KW35℃ =2.1 ×10-14。
则下列叙述正确的是:
A、c(H+)随着温度的升高而降低
B、在35℃时,纯水中 c(H+) >c(OH-)
C、水的电离常数K25 ℃ >K35 ℃
D、水的电离是一个吸热过程D3.判断正误:
①任何水溶液中都存在水的电离平衡。
②任何水溶液中(不论酸、碱或中性) 都存 在Kw=10-14 。
√×4.思考讨论(25度时)
1)0.01mol/L盐酸溶液中。c(H+)、 c(OH-)分别为多少?由水电离出的c(H+) H2O、 c(OH-) H2O分别是多少?为什么?
2)0.01mol/L NaOH溶液中。 c(H+) 、 c(OH-)分别为多少?由水电离出的c(H+) H2O、 c(OH-) H2O分别是多少?为什么?
任何水溶液中由水电离出来的
c(H+) H2O与 c(OH-) H2O相等 计算
1、某溶液中由水电离产生的c(H+) H2O= 10-12 mol/L ,则该溶液呈酸性还是碱性?并求算该溶液中 c(H+)的可能值 ?2、浓度均为0.1mol/L的下列溶液中由水电离出的c(H+) H2O大小关系为:①盐酸 ②醋酸溶液 ③硫酸溶液
④氢氧化钠溶液 解答: c(H+) H2O= c(OH-) H2O= 10-12 mol/L
若c(H+) aq= c(H+) H2O= 10-12 mol/L 则 c(OH-) aq= 10-2 mol/L 溶液显碱性
若c(OH-) aq= c(OH-) H2O= 10-12 mol/L 则 c(H+) aq= 10-2 mol/L 溶液显酸性② > ① =④ > ③
(Ⅰ)2019/2/26一、水的电离H2O + H2O H3O+ + OH-[定性讨论]
纯水中有哪些微粒?
H2O 、 H+ 、 OH-
作为弱电解质,水的电离平衡受哪些外界因素影响?
温度、离子浓度(H+、OH-)等影响[定量讨论]阅读教材P45
思考1:纯水中c(H+)与c(OH-)大小有何关系?
思考2:在25℃下, c(H+) 、 c(OH-)等于多少?
说明水的电离程度如何?
由水电离出的H+、OH-的物质的量相等 25℃时,水电离出来的 c(H+) = c(OH-)=10-7mol/L
水是一种极弱的电解质(通常的电流表无法检验其中离子)。 室温下 1L(55.6mol)水中,只有10—7mol 水发生电离
55.6 :10—7 = n :1 n = 55.6×107KW——水的离子积常数例、水是一种极弱的电解质,在室温下,平均每n个分子只有1个分子发生电离,则n值是:
A、10-14 B、55.6×107 C、107 D、55.61.水是一种极弱的电解质,能微弱的电离:c(H+) . c(OH-) = K 电离×c(H2O) = Kw分析下表3-2的数据有何规律,并解释之 讨论:2.水的离子积常数Kw= c(H+) . c(OH-)1)表达式:注:常数无单位KW 叫做水的离子积常数,简称水的离子积。2)影响KW的因素KW只与温度有关(与浓度无关):温度升高, KW值增大任何水溶液中都存在Kw = c(H+) . c(OH-)
如:KW25℃ = 1.0×10-14
KW100℃= 55.0×10-14 25℃ 时纯水 KW = c(H+) . c(OH-) =1.0×10—14讨论:对常温下的纯水进行下列操作,完成下表: 中性→↑↑=↑酸性←↑↓>不变碱性←↓↑<不变小结:加入酸或碱都抑制水的电离☆升高温度,Kw增大。
☆温度不变,加入溶质对水的电离平衡及KW的影响。
加入酸或碱对水的电离有什么影响?(促进还是抑制?)
加入酸或碱对Kw有什么影响呢?
酸碱由于电离产生H+或OH-,能抑制水的电离,使水的电离程度减小,但KW不变。练习:水的电离平衡的移动← ↑ ↓ —
→ ↓ ↑ —
— — — —
→ ↑ ↑ ↑2.水的电离过程为H2O H+ + OH-,在不同温度下其离子积为 :
KW25℃=1×10-14, KW35℃ =2.1 ×10-14。
则下列叙述正确的是:
A、c(H+)随着温度的升高而降低
B、在35℃时,纯水中 c(H+) >c(OH-)
C、水的电离常数K25 ℃ >K35 ℃
D、水的电离是一个吸热过程D3.判断正误:
①任何水溶液中都存在水的电离平衡。
②任何水溶液中(不论酸、碱或中性) 都存 在Kw=10-14 。
√×4.思考讨论(25度时)
1)0.01mol/L盐酸溶液中。c(H+)、 c(OH-)分别为多少?由水电离出的c(H+) H2O、 c(OH-) H2O分别是多少?为什么?
2)0.01mol/L NaOH溶液中。 c(H+) 、 c(OH-)分别为多少?由水电离出的c(H+) H2O、 c(OH-) H2O分别是多少?为什么?
任何水溶液中由水电离出来的
c(H+) H2O与 c(OH-) H2O相等 计算
1、某溶液中由水电离产生的c(H+) H2O= 10-12 mol/L ,则该溶液呈酸性还是碱性?并求算该溶液中 c(H+)的可能值 ?2、浓度均为0.1mol/L的下列溶液中由水电离出的c(H+) H2O大小关系为:①盐酸 ②醋酸溶液 ③硫酸溶液
④氢氧化钠溶液 解答: c(H+) H2O= c(OH-) H2O= 10-12 mol/L
若c(H+) aq= c(H+) H2O= 10-12 mol/L 则 c(OH-) aq= 10-2 mol/L 溶液显碱性
若c(OH-) aq= c(OH-) H2O= 10-12 mol/L 则 c(H+) aq= 10-2 mol/L 溶液显酸性② > ① =④ > ③
