化学:3.1.2《弱电解质的电离》课件(新人教版选修4)
文档属性
| 名称 | 化学:3.1.2《弱电解质的电离》课件(新人教版选修4) |  | |
| 格式 | rar | ||
| 文件大小 | 140.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-09-29 12:11:00 | ||
图片预览




文档简介
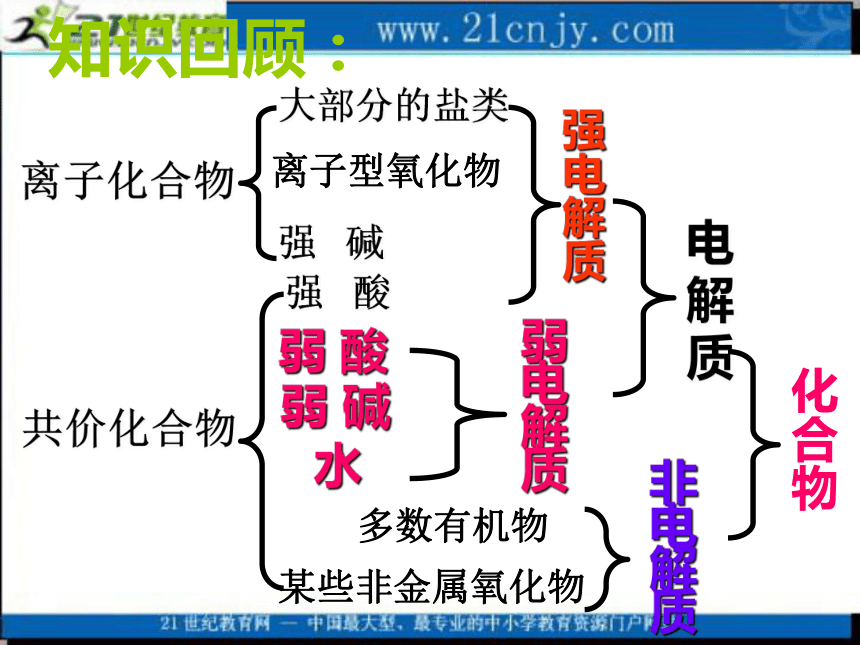
课件11张PPT。第三章 水溶液中的离子平衡§3-1 弱电解质的电离(第二课时)知识回顾:一、强弱电解质强电解质:在水溶液中能全部电离成离子的电解质。弱电解质:在水溶液中只部分电离成离子的电解质。二、弱电解质的电离平衡 1.定义2.特点3.影响电离平衡的因素
4、电离方程式的书写强电解质在溶液中完全电离,用“=”
弱电解质在溶液中部分电离,用“ ”
多元弱酸的电离 应分步完成电离方程式,多元弱碱则一步完成电离方程式。NaCl = Na++Cl-强等号、弱可逆、多元弱酸分步写 1. 请写出Na2SO4、HClO、NH3·H2O 、H2CO3、Fe(OH)3在水溶液中的电离方程式。
Na2SO4 = 2Na+ +SO42-HClO H++ClO-NH3·H2O NH4++OH-H2CO3 H++HCO3-HCO3- H++CO32-Fe(OH)3 Fe3++3OH-【课堂练习】对于一元弱酸 HA H++A-对于一元弱碱 BOH B++OH-注意:K值只随温度变化。探究实验:[实验3-2] 课本P42
你能否推测CH3COOH、H3BO3、H2CO3三种弱酸的相对强弱,及其与电离常数大小的关系?写出H3PO4在水溶液中的电离方程式。H3PO4H+ + H2PO4-H2PO4-H+ + HPO42-HPO42-H+ + PO43-你推测每一步的电离程度如何变化,为什么?多元弱酸是分步电离的,K1》K2》K3
多元弱酸的酸性由第一步电离决定。试根据课本P42中“一些弱酸和弱碱的电离平衡常数”比较它们的相对强弱。草酸>磷酸>柠檬酸>碳酸 意义:K值越大,电离程度越大,相应酸 (或碱)的酸(或碱)性越强。2、填表:0.1mol/L的CH3COOH溶液
CH3COOH CH3COO-+H+【课堂练习】增大增大减小减弱不变增大增大增大增强增大减小减小减小增强不变减小增大增大增强不变增大减小减小增强不变 祝
同学们
学习进步!
4、电离方程式的书写强电解质在溶液中完全电离,用“=”
弱电解质在溶液中部分电离,用“ ”
多元弱酸的电离 应分步完成电离方程式,多元弱碱则一步完成电离方程式。NaCl = Na++Cl-强等号、弱可逆、多元弱酸分步写 1. 请写出Na2SO4、HClO、NH3·H2O 、H2CO3、Fe(OH)3在水溶液中的电离方程式。
Na2SO4 = 2Na+ +SO42-HClO H++ClO-NH3·H2O NH4++OH-H2CO3 H++HCO3-HCO3- H++CO32-Fe(OH)3 Fe3++3OH-【课堂练习】对于一元弱酸 HA H++A-对于一元弱碱 BOH B++OH-注意:K值只随温度变化。探究实验:[实验3-2] 课本P42
你能否推测CH3COOH、H3BO3、H2CO3三种弱酸的相对强弱,及其与电离常数大小的关系?写出H3PO4在水溶液中的电离方程式。H3PO4H+ + H2PO4-H2PO4-H+ + HPO42-HPO42-H+ + PO43-你推测每一步的电离程度如何变化,为什么?多元弱酸是分步电离的,K1》K2》K3
多元弱酸的酸性由第一步电离决定。试根据课本P42中“一些弱酸和弱碱的电离平衡常数”比较它们的相对强弱。草酸>磷酸>柠檬酸>碳酸 意义:K值越大,电离程度越大,相应酸 (或碱)的酸(或碱)性越强。2、填表:0.1mol/L的CH3COOH溶液
CH3COOH CH3COO-+H+【课堂练习】增大增大减小减弱不变增大增大增大增强增大减小减小减小增强不变减小增大增大增强不变增大减小减小增强不变 祝
同学们
学习进步!
