化学:2.4《化学反应进行的方向》课件(1)(新人教版选修4)
文档属性
| 名称 | 化学:2.4《化学反应进行的方向》课件(1)(新人教版选修4) |

|
|
| 格式 | rar | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-09-29 00:00:00 | ||
图片预览







文档简介
课件26张PPT。高山流水冰雪融化花开花谢自发过程和非自发过程自发过程:
自然界中水总是从高处往地处流;
电流总是从电位高的地方向电位低的地方流动;
室温下冰块自动融化;
墨水扩散;
食盐溶解于水。自发反应:
镁条燃烧:Mg(s)+O2(g)=MgO(s)
酸碱中和:H++OH-=H2O
铁器暴露在潮湿空气中会生锈:3Fe(s)+3/2O2(g)=Fe2O3(s)
甲烷和氧气的混合气体遇明火就燃烧:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)自发过程:
在一定条件下,不借助外部力量就能自动进行的过程。
自发反应:
在一定温度、压强下,不借助(光、电能等)外部力量即能进行,或具有发生的可能性的反应称为自发反应。自发反应是从属于自发过程的,是属于自发过程的一部分。那么我们该如何判断一个过程,一个反应能否自发进行呢?一个过程或者一个反应要自发的进行是否要符合什么条件呢?【探究】以“物体由高处自由下落”为代表,探究自发过程中有哪些变化趋势。自然界中水总是从高处往地处流;
电流总是从电位高的地方向电位低的地方流动;
室温下冰块自动融化;观察下列几个自发进行的化学反应,找出它们的共同之处
钠与水反应2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)△H=-368 kJ/mol
(2)铁生锈:3Fe (s)+3/2O2 (g)=Fe2O3 (s) △H=-824 kJ/mol
(3)氢气和氧气反应:2H2(g)+O2(g)=2H2O(l ) △H=-571.6kJ/mol共同点:△H<0,放热反应,高能向低能转化。共同点:高能向低能转化。一、反应焓变与反应方向 :注意:
(1)焓判据只能用于判断过程的方向,能否实现要看具体条件;
(2)焓判据只判断一定条件化学反应能否自发进行,与化学反应速率无关。
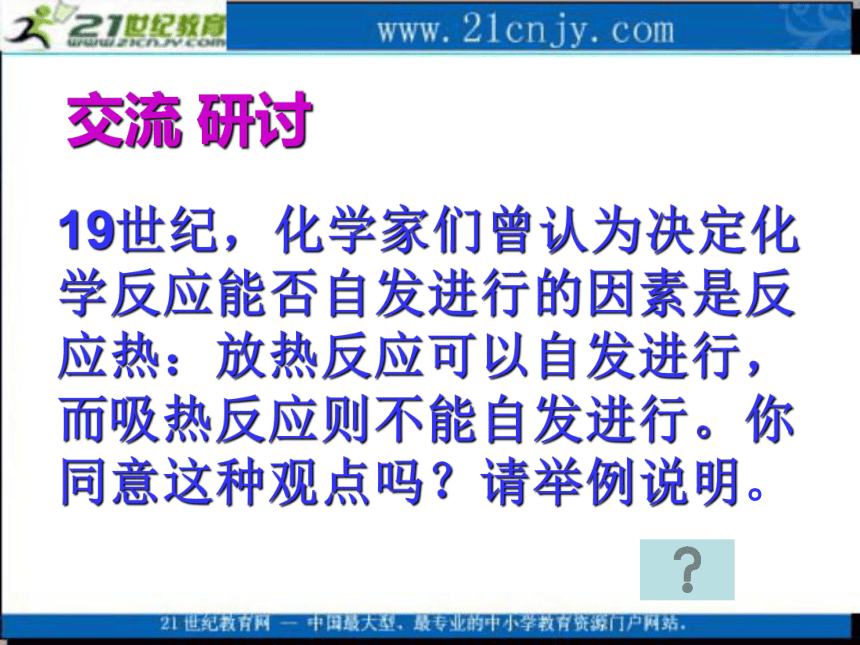
(3)反应焓变是反应能否自发进行的一个因素,但不是唯一因素 自发过程的体系取向于从高能状态转变为低能状态(这时体系会对外部做功或释放热量,焓变小于0),这一经验规律就是焓判据,是判断化学反应进行方向的判据之一。交流 研讨19世纪,化学家们曾认为决定化学反应能否自发进行的因素是反应热:放热反应可以自发进行,而吸热反应则不能自发进行。你同意这种观点吗?请举例说明。
举例:总结:焓变作为判断反应自发性的依据:
若 △H<0,正向反应能自发进行;若△H>0,
正向反应不能自发进行,而逆向反应能自
发进行。墨水滴入水中
气体的扩散固体的溶解一副崭新的扑克牌被洗过后会怎样?
如果没有法律的制约,世界会怎样?
下课铃一响教室里会怎样?
你能发现这些看似不相干的事件之间的联系吗?克劳修斯 (德国)
熵S二、熵(S):
1.描述体系混乱度的物理量
2.符号:S 单位:J?mol-1?K-1 3.大小判据:
(1)物质的混乱度:体系混乱度越大,熵值越大;
(2)同一条件:不同物质的熵值不同;
(3)物质的存在状态:S(g) > S(l) > S(s)。 标准状况下:1mol不同物质的熵S(Jmol-1K-1) 4.反应熵变:反应产物的总熵与反应物总熵之差
(1)符号:△S
(2)表达式:△S =∑S(生成物) – ∑S (反应物)
(3)正负判断:
①气体体积增大的反应,△S>0,熵增加反应
②气体体积减小的反应,△S<0,熵减小反应 练习:判断下列反应熵变大小:
1、N2+3H2=2NH3
2、2C+O2=2CO
3、CaCO3=CaO+CO2
△S<0△S<0△S>01、冰→ 液态水 → 水蒸气
2、氯化钠晶体溶于水
3、自发进行的吸热反应:
N2O5分解:
2N2O5(g) =4NO2(g)+O2(g)??? △H=+56.7kJ/mol
碳酸铵的分解: (NH4 )2CO3(s)=NH4HCO3(s)+NH3(g)??? △H=+74.9 kJ/mol共同点:熵(S)增加【探究】下列自发过程熵变的特点注意:
(1)熵变只是反应能否自发进行的一种因素;
(2)熵变(△S)只决定于体系的始态和终态,与变化的途径无关;
(3)熵判据只判断一定条件化学反应能否自发进行,与化学反应速率无关。 总结:自发过程的两大变化趋势:
(1)能量趋于减小(焓减)
(2)混乱度趋于增大(熵增)三、反应熵变与反应方向:
??????? 在与外界隔离的体系中,自发过程将导致体系的熵增大,这一经验规律叫做熵增原理。是在用来判断化学反应方向时就称为熵判据 练习:
1.能用能量判据判断下列过程的方向的是( )
A. 水总是自发的由高处往低处流
B. 放热反应容易自发进行,吸热反应不能自发进行
C. 有序排列的火柴散落时成为无序排列
D. 多次洗牌后,扑克牌的毫无规律的混乱排列的几率大
2.已知石墨、金刚石燃烧的热化学方程式分别为:
C(石墨,s)+O2(g)=CO2 (g)
△H=-393.5kJ/mol
C(金刚石,s)+O2 (g) =CO2 (g)
△H=-395.4kJ/mol
关于金刚石和石墨的相互转化,下列说法正确的是( )
A.石墨转化为金刚石是自发进行的过程
B.金刚石转化为石墨是自发进行的过程
C.石墨比金刚石能量低
D.金刚石比石墨能量低
ABC3.下列过程属于熵增加的是( )
A.固体的溶解过程
B.气体扩散过程
C.水蒸气变为液态水
D.CO(g)+2H2(g)=CH3OH(g)
4.下列说法中,正确的是( )
A.自发反应一定是熵增大,非自发反应一定是熵减小或不变
B.自发反应在恰当条件下才能实现
C.自发反应在任何条件下均能实现
D. 同一物质的固、液、气三种状态的熵值相同
5.下列反应中在高温下不能自发进行的是( )
A.CO(g)=C(s) +I/2O2(g)
B.2N2O5(g)=4NO2(g)+O2(g)
C.(NH4) 2CO3(s)=NH4HCO3(s)+NH3(g)
D.MgCO3(s)=MgO(s)+CO2(g)ABBA举例:科学家们总结出了一条公式△G= △H-T △S,△G代表的是自由能,用自由能来判断反应进行的方向是最全面最科学的,当△G<0时,反应就可以自发进行 任何温度都自发进行不能自发进行较低温度时自发进行高温时自发进行总结:四、焓变与熵变对反应方向的共同影响
1.判据:△H-T△S
2.判据与反应的自发性:
< 0 反应自发进行
△H-T△S = 0 反应达平衡状态
> 0 反应不能自发进行
3.适用判据应注意的问题:
(1)判断反应的自发性要结合△H和△S,
利用△H-T△S
(2)条件是一定温度、压强下
(3)反应具有自发性,只能说明这个反应有进行的趋势,但这个反应到底能不能反应,那还要看反应进行的限度和反应进行的速率。1.下列说法完全正确的是( )
A.放热反应均是自发反应
B.ΔS为正值的反应均是自发反应
C.物质的量增加的反应,ΔS为正值
D.如果ΔH和ΔS均为正值,当温度升高时,反应可能
自发进行
2.下列反应中,ΔS最大的是( )
A.CaCO3(s)=CaO(s)+CO2(g)
B.2SO2(g)+O2(g)=2SO3(g)
C.N2(g)+3H2(g)=2NH3(g)
D.CuSO4(s)+5H2O(l)=CuSO4?5H2O(s)
3.某反应2AB(g)=C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
A.ΔH < 0,ΔS > 0 B. ΔH < 0,ΔS <0
C. ΔH > 0,ΔS > 0 D. ΔH > 0,ΔS < 0DAC69.9Jmol-1K-147.9Jmol-1K-1188.7Jmol-1K-1S(g)>S(l)>S(s)三种状态下水的熵 冰 水 水蒸气
自然界中水总是从高处往地处流;
电流总是从电位高的地方向电位低的地方流动;
室温下冰块自动融化;
墨水扩散;
食盐溶解于水。自发反应:
镁条燃烧:Mg(s)+O2(g)=MgO(s)
酸碱中和:H++OH-=H2O
铁器暴露在潮湿空气中会生锈:3Fe(s)+3/2O2(g)=Fe2O3(s)
甲烷和氧气的混合气体遇明火就燃烧:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)自发过程:
在一定条件下,不借助外部力量就能自动进行的过程。
自发反应:
在一定温度、压强下,不借助(光、电能等)外部力量即能进行,或具有发生的可能性的反应称为自发反应。自发反应是从属于自发过程的,是属于自发过程的一部分。那么我们该如何判断一个过程,一个反应能否自发进行呢?一个过程或者一个反应要自发的进行是否要符合什么条件呢?【探究】以“物体由高处自由下落”为代表,探究自发过程中有哪些变化趋势。自然界中水总是从高处往地处流;
电流总是从电位高的地方向电位低的地方流动;
室温下冰块自动融化;观察下列几个自发进行的化学反应,找出它们的共同之处
钠与水反应2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)△H=-368 kJ/mol
(2)铁生锈:3Fe (s)+3/2O2 (g)=Fe2O3 (s) △H=-824 kJ/mol
(3)氢气和氧气反应:2H2(g)+O2(g)=2H2O(l ) △H=-571.6kJ/mol共同点:△H<0,放热反应,高能向低能转化。共同点:高能向低能转化。一、反应焓变与反应方向 :注意:
(1)焓判据只能用于判断过程的方向,能否实现要看具体条件;
(2)焓判据只判断一定条件化学反应能否自发进行,与化学反应速率无关。
(3)反应焓变是反应能否自发进行的一个因素,但不是唯一因素 自发过程的体系取向于从高能状态转变为低能状态(这时体系会对外部做功或释放热量,焓变小于0),这一经验规律就是焓判据,是判断化学反应进行方向的判据之一。交流 研讨19世纪,化学家们曾认为决定化学反应能否自发进行的因素是反应热:放热反应可以自发进行,而吸热反应则不能自发进行。你同意这种观点吗?请举例说明。
举例:总结:焓变作为判断反应自发性的依据:
若 △H<0,正向反应能自发进行;若△H>0,
正向反应不能自发进行,而逆向反应能自
发进行。墨水滴入水中
气体的扩散固体的溶解一副崭新的扑克牌被洗过后会怎样?
如果没有法律的制约,世界会怎样?
下课铃一响教室里会怎样?
你能发现这些看似不相干的事件之间的联系吗?克劳修斯 (德国)
熵S二、熵(S):
1.描述体系混乱度的物理量
2.符号:S 单位:J?mol-1?K-1 3.大小判据:
(1)物质的混乱度:体系混乱度越大,熵值越大;
(2)同一条件:不同物质的熵值不同;
(3)物质的存在状态:S(g) > S(l) > S(s)。 标准状况下:1mol不同物质的熵S(Jmol-1K-1) 4.反应熵变:反应产物的总熵与反应物总熵之差
(1)符号:△S
(2)表达式:△S =∑S(生成物) – ∑S (反应物)
(3)正负判断:
①气体体积增大的反应,△S>0,熵增加反应
②气体体积减小的反应,△S<0,熵减小反应 练习:判断下列反应熵变大小:
1、N2+3H2=2NH3
2、2C+O2=2CO
3、CaCO3=CaO+CO2
△S<0△S<0△S>01、冰→ 液态水 → 水蒸气
2、氯化钠晶体溶于水
3、自发进行的吸热反应:
N2O5分解:
2N2O5(g) =4NO2(g)+O2(g)??? △H=+56.7kJ/mol
碳酸铵的分解: (NH4 )2CO3(s)=NH4HCO3(s)+NH3(g)??? △H=+74.9 kJ/mol共同点:熵(S)增加【探究】下列自发过程熵变的特点注意:
(1)熵变只是反应能否自发进行的一种因素;
(2)熵变(△S)只决定于体系的始态和终态,与变化的途径无关;
(3)熵判据只判断一定条件化学反应能否自发进行,与化学反应速率无关。 总结:自发过程的两大变化趋势:
(1)能量趋于减小(焓减)
(2)混乱度趋于增大(熵增)三、反应熵变与反应方向:
??????? 在与外界隔离的体系中,自发过程将导致体系的熵增大,这一经验规律叫做熵增原理。是在用来判断化学反应方向时就称为熵判据 练习:
1.能用能量判据判断下列过程的方向的是( )
A. 水总是自发的由高处往低处流
B. 放热反应容易自发进行,吸热反应不能自发进行
C. 有序排列的火柴散落时成为无序排列
D. 多次洗牌后,扑克牌的毫无规律的混乱排列的几率大
2.已知石墨、金刚石燃烧的热化学方程式分别为:
C(石墨,s)+O2(g)=CO2 (g)
△H=-393.5kJ/mol
C(金刚石,s)+O2 (g) =CO2 (g)
△H=-395.4kJ/mol
关于金刚石和石墨的相互转化,下列说法正确的是( )
A.石墨转化为金刚石是自发进行的过程
B.金刚石转化为石墨是自发进行的过程
C.石墨比金刚石能量低
D.金刚石比石墨能量低
ABC3.下列过程属于熵增加的是( )
A.固体的溶解过程
B.气体扩散过程
C.水蒸气变为液态水
D.CO(g)+2H2(g)=CH3OH(g)
4.下列说法中,正确的是( )
A.自发反应一定是熵增大,非自发反应一定是熵减小或不变
B.自发反应在恰当条件下才能实现
C.自发反应在任何条件下均能实现
D. 同一物质的固、液、气三种状态的熵值相同
5.下列反应中在高温下不能自发进行的是( )
A.CO(g)=C(s) +I/2O2(g)
B.2N2O5(g)=4NO2(g)+O2(g)
C.(NH4) 2CO3(s)=NH4HCO3(s)+NH3(g)
D.MgCO3(s)=MgO(s)+CO2(g)ABBA举例:科学家们总结出了一条公式△G= △H-T △S,△G代表的是自由能,用自由能来判断反应进行的方向是最全面最科学的,当△G<0时,反应就可以自发进行 任何温度都自发进行不能自发进行较低温度时自发进行高温时自发进行总结:四、焓变与熵变对反应方向的共同影响
1.判据:△H-T△S
2.判据与反应的自发性:
< 0 反应自发进行
△H-T△S = 0 反应达平衡状态
> 0 反应不能自发进行
3.适用判据应注意的问题:
(1)判断反应的自发性要结合△H和△S,
利用△H-T△S
(2)条件是一定温度、压强下
(3)反应具有自发性,只能说明这个反应有进行的趋势,但这个反应到底能不能反应,那还要看反应进行的限度和反应进行的速率。1.下列说法完全正确的是( )
A.放热反应均是自发反应
B.ΔS为正值的反应均是自发反应
C.物质的量增加的反应,ΔS为正值
D.如果ΔH和ΔS均为正值,当温度升高时,反应可能
自发进行
2.下列反应中,ΔS最大的是( )
A.CaCO3(s)=CaO(s)+CO2(g)
B.2SO2(g)+O2(g)=2SO3(g)
C.N2(g)+3H2(g)=2NH3(g)
D.CuSO4(s)+5H2O(l)=CuSO4?5H2O(s)
3.某反应2AB(g)=C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
A.ΔH < 0,ΔS > 0 B. ΔH < 0,ΔS <0
C. ΔH > 0,ΔS > 0 D. ΔH > 0,ΔS < 0DAC69.9Jmol-1K-147.9Jmol-1K-1188.7Jmol-1K-1S(g)>S(l)>S(s)三种状态下水的熵 冰 水 水蒸气
