化学平衡图像
图片预览




文档简介
课件29张PPT。I.恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(气)+B(气)C(气)(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物
质的量为 mol。(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分
别是ymol和3a mol,则x= mol,y= mol
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的
量分数是 。II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中
发生上述反应。(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的
a进行比较 (选填一个编号)。(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。(1-a) 3a 2 3-3a 丁 因为(5)小题中容器容积不变,而(1)小题中容器
的容积缩小,所以(5)小题的容器中的压力小于(1)
小题容器中的压力,有利于逆向反应,故反应达到平衡
后a>b。乙 若3a>1,B的物质的量小于2mol;
若3a=1 ,B的物质的量等于2mol;
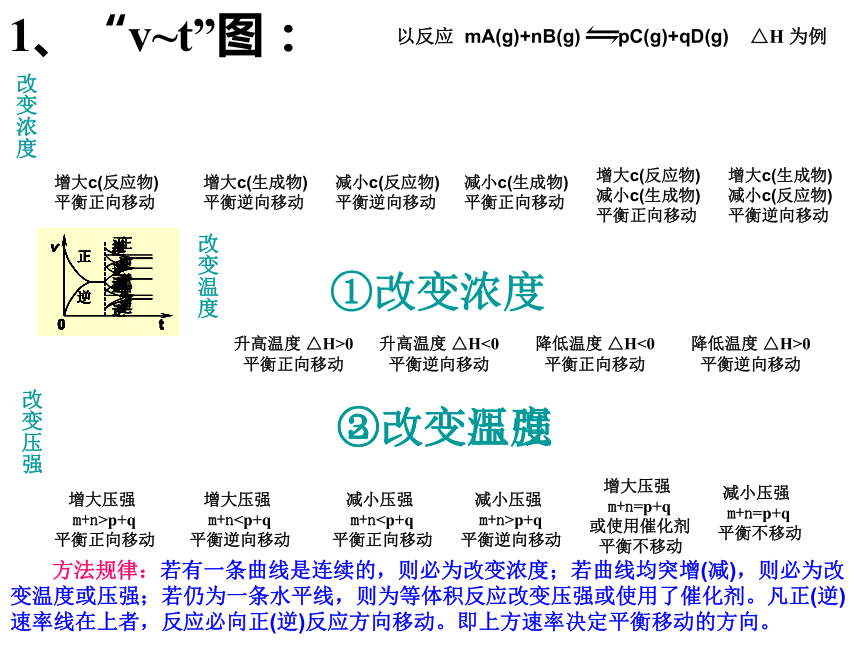
若3a<1,B的物质的量大于2mol思考?化学平衡图像一.图像类型增大c(反应物)
平衡正向移动增大c(生成物)
平衡逆向移动减小c(反应物)
平衡逆向移动减小c(生成物)
平衡正向移动增大c(反应物)
减小c(生成物)
平衡正向移动增大c(生成物)
减小c(反应物)
平衡逆向移动以反应 mA(g)+nB(g) pC(g)+qD(g) △H 为例升高温度 △H>0
平衡正向移动升高温度 △H<0
平衡逆向移动降低温度 △H<0
平衡正向移动降低温度 △H>0
平衡逆向移动 增大压强
m+n>p+q
平衡正向移动 增大压强
m+n平衡逆向移动 减小压强
m+n平衡正向移动 减小压强
m+n>p+q
平衡逆向移动 增大压强
m+n=p+q
或使用催化剂
平衡不移动 减小压强
m+n=p+q
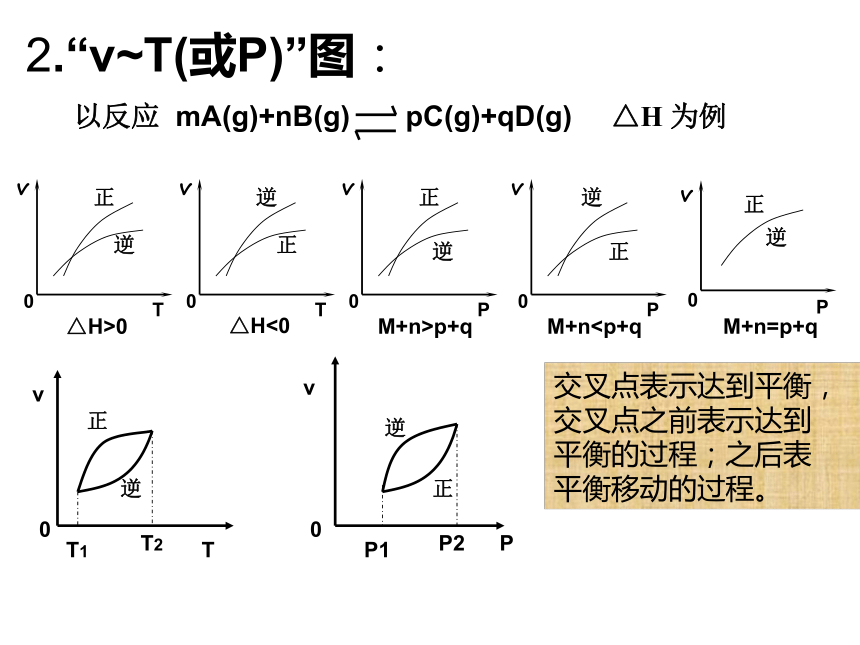
平衡不移动 方法规律:若有一条曲线是连续的,则必为改变浓度;若曲线均突增(减),则必为改变温度或压强;若仍为一条水平线,则为等体积反应改变压强或使用了催化剂。凡正(逆)速率线在上者,反应必向正(逆)反应方向移动。即上方速率决定平衡移动的方向。 ①改变浓度②改变温度③改变压强改变浓度改变温度改变压强1、“v~t”图:△H>0△H<0M+n>p+qM+n交叉点之前表示达到
平衡的过程;之后表
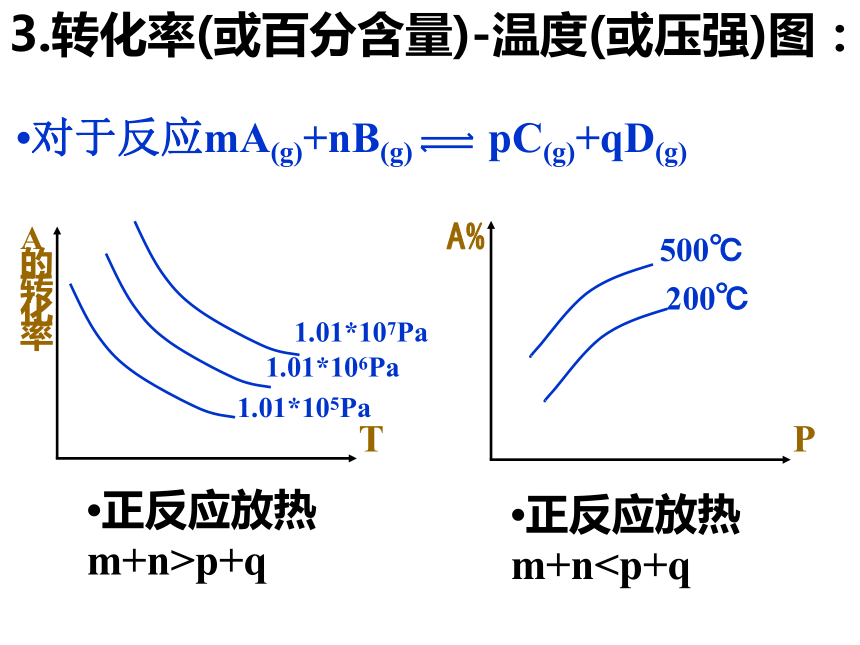
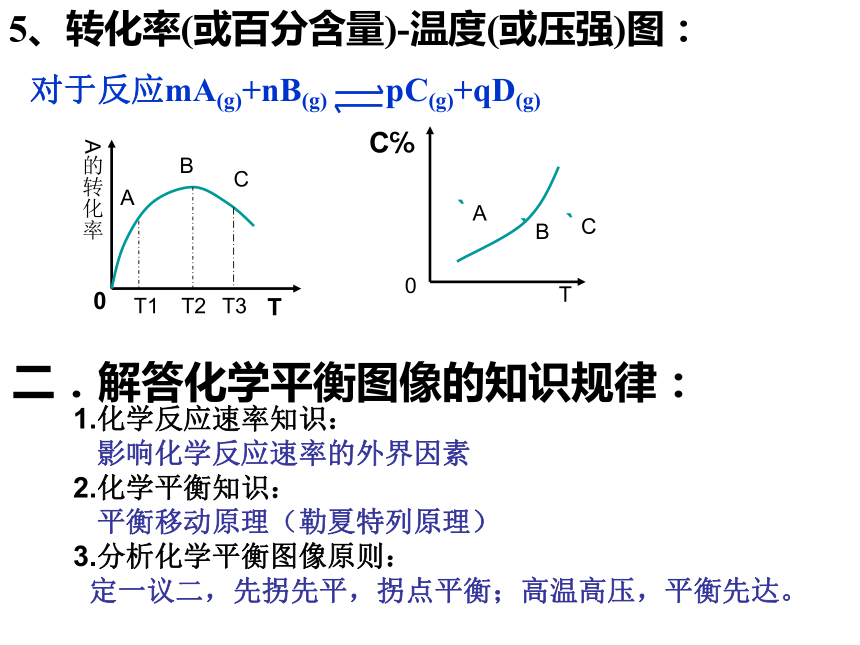
平衡移动的过程。3.转化率(或百分含量)-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)?正反应放热m+n>p+q?正反应放热m+n 影响化学反应速率的外界因素
2.化学平衡知识:
平衡移动原理(勒夏特列原理)
3.分析化学平衡图像原则:
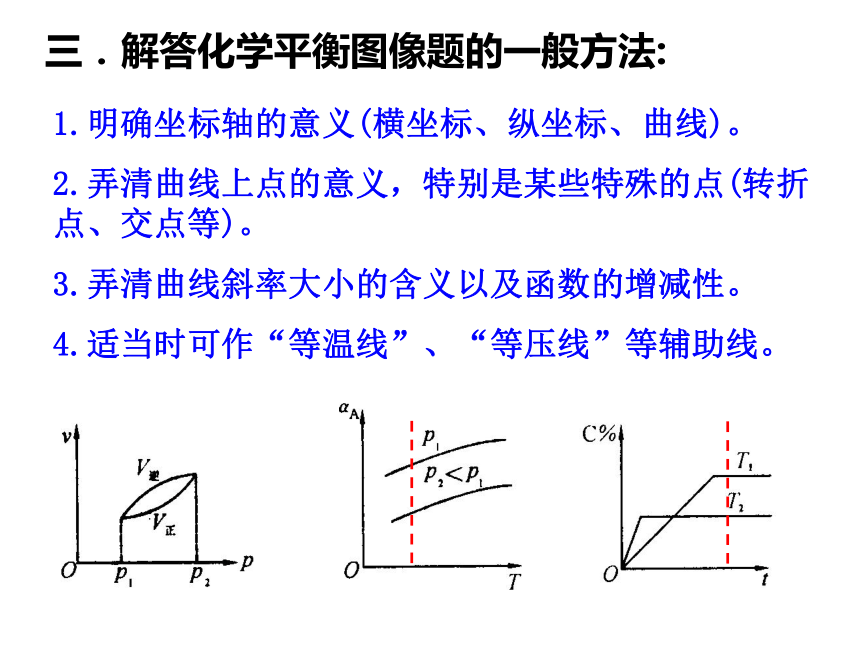
定一议二,先拐先平,拐点平衡;高温高压,平衡先达。三.解答化学平衡图像题的一般方法:1.明确坐标轴的意义(横坐标、纵坐标、曲线)。
2.弄清曲线上点的意义,特别是某些特殊的点(转折点、交点等)。
3.弄清曲线斜率大小的含义以及函数的增减性。
4.适当时可作“等温线”、“等压线”等辅助线。四.解答化学平衡图像题的步骤:(1)分析图像:
一看面、二看线、三看点、四看辅助线 、五看量的变化 。五.基本题型题型1:由化学方程式的特点判断图像
例:可表示为可逆反应2A(g)+B(g) 2C(g) △H < 0的图象是( ) B 练习:1.下图表示外界条件(温度、压强)的变化对下列反应的影响 A(s) + B(g) 2C(g) ,在图中,Y轴是指( )
A. 平衡混合气体中C的体积分数
B. 平衡混合气体中B的体积分数
C. B的转化率
D. A的转化率△H > 0B A(g) + 3B(g) 2C(g) △H <0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图所示,下列判断一定错误的是( )A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高B.图II研究的是压强对反应的影响,且甲的压强较高C.图II研究的是温度对反应的影响,且甲的温度较高D.图III研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 AB2.在容积固定的密闭容器中存在如下反应:3.反应X(g) + 3Y(g)? 2Z(g) △H﹤0,在不同温度和不同压强下(P1>P2)达平衡时,混和气体中Z的百分含量随温度、压强变化的曲线为( )C题型2:由图像特征判断方程式例:在下图中,x%为气态反应物在平衡体系中的体积分数,该图表示x%与温度、压强的关系,符合该曲线的反应是( )A. N2O3(g) + O2(g) N2O5(g)
B. H2(g) + I2(g) 2HI(g)
C. 4NH3(g) + 3O2(g) 2N2(g) + 6H2O(g)
D. C(s) + H2O(g) H2(g) + CO(g)△H > 0△H > 0△H < 0△H < 0D练习:1.下图中,表示平衡混合物中x的百分含量在不同压强下随温度的变化情况,在下列平衡体系中,横线表明的物质可代表x的是( )A. N2(g) + 3H2(g) 2NH3(g)
B. H2(g) + I2(g) 2HI(g)
C. 2SO3(g) 2SO2(g) + O2(g)
D. 4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g)△H < 0△H < 0△H < 0△H > 0D2.已知某可逆反应:aA(g) + bB(g) cC(g)在密闭容器中进行,在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的体积分数(B%)与反应时间(t)的关系如图所示。下列判断正确的是 ( )A? T1<T2,p1<p2,a+b>c,正反应吸热
B? T1>T2,p1<p2,a+b<c,正反应吸热
C? T1<T2,p1<p2,a+b<c,正反应放热
D? T1>T2,p1<p2,a+b>c,正反应放热B题型3:根据图像特征判断物质的状态和反应特征A . A2 、 B2 及AB均为气体,Q>0
B . AB为气体,A2 、 B2 中有一种为非气体,Q > 0
C . AB为气体, A2 、 B2 中有一种为非气体,Q < 0
D . AB为固体,A2 、 B2 中有一种为非气体,Q > 0C练习:A(g) + B(g) 2C + D(g) 此反应符合下列两个B△H =Q,图像,下列说法正确的是( )1.在一密闭容器中进行下列可逆反应:A. Q <0,C为固体或液体 B. Q<0,C为气体
C. Q>0,C为气体 D. Q>0,C为固体或液体BA. Z、W均为气态,X、Y中有一种为气体
B. Z、W中有一种为气体,X、Y均为气体
C. X、Y、Z均为非气体,W 为气体
D. X、Y均为气体,Z、W 皆为非气体题型4:图像的定量分析例:根据下面两幅图像,选出符合题意的反应方程式( )B A. x + 3y 2z
B. x + 3y 2z
C.5x + 3y 4z
D.X + 2y 3z练习:1.如图所示,800℃ 时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图像分析不能得出的结论是( )A. A是反应物。
B. 前两分钟A的分解速率是0.1 mol ? L-1 ? min-1
C. 若升高温度,A的转化率增大。
D. 增大压强,A的转化率减少。C2.右图表示800 ℃时,A、B、C三种气体在密闭容器中反应时各物质浓度随时间变化的情况,由图分析可得出的正确结论是:
(1)前2min内A的平均消耗
的速率是_____________。
(2)反应的化学方程式是:
_______________________
(3)8min后,若将容器的体
积缩小一半,c(A)将________
c(B)将________c(C)将_______
(填增大、减小、不变);
平衡将向________反应方向移动;达到新的平衡时混合气体的相对平均分子质量是___________ , A的转化率_________。0.1mol /(L ?min )增大增大增大逆增大减小1 - S ( a O b )2S(a O b)题型5:化学反应速率与化学平衡的综合运用例: mM(s) + nN(g) pQ(g) ,的可逆反应在定温时N%与压强的关系如下图,下列有关叙述正确的是( )A△H < 0A. A点时,V正> V逆
B. A点比B点的反应速率快
C. n>p
D. m+ n >p练习:BA. A点和E点
B. C点
C. B点
D. D点上述可逆反应在一定条件下反应,B的体积分数B%与压强的关系如右图所示,有关叙述正确的是( )A. m + n p
B. n p
C. x点的状态时混合体系中
v正 v逆
D. x 点的状态比 y点的状态
混合体系中的反应速率快 ? x? y压强B%2.m A(s) + n B(g) p C (g) △H < 0CD4.对于反应N2 + 3H2 2NH3 ,测得NH3%与温度T的关系如图所示。
请判断该反应的正反应是_____热反应(填“放”或“吸”),并解释为什么在T1时NH3%最高?放 因为开始时加入N2和H2后随温度的升高,反应速率增大,NH3%增多,在T1时达到平衡。此时再升高温度,由于正反应是放热反应,故平衡向逆反应方向移动,NH3%降低,因此T1时NH3%最高。谢谢
A(气)+B(气)C(气)(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物
质的量为 mol。(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分
别是ymol和3a mol,则x= mol,y= mol
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的
量分数是 。II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中
发生上述反应。(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的
a进行比较 (选填一个编号)。(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。(1-a) 3a 2 3-3a 丁 因为(5)小题中容器容积不变,而(1)小题中容器
的容积缩小,所以(5)小题的容器中的压力小于(1)
小题容器中的压力,有利于逆向反应,故反应达到平衡
后a>b。乙 若3a>1,B的物质的量小于2mol;
若3a=1 ,B的物质的量等于2mol;
若3a<1,B的物质的量大于2mol思考?化学平衡图像一.图像类型增大c(反应物)
平衡正向移动增大c(生成物)
平衡逆向移动减小c(反应物)
平衡逆向移动减小c(生成物)
平衡正向移动增大c(反应物)
减小c(生成物)
平衡正向移动增大c(生成物)
减小c(反应物)
平衡逆向移动以反应 mA(g)+nB(g) pC(g)+qD(g) △H 为例升高温度 △H>0
平衡正向移动升高温度 △H<0
平衡逆向移动降低温度 △H<0
平衡正向移动降低温度 △H>0
平衡逆向移动 增大压强
m+n>p+q
平衡正向移动 增大压强
m+n
m+n
m+n>p+q
平衡逆向移动 增大压强
m+n=p+q
或使用催化剂
平衡不移动 减小压强
m+n=p+q
平衡不移动 方法规律:若有一条曲线是连续的,则必为改变浓度;若曲线均突增(减),则必为改变温度或压强;若仍为一条水平线,则为等体积反应改变压强或使用了催化剂。凡正(逆)速率线在上者,反应必向正(逆)反应方向移动。即上方速率决定平衡移动的方向。 ①改变浓度②改变温度③改变压强改变浓度改变温度改变压强1、“v~t”图:△H>0△H<0M+n>p+qM+n
平衡的过程;之后表
平衡移动的过程。3.转化率(或百分含量)-温度(或压强)图:?对于反应mA(g)+nB(g) pC(g)+qD(g)?正反应放热m+n>p+q?正反应放热m+n
2.化学平衡知识:
平衡移动原理(勒夏特列原理)
3.分析化学平衡图像原则:
定一议二,先拐先平,拐点平衡;高温高压,平衡先达。三.解答化学平衡图像题的一般方法:1.明确坐标轴的意义(横坐标、纵坐标、曲线)。
2.弄清曲线上点的意义,特别是某些特殊的点(转折点、交点等)。
3.弄清曲线斜率大小的含义以及函数的增减性。
4.适当时可作“等温线”、“等压线”等辅助线。四.解答化学平衡图像题的步骤:(1)分析图像:
一看面、二看线、三看点、四看辅助线 、五看量的变化 。五.基本题型题型1:由化学方程式的特点判断图像
例:可表示为可逆反应2A(g)+B(g) 2C(g) △H < 0的图象是( ) B 练习:1.下图表示外界条件(温度、压强)的变化对下列反应的影响 A(s) + B(g) 2C(g) ,在图中,Y轴是指( )
A. 平衡混合气体中C的体积分数
B. 平衡混合气体中B的体积分数
C. B的转化率
D. A的转化率△H > 0B A(g) + 3B(g) 2C(g) △H <0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图所示,下列判断一定错误的是( )A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高B.图II研究的是压强对反应的影响,且甲的压强较高C.图II研究的是温度对反应的影响,且甲的温度较高D.图III研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 AB2.在容积固定的密闭容器中存在如下反应:3.反应X(g) + 3Y(g)? 2Z(g) △H﹤0,在不同温度和不同压强下(P1>P2)达平衡时,混和气体中Z的百分含量随温度、压强变化的曲线为( )C题型2:由图像特征判断方程式例:在下图中,x%为气态反应物在平衡体系中的体积分数,该图表示x%与温度、压强的关系,符合该曲线的反应是( )A. N2O3(g) + O2(g) N2O5(g)
B. H2(g) + I2(g) 2HI(g)
C. 4NH3(g) + 3O2(g) 2N2(g) + 6H2O(g)
D. C(s) + H2O(g) H2(g) + CO(g)△H > 0△H > 0△H < 0△H < 0D练习:1.下图中,表示平衡混合物中x的百分含量在不同压强下随温度的变化情况,在下列平衡体系中,横线表明的物质可代表x的是( )A. N2(g) + 3H2(g) 2NH3(g)
B. H2(g) + I2(g) 2HI(g)
C. 2SO3(g) 2SO2(g) + O2(g)
D. 4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g)△H < 0△H < 0△H < 0△H > 0D2.已知某可逆反应:aA(g) + bB(g) cC(g)在密闭容器中进行,在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的体积分数(B%)与反应时间(t)的关系如图所示。下列判断正确的是 ( )A? T1<T2,p1<p2,a+b>c,正反应吸热
B? T1>T2,p1<p2,a+b<c,正反应吸热
C? T1<T2,p1<p2,a+b<c,正反应放热
D? T1>T2,p1<p2,a+b>c,正反应放热B题型3:根据图像特征判断物质的状态和反应特征A . A2 、 B2 及AB均为气体,Q>0
B . AB为气体,A2 、 B2 中有一种为非气体,Q > 0
C . AB为气体, A2 、 B2 中有一种为非气体,Q < 0
D . AB为固体,A2 、 B2 中有一种为非气体,Q > 0C练习:A(g) + B(g) 2C + D(g) 此反应符合下列两个B△H =Q,图像,下列说法正确的是( )1.在一密闭容器中进行下列可逆反应:A. Q <0,C为固体或液体 B. Q<0,C为气体
C. Q>0,C为气体 D. Q>0,C为固体或液体BA. Z、W均为气态,X、Y中有一种为气体
B. Z、W中有一种为气体,X、Y均为气体
C. X、Y、Z均为非气体,W 为气体
D. X、Y均为气体,Z、W 皆为非气体题型4:图像的定量分析例:根据下面两幅图像,选出符合题意的反应方程式( )B A. x + 3y 2z
B. x + 3y 2z
C.5x + 3y 4z
D.X + 2y 3z练习:1.如图所示,800℃ 时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图像分析不能得出的结论是( )A. A是反应物。
B. 前两分钟A的分解速率是0.1 mol ? L-1 ? min-1
C. 若升高温度,A的转化率增大。
D. 增大压强,A的转化率减少。C2.右图表示800 ℃时,A、B、C三种气体在密闭容器中反应时各物质浓度随时间变化的情况,由图分析可得出的正确结论是:
(1)前2min内A的平均消耗
的速率是_____________。
(2)反应的化学方程式是:
_______________________
(3)8min后,若将容器的体
积缩小一半,c(A)将________
c(B)将________c(C)将_______
(填增大、减小、不变);
平衡将向________反应方向移动;达到新的平衡时混合气体的相对平均分子质量是___________ , A的转化率_________。0.1mol /(L ?min )增大增大增大逆增大减小1 - S ( a O b )2S(a O b)题型5:化学反应速率与化学平衡的综合运用例: mM(s) + nN(g) pQ(g) ,的可逆反应在定温时N%与压强的关系如下图,下列有关叙述正确的是( )A△H < 0A. A点时,V正> V逆
B. A点比B点的反应速率快
C. n>p
D. m+ n >p练习:BA. A点和E点
B. C点
C. B点
D. D点上述可逆反应在一定条件下反应,B的体积分数B%与压强的关系如右图所示,有关叙述正确的是( )A. m + n p
B. n p
C. x点的状态时混合体系中
v正 v逆
D. x 点的状态比 y点的状态
混合体系中的反应速率快 ? x? y压强B%2.m A(s) + n B(g) p C (g) △H < 0CD4.对于反应N2 + 3H2 2NH3 ,测得NH3%与温度T的关系如图所示。
请判断该反应的正反应是_____热反应(填“放”或“吸”),并解释为什么在T1时NH3%最高?放 因为开始时加入N2和H2后随温度的升高,反应速率增大,NH3%增多,在T1时达到平衡。此时再升高温度,由于正反应是放热反应,故平衡向逆反应方向移动,NH3%降低,因此T1时NH3%最高。谢谢
