《电解池的工作原理》教学课件
文档属性
| 名称 | 《电解池的工作原理》教学课件 |

|
|
| 格式 | rar | ||
| 文件大小 | 107.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-10-15 22:50:00 | ||
图片预览





文档简介
课件15张PPT。电解池的工作原理第1课时
电解池(电解槽):
把电能转化为化学能的装置。如何实现电能转化为化学能呢?
我们以电解熔融NaCl为例电解熔融氯化钠(见课本P17原理图)通电前, Na+ Cl- 在 ____________运动。
通电后, Na+向__ 极(与电源______相连)移动,Cl-向___极(与电源______相连)移动。
电子从电源负极流向_________极,电极反应为__________,发生____________________反应。
电子从电解池阳极流向_______极,电极反应为__________,发生_______________________反应。
总反应为_______________________。 阴无规则自由负极阳正极电解池阴2NaCl 2Na +Cl2↑氧化还原电源正2Na++ 2e- == 2Na2Cl --2e-==Cl2↑ 电解:在直流电的作用下,在两电极上分别发生氧化反应和还原反应的过程。
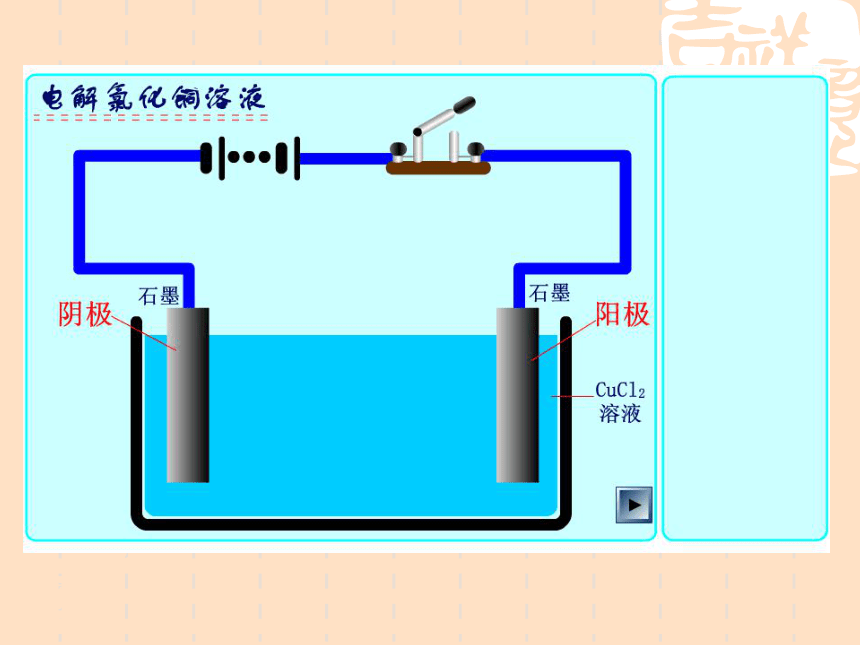
下面以石墨为电极电解氯化铜溶液为例来分析。这是电解熔融盐的情况。
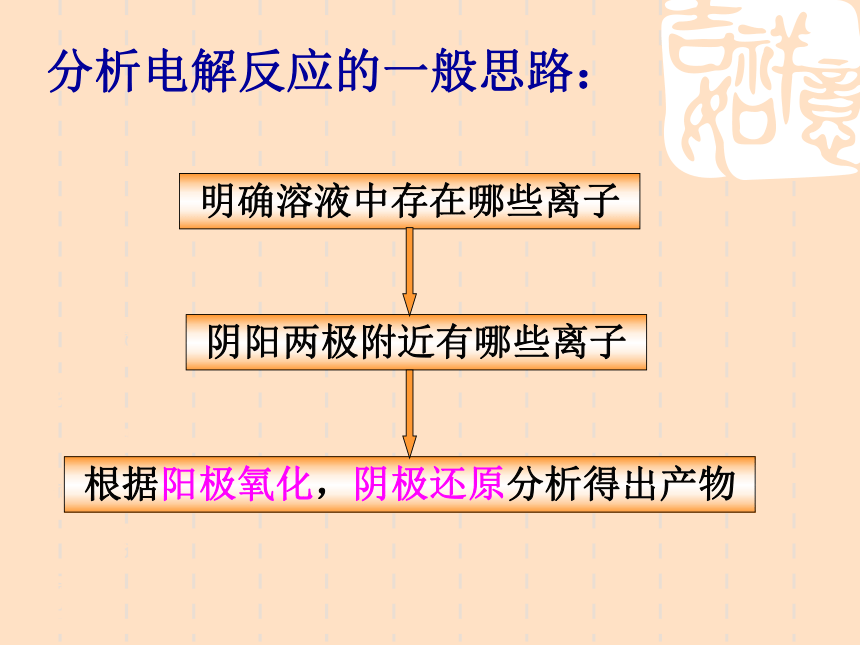
电解电解质溶液又会发生什么反应呢?分析电解反应的一般思路:明确溶液中存在哪些离子根据阳极氧化,阴极还原分析得出产物阴阳两极附近有哪些离子 为何当一个电极存在多种可能的放电离子时,不是大家共同放电,而是只有一种离子放电?放电能力与什么因素有关?思考:(物质在电解池的阴、阳两极发生反应的过程叫放电。)阴极: 发生____反应, ___电子,离子 _____越强,反应越容易。
常见阳离子放电顺序:
(Ag+>Fe3+)>Hg2+>Cu2+>(H+>Pb2+>Ni 2 +> Fe2+>Zn2+)>
Al3+>Mg2+>Na+
注:括号中离子的氧化性,随浓度的增大而增强
阳极:发生____反应, ___电子,离子 _____越强,反应越容易。
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-得还原氧化性失氧化还原性想一想: 若以铜为阳极,铁为阴极,电解 氯化铜溶液,情况又如何?②当阳极为金属电极(即活性电极)时,
金属电极优先放电,被氧化而溶解。电能转化为化学能阳极(接电源正极)阴极(接电源负极)阴离子向阳极迁移
阳离子向阴极迁移化学能转化为电能负极正极阴离子向负极迁移
阳离子向正极迁移都是氧化还原反应整理与归纳练习及作业: 完成下列溶液的电极反应(以石墨为电极电解)硫酸溶液:
盐酸:
NaOH溶液:
CuBr2溶液:
KCl溶液:
CuSO4溶液:
Na2SO4溶液:
总结⑴电解水型:含氧酸、强碱、活泼金属的含氧酸盐(如NaOH、H2SO4、K2SO4)的电解
⑵电解电解质型:无氧酸、不活泼的无氧酸盐(如HCl、CuCl2)溶液的电解
电解质和水同时被电解型
⑶放氢生碱型:活泼金属的无氧酸盐(如NaCl、MgBr2)溶液的电解
⑷放氧生酸型:不活泼金属的含氧酸盐(如CuSO4、AgNO3)溶液的电解用惰性电极电解电解质溶液的规律下列说法中正确的是( )
A.在原电池中,物质在负极上发生氧化反应
B.在电池中,电子由正极流向负极
C.在电解池中,物质在阴极发生氧化反应
D.在电解池中,与电源正极相连的电极是阴极思考与应用:再 见!
电解池(电解槽):
把电能转化为化学能的装置。如何实现电能转化为化学能呢?
我们以电解熔融NaCl为例电解熔融氯化钠(见课本P17原理图)通电前, Na+ Cl- 在 ____________运动。
通电后, Na+向__ 极(与电源______相连)移动,Cl-向___极(与电源______相连)移动。
电子从电源负极流向_________极,电极反应为__________,发生____________________反应。
电子从电解池阳极流向_______极,电极反应为__________,发生_______________________反应。
总反应为_______________________。 阴无规则自由负极阳正极电解池阴2NaCl 2Na +Cl2↑氧化还原电源正2Na++ 2e- == 2Na2Cl --2e-==Cl2↑ 电解:在直流电的作用下,在两电极上分别发生氧化反应和还原反应的过程。
下面以石墨为电极电解氯化铜溶液为例来分析。这是电解熔融盐的情况。
电解电解质溶液又会发生什么反应呢?分析电解反应的一般思路:明确溶液中存在哪些离子根据阳极氧化,阴极还原分析得出产物阴阳两极附近有哪些离子 为何当一个电极存在多种可能的放电离子时,不是大家共同放电,而是只有一种离子放电?放电能力与什么因素有关?思考:(物质在电解池的阴、阳两极发生反应的过程叫放电。)阴极: 发生____反应, ___电子,离子 _____越强,反应越容易。
常见阳离子放电顺序:
(Ag+>Fe3+)>Hg2+>Cu2+>(H+>Pb2+>Ni 2 +> Fe2+>Zn2+)>
Al3+>Mg2+>Na+
注:括号中离子的氧化性,随浓度的增大而增强
阳极:发生____反应, ___电子,离子 _____越强,反应越容易。
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-得还原氧化性失氧化还原性想一想: 若以铜为阳极,铁为阴极,电解 氯化铜溶液,情况又如何?②当阳极为金属电极(即活性电极)时,
金属电极优先放电,被氧化而溶解。电能转化为化学能阳极(接电源正极)阴极(接电源负极)阴离子向阳极迁移
阳离子向阴极迁移化学能转化为电能负极正极阴离子向负极迁移
阳离子向正极迁移都是氧化还原反应整理与归纳练习及作业: 完成下列溶液的电极反应(以石墨为电极电解)硫酸溶液:
盐酸:
NaOH溶液:
CuBr2溶液:
KCl溶液:
CuSO4溶液:
Na2SO4溶液:
总结⑴电解水型:含氧酸、强碱、活泼金属的含氧酸盐(如NaOH、H2SO4、K2SO4)的电解
⑵电解电解质型:无氧酸、不活泼的无氧酸盐(如HCl、CuCl2)溶液的电解
电解质和水同时被电解型
⑶放氢生碱型:活泼金属的无氧酸盐(如NaCl、MgBr2)溶液的电解
⑷放氧生酸型:不活泼金属的含氧酸盐(如CuSO4、AgNO3)溶液的电解用惰性电极电解电解质溶液的规律下列说法中正确的是( )
A.在原电池中,物质在负极上发生氧化反应
B.在电池中,电子由正极流向负极
C.在电解池中,物质在阴极发生氧化反应
D.在电解池中,与电源正极相连的电极是阴极思考与应用:再 见!
