《反应热的测量与计算》教学课件
图片预览










文档简介
课件33张PPT。
反应热的测量与计算
专题1第一单元 化学反应中的热效应2课时【交流与讨论】 热化学方程式中,提供了反应热的数据,那么,这些数据是通过什么途径获得的呢?
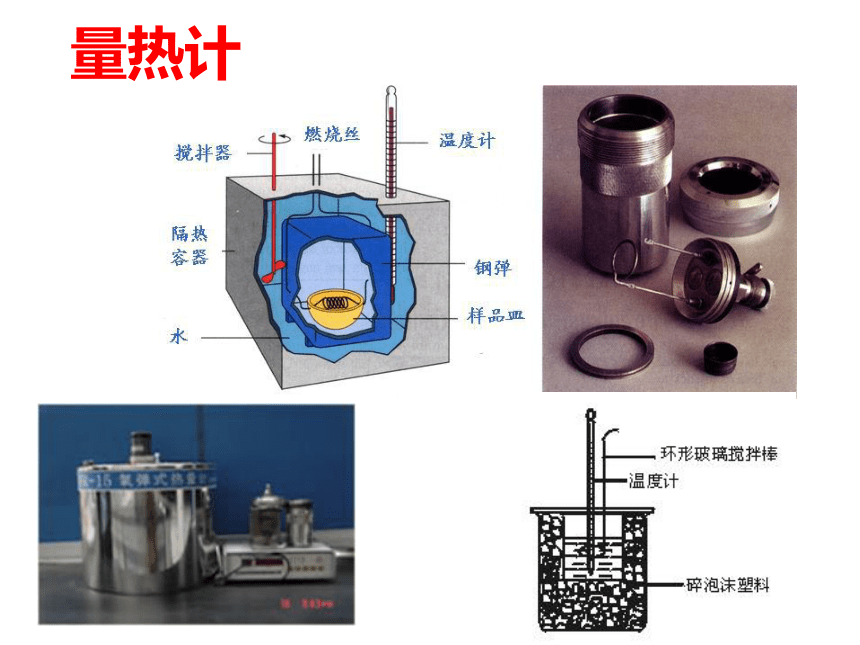
量热计【实 验 原 理】公式一: Q=Cm△t
公式二: △H=Q÷n
C为比热容,为定值。
m为质量,可以测定。
n为物质的量。 在稀溶液中,酸和碱发生中和反应而
生成1mol水时放出的热量。
研究条件:稀溶液
反应物:酸与碱
生成物及其物质的量:1mol 注:强酸与弱碱反应,强碱与弱酸、弱酸和弱碱反应生成1molH2O放出的热小于57.3KJ/mol一、中和热:?二、中和热的测定⑴实验药品:50 mL0.50 mol/L的盐酸
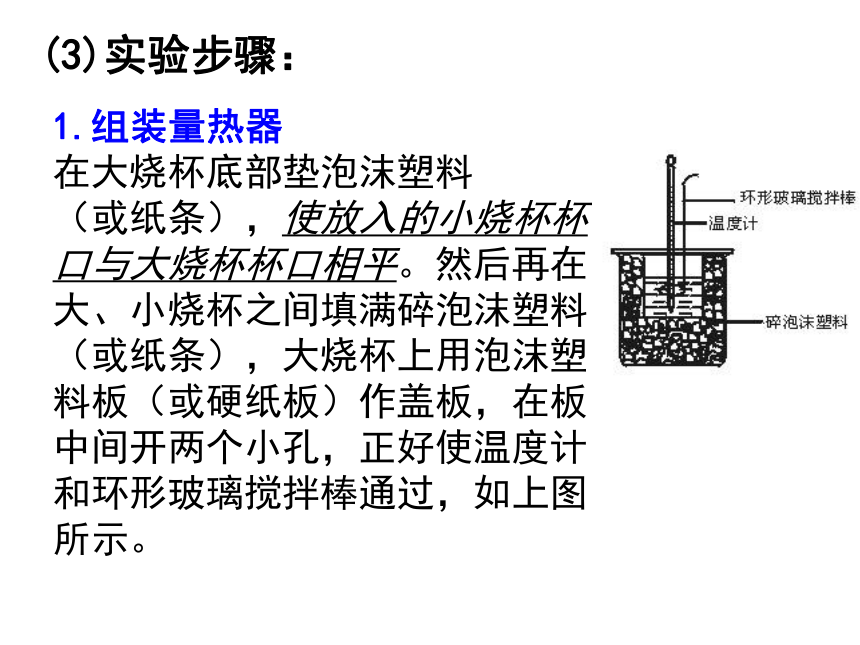
50 mL0.50 mol/L的氢氧化钠溶液⑵实验仪器:简易量热计【活动与探究】简易量热计(3)实验步骤:1.组装量热器
在大烧杯底部垫泡沫塑料
(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,如上图所示。用一个量筒最取50 mL 0.50 mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。2 药品取用 用另一个量筒量取50 mL 0.50 mol/L
NaOH溶液,并用温度计测量NaOH溶液
的温度,记入下表。把量筒中的NaOH溶液迅速倒入量热计(注意不要洒到外面)。立即盖上盖板,用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入表中。3 酸碱混合4 重复以上实验两次用同样的方法测定氢氧化钾溶液与盐酸反应、氢氧化钠溶液与硝酸反应的反应热,请预测其反应热是否相同。 假设溶液的比热与水的比热相等,溶液的密度与水的密度相等,忽略量热计的比热,根据溶液温度升高的数值,计算中和反应的反应热并写出该反应的热化学方程式。1、如何利用上述温度变化的数据求出反应放出的热量呢?议一议5 数据处理Q =mCΔt? ①
Q:中和反应放出的热量。
m:反应混合液的质量。
C:反应混合液的比热容。
Δt:反应前后溶液温度的差值。我们如何得到上述数据呢?m的质量为所用酸、碱的质量和,测出参加反应的酸、碱质量相加即可;C需要查阅,Δt可用温度计测出反应前后的温度相减得到。5 数据处理[问]酸、碱反应时,我们用的是它的稀溶液,它们的质量应怎样得到?量出它们的体积,再乘以它们的密度即可。 Q =(V酸ρ酸+V碱ρ碱)·C·(t2-t1) ②5 数据处理 本实验中,我们所用一元酸、一元碱的体积均为50 mL,它 们的浓度分别为0.50 mol/L和0.55 mol/L。由于是稀溶液,且为了计算简便,我们近似地认为,所用酸、碱溶液的密度均为1 g/cm3,且中和后所得溶液的比热容为 4.18 J/(g·℃)5 数据处理③式表示的是不是该反应的反应热?是中和热吗?为什么?议一议已知 V酸=V碱=50 mL。
C酸=0.50 mol/L
c碱=0.55 mol/L。
ρ酸=ρ碱=1 g/cm3
C=4.18 J/(g·℃)
请把以上数据代入式②,得出Q的表示式。其中热量的单位用kJ。得出结果。Q = 0.418(t2-t1)kJ ③5 数据处理③式不是该反应的反应热,因为反应热是有正负的,中和反应放热,故其ΔH为“-”。
中和热是稀的酸、碱中和生成 1 mol水的反应热,而50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L 氢氧化钠反应后生成的水只有0.025 mol,故③式表示的也不是中和热。 5 数据处理[问题]该反应的中和热应怎样表示呢?中和热5 数据处理[议一议]你所测得的数据是否为57.4 kJ/mol,
若不是,分析产生误差的原因6 数据分析:1>.量取溶液的体积有误差2>药品的选用不当引起的误差3>实验过程中有液体洒在外面。4>.混合酸、碱溶液时,动作缓慢,
导致实验误差5>.隔热操作不到位,致使实验过程
中热量损失而导致误差6>.测了酸后的温度计未用水清洗而便
立即去测碱的温度,致使热量损失
而引起误差。【问题探究】1、大、小烧杯放置时,为何要使两杯口相平?填碎纸条的作用是什么?减少热量损失2、酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?减少热量损失【问题探究】3、实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?为什么?不能。因为铜丝易导热,使热量损失较大【问题探究】4、有人建议用50mL0.55mol/LNaOH进行上述实验,测得的中和热数值会更加准确。为什么? 可以保证盐酸完全反应。
使测得的热量更加准确。【问题探究】5、判断下列实验操作对中和热测定的数值有如何影响?填变大变小或者不变。①大烧杯上没有盖硬纸板
②用相同浓度和体积的氨水代替NaOH溶液进行实验
③用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
④实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行实验变小变小变小不变【问题探究】1、为了减小误差。某同学在实验中两次测定中和热。第一次是用50 mL 0.50 mol/L的盐酸和50 mL 0.50 mol/L氢氧化钠,第二次是用100 mL 0.50 mol/L的盐酸和100 mL 0.50mol/L的NaOH溶液。请你预测该同学两次测得的中和热结果 (相等或者不相等)。【概念辨析】相等2、若将1L1mol/LNaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H1、△H2 、△H3 ;则三者的大小关系为
。△H1>△H3>△H2 燃烧热:1g可燃物完全燃烧生成最稳定的氧化物所释放的热量。【概念辨析】盖斯定律 不管化学反应是分一步完成或分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。如何理解盖斯定律?ΔH、ΔH1、ΔH2之间有何关系?ΔH=ΔH1+ΔH2BΔH如何测出这个反应的反应热:
C(s)+1/2O2(g) = CO(g) ΔH1=?你知道吗?①C(s)+1/2O2(g)==CO(g) ΔH1=?
②CO(g)+1/2O2(g)== CO2(g) ΔH2=—283.0kJ/mol
③C(s)+O2(g)==CO2(g) ΔH3=—393.5kJ/mol
① + ② = ③ ,
则 ΔH1 + ΔH2 =ΔH3
ΔH1 =ΔH3 -ΔH2
= - 393.5kJ/mol + 283.0kJ/mol
= - 110.5kJ/mol 若多步化学反应相加可得到新的化学反应,则新反应的反应热即为上述多步反应的反应热之和。【总结规律】注意:
1、计量数的变化与反应热数值的变化要对应
2、反应方向发生改变反应热的符号也要改变总结思考:
在用方程式叠加计算反应热时要注意哪些问题?盖斯定律的应用根据下列反应的焓变,计算C(石墨)与H2(g)反应生成1molC2H2(g)的焓变:
C(石墨)+O2(g)=CO2(g) △H=-393.5KJ/mol
2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599.2KJ/mol ∵ (①×4 +② -③) ÷2
得到2C(石墨)(s)+H2(g) =C2H2(g)
∴ △H=(△H1 ×4 + △H2- △H3) ÷2①②③=+226.8KJ/mol你知道神六的火箭燃料是什么吗?例2、某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。2 N2H4(g)+ 2NO2(g)= 3N2(g)+4H2O(l)
△H=-1135.2kJ/mol 课后拓展
量热计【实 验 原 理】公式一: Q=Cm△t
公式二: △H=Q÷n
C为比热容,为定值。
m为质量,可以测定。
n为物质的量。 在稀溶液中,酸和碱发生中和反应而
生成1mol水时放出的热量。
研究条件:稀溶液
反应物:酸与碱
生成物及其物质的量:1mol 注:强酸与弱碱反应,强碱与弱酸、弱酸和弱碱反应生成1molH2O放出的热小于57.3KJ/mol一、中和热:?二、中和热的测定⑴实验药品:50 mL0.50 mol/L的盐酸
50 mL0.50 mol/L的氢氧化钠溶液⑵实验仪器:简易量热计【活动与探究】简易量热计(3)实验步骤:1.组装量热器
在大烧杯底部垫泡沫塑料
(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,如上图所示。用一个量筒最取50 mL 0.50 mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。2 药品取用 用另一个量筒量取50 mL 0.50 mol/L
NaOH溶液,并用温度计测量NaOH溶液
的温度,记入下表。把量筒中的NaOH溶液迅速倒入量热计(注意不要洒到外面)。立即盖上盖板,用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入表中。3 酸碱混合4 重复以上实验两次用同样的方法测定氢氧化钾溶液与盐酸反应、氢氧化钠溶液与硝酸反应的反应热,请预测其反应热是否相同。 假设溶液的比热与水的比热相等,溶液的密度与水的密度相等,忽略量热计的比热,根据溶液温度升高的数值,计算中和反应的反应热并写出该反应的热化学方程式。1、如何利用上述温度变化的数据求出反应放出的热量呢?议一议5 数据处理Q =mCΔt? ①
Q:中和反应放出的热量。
m:反应混合液的质量。
C:反应混合液的比热容。
Δt:反应前后溶液温度的差值。我们如何得到上述数据呢?m的质量为所用酸、碱的质量和,测出参加反应的酸、碱质量相加即可;C需要查阅,Δt可用温度计测出反应前后的温度相减得到。5 数据处理[问]酸、碱反应时,我们用的是它的稀溶液,它们的质量应怎样得到?量出它们的体积,再乘以它们的密度即可。 Q =(V酸ρ酸+V碱ρ碱)·C·(t2-t1) ②5 数据处理 本实验中,我们所用一元酸、一元碱的体积均为50 mL,它 们的浓度分别为0.50 mol/L和0.55 mol/L。由于是稀溶液,且为了计算简便,我们近似地认为,所用酸、碱溶液的密度均为1 g/cm3,且中和后所得溶液的比热容为 4.18 J/(g·℃)5 数据处理③式表示的是不是该反应的反应热?是中和热吗?为什么?议一议已知 V酸=V碱=50 mL。
C酸=0.50 mol/L
c碱=0.55 mol/L。
ρ酸=ρ碱=1 g/cm3
C=4.18 J/(g·℃)
请把以上数据代入式②,得出Q的表示式。其中热量的单位用kJ。得出结果。Q = 0.418(t2-t1)kJ ③5 数据处理③式不是该反应的反应热,因为反应热是有正负的,中和反应放热,故其ΔH为“-”。
中和热是稀的酸、碱中和生成 1 mol水的反应热,而50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L 氢氧化钠反应后生成的水只有0.025 mol,故③式表示的也不是中和热。 5 数据处理[问题]该反应的中和热应怎样表示呢?中和热5 数据处理[议一议]你所测得的数据是否为57.4 kJ/mol,
若不是,分析产生误差的原因6 数据分析:1>.量取溶液的体积有误差2>药品的选用不当引起的误差3>实验过程中有液体洒在外面。4>.混合酸、碱溶液时,动作缓慢,
导致实验误差5>.隔热操作不到位,致使实验过程
中热量损失而导致误差6>.测了酸后的温度计未用水清洗而便
立即去测碱的温度,致使热量损失
而引起误差。【问题探究】1、大、小烧杯放置时,为何要使两杯口相平?填碎纸条的作用是什么?减少热量损失2、酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?减少热量损失【问题探究】3、实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?为什么?不能。因为铜丝易导热,使热量损失较大【问题探究】4、有人建议用50mL0.55mol/LNaOH进行上述实验,测得的中和热数值会更加准确。为什么? 可以保证盐酸完全反应。
使测得的热量更加准确。【问题探究】5、判断下列实验操作对中和热测定的数值有如何影响?填变大变小或者不变。①大烧杯上没有盖硬纸板
②用相同浓度和体积的氨水代替NaOH溶液进行实验
③用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
④实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行实验变小变小变小不变【问题探究】1、为了减小误差。某同学在实验中两次测定中和热。第一次是用50 mL 0.50 mol/L的盐酸和50 mL 0.50 mol/L氢氧化钠,第二次是用100 mL 0.50 mol/L的盐酸和100 mL 0.50mol/L的NaOH溶液。请你预测该同学两次测得的中和热结果 (相等或者不相等)。【概念辨析】相等2、若将1L1mol/LNaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H1、△H2 、△H3 ;则三者的大小关系为
。△H1>△H3>△H2 燃烧热:1g可燃物完全燃烧生成最稳定的氧化物所释放的热量。【概念辨析】盖斯定律 不管化学反应是分一步完成或分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。如何理解盖斯定律?ΔH、ΔH1、ΔH2之间有何关系?ΔH=ΔH1+ΔH2BΔH如何测出这个反应的反应热:
C(s)+1/2O2(g) = CO(g) ΔH1=?你知道吗?①C(s)+1/2O2(g)==CO(g) ΔH1=?
②CO(g)+1/2O2(g)== CO2(g) ΔH2=—283.0kJ/mol
③C(s)+O2(g)==CO2(g) ΔH3=—393.5kJ/mol
① + ② = ③ ,
则 ΔH1 + ΔH2 =ΔH3
ΔH1 =ΔH3 -ΔH2
= - 393.5kJ/mol + 283.0kJ/mol
= - 110.5kJ/mol 若多步化学反应相加可得到新的化学反应,则新反应的反应热即为上述多步反应的反应热之和。【总结规律】注意:
1、计量数的变化与反应热数值的变化要对应
2、反应方向发生改变反应热的符号也要改变总结思考:
在用方程式叠加计算反应热时要注意哪些问题?盖斯定律的应用根据下列反应的焓变,计算C(石墨)与H2(g)反应生成1molC2H2(g)的焓变:
C(石墨)+O2(g)=CO2(g) △H=-393.5KJ/mol
2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599.2KJ/mol ∵ (①×4 +② -③) ÷2
得到2C(石墨)(s)+H2(g) =C2H2(g)
∴ △H=(△H1 ×4 + △H2- △H3) ÷2①②③=+226.8KJ/mol你知道神六的火箭燃料是什么吗?例2、某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。2 N2H4(g)+ 2NO2(g)= 3N2(g)+4H2O(l)
△H=-1135.2kJ/mol 课后拓展
