《原电池的工作原理》教学课件
图片预览



文档简介
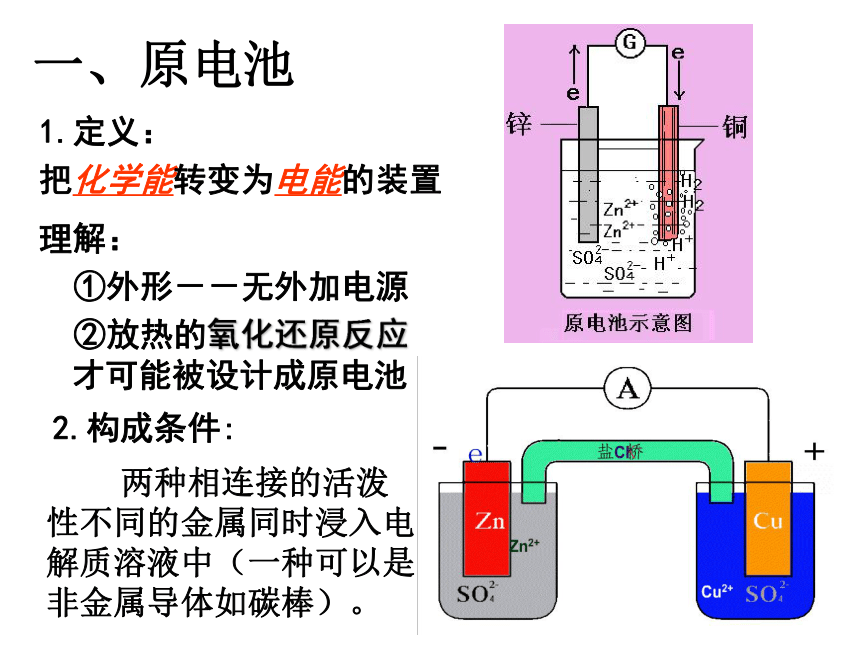
课件15张PPT。原电池的工作原理一、原电池1.定义:
把化学能转变为电能的装置 理解:
①外形--无外加电源
②放热的氧化还原反应才可能被设计成原电池 两种相连接的活泼性不同的金属同时浸入电解质溶液中(一种可以是非金属导体如碳棒)。2.构成条件:盐桥:在U型管中装用饱和KCl溶液浸泡的棉绳. 盐桥的作用:
使Cl-向锌盐方向移动,K+向铜盐方向移动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子不断
从Zn极流向Cu极。3.原电池的化学原理电子从负极(较活泼金属)流向正极(较不活泼金属或碳棒),
负极发生氧化反应,正极发生还原反应。4.半电池:包括电极材料和电解质溶液,两个隔离
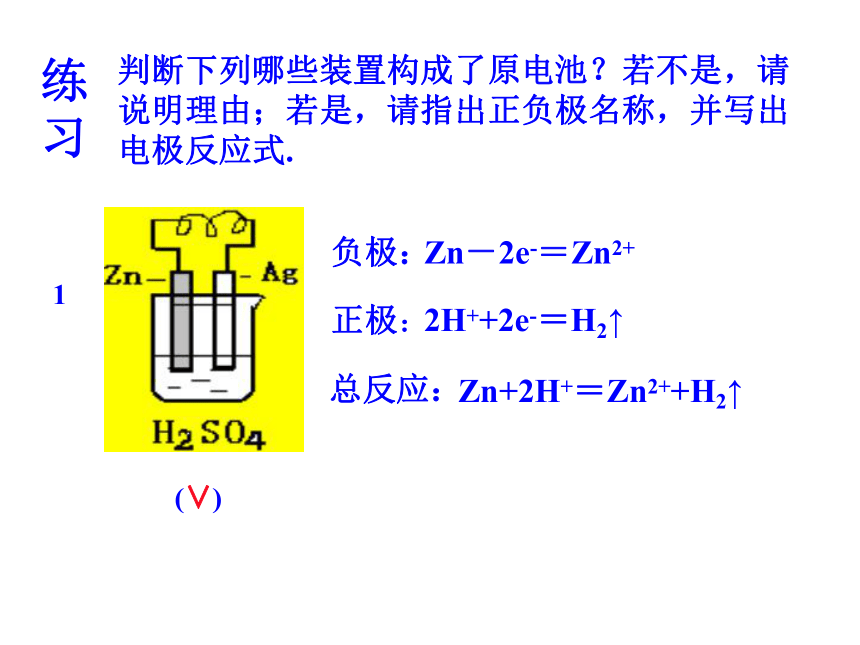
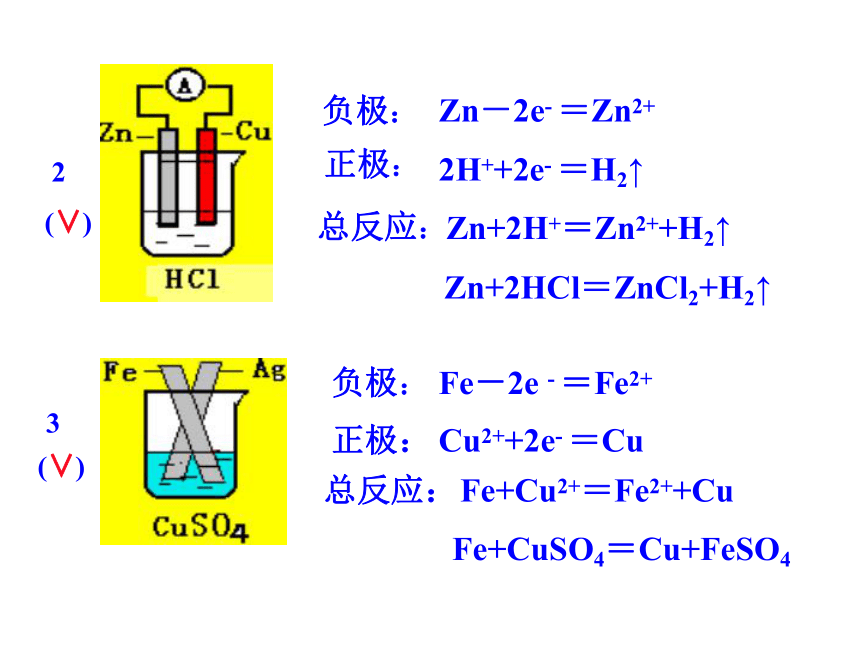
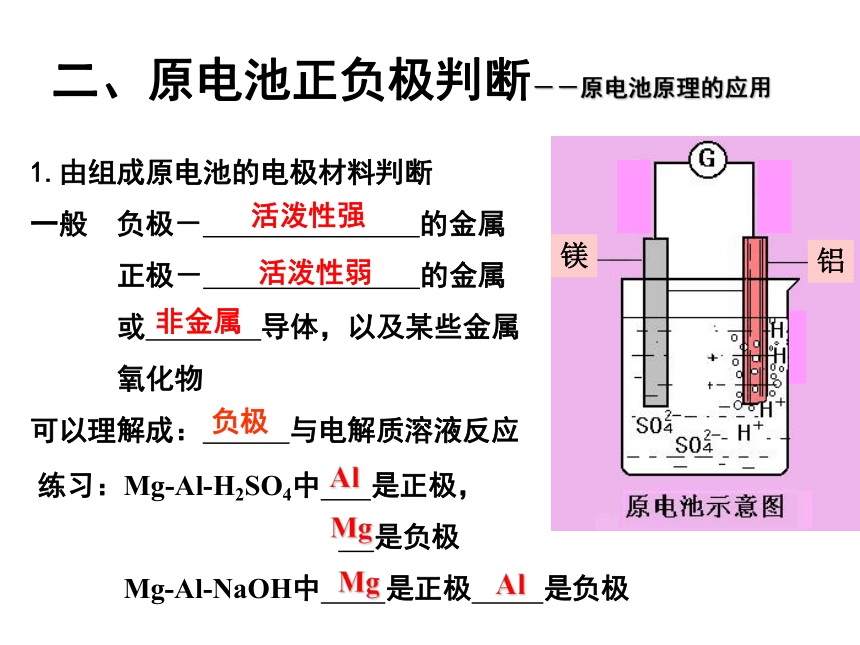
的半电池通过盐桥连接起来。练习判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.1(∨)2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑(∨)负极:正极:总反应:Zn-2e- =Zn2+2H++2e- =H2↑Zn+2H+=Zn2++H2↑(∨)正极:负极:总反应:Fe-2e - =Fe2+Cu2++2e- =CuFe+Cu2+=Fe2++CuFe+CuSO4=Cu+FeSO423Zn+2HCl=ZnCl2+H2↑54(×)(∨)负极:正极:总反应:Zn-2e-=Zn2+Cu2++2e-=CuZn+Cu2+=Zn2++Cu或 Zn+CuSO4=ZnSO4+Cu二、原电池正负极判断--原电池原理的应用1.由组成原电池的电极材料判断
一般 负极- 的金属
正极- 的金属
或 导体,以及某些金属
氧化物
可以理解成: 与电解质溶液反应 练习:Mg-Al-H2SO4中 是正极,
是负极
Mg-Al-NaOH中 是正极 是负极MgAlAlMg 活泼性强活泼性弱非金属负极二、原电池正负极判断--原电池原理的应用1.由组成原电池的电极材料判断2.根据电子(电流)流动的方向判断
电子--由 流出,流入 ;
电流--由 流出,流入 。负极正极正极负极二、原电池正负极判断--原电池原理的应用1.由组成原电池的电极材料判断2.根据电子(电流)流动的方向判断 3.根据电极反应类型判断
负极-- 电子,发生 反应
正极-- 电子,发生 反应 失得氧化还原二、原电池正负极判断--原电池原理的应用1.由组成原电池的电极材料判断2.根据电子(电流)流动的方向判断 3.根据电极反应类型判断 4.根据电解质溶液离子移动的方向判断
阴离子-向 极移动(负极带正电荷)
阳离子-向 极移动(正极带负电荷) 负正二、原电池正负极判断--原电池原理的应用1.由组成原电池的电极材料判断2.根据电子(电流)流动的方向判断 3.根据电极反应类型判断 4.根据电解质溶液离子移动的方向判断 5.根据电极现象来判断
负极-- ;
正极-- ;牺牲、溶解增重、气泡二、原电池正负极判断--原电池原理的应用1.由组成原电池的电极材料判断2.根据电子(电流)流动的方向判断 3.根据电极反应类型判断 4.根据电解质溶液离子移动的方向判断 5.根据电极现象来判断 6.燃料电池中
燃料在 反应
氧化剂在 反应 负极正极随堂检测 1、把金属甲和乙分别插入稀硫酸中,观察到金属甲表面有气泡产生,金属乙表面无气泡产生,此实验说明甲的金属活动性比乙的 ;若把这两种金属用导线连接后平行插入稀硫酸中,则可观察到金属 的表面有气泡产生,一段时间后金属 的质量减少。2、已知氧化还原反应
Cu + 2FeCl3 = 2FeCl2 + CuCl2,
利用这一反应设计一个原电池,画出示意图,
标出电极材料,电解质溶液,写出电极反应式。
正极:负极:总反应:Cu-2e - =Cu2+2Fe3++2e- =2Fe2+2Fe3++Cu=2Fe2++Cu2+4.为获得较长时间的稳定电流,如何将由“Zn-稀H2SO4-Cu”组成的原电池(如左下图)进行简单改装?
把化学能转变为电能的装置 理解:
①外形--无外加电源
②放热的氧化还原反应才可能被设计成原电池 两种相连接的活泼性不同的金属同时浸入电解质溶液中(一种可以是非金属导体如碳棒)。2.构成条件:盐桥:在U型管中装用饱和KCl溶液浸泡的棉绳. 盐桥的作用:
使Cl-向锌盐方向移动,K+向铜盐方向移动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子不断
从Zn极流向Cu极。3.原电池的化学原理电子从负极(较活泼金属)流向正极(较不活泼金属或碳棒),
负极发生氧化反应,正极发生还原反应。4.半电池:包括电极材料和电解质溶液,两个隔离
的半电池通过盐桥连接起来。练习判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.1(∨)2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑(∨)负极:正极:总反应:Zn-2e- =Zn2+2H++2e- =H2↑Zn+2H+=Zn2++H2↑(∨)正极:负极:总反应:Fe-2e - =Fe2+Cu2++2e- =CuFe+Cu2+=Fe2++CuFe+CuSO4=Cu+FeSO423Zn+2HCl=ZnCl2+H2↑54(×)(∨)负极:正极:总反应:Zn-2e-=Zn2+Cu2++2e-=CuZn+Cu2+=Zn2++Cu或 Zn+CuSO4=ZnSO4+Cu二、原电池正负极判断--原电池原理的应用1.由组成原电池的电极材料判断
一般 负极- 的金属
正极- 的金属
或 导体,以及某些金属
氧化物
可以理解成: 与电解质溶液反应 练习:Mg-Al-H2SO4中 是正极,
是负极
Mg-Al-NaOH中 是正极 是负极MgAlAlMg 活泼性强活泼性弱非金属负极二、原电池正负极判断--原电池原理的应用1.由组成原电池的电极材料判断2.根据电子(电流)流动的方向判断
电子--由 流出,流入 ;
电流--由 流出,流入 。负极正极正极负极二、原电池正负极判断--原电池原理的应用1.由组成原电池的电极材料判断2.根据电子(电流)流动的方向判断 3.根据电极反应类型判断
负极-- 电子,发生 反应
正极-- 电子,发生 反应 失得氧化还原二、原电池正负极判断--原电池原理的应用1.由组成原电池的电极材料判断2.根据电子(电流)流动的方向判断 3.根据电极反应类型判断 4.根据电解质溶液离子移动的方向判断
阴离子-向 极移动(负极带正电荷)
阳离子-向 极移动(正极带负电荷) 负正二、原电池正负极判断--原电池原理的应用1.由组成原电池的电极材料判断2.根据电子(电流)流动的方向判断 3.根据电极反应类型判断 4.根据电解质溶液离子移动的方向判断 5.根据电极现象来判断
负极-- ;
正极-- ;牺牲、溶解增重、气泡二、原电池正负极判断--原电池原理的应用1.由组成原电池的电极材料判断2.根据电子(电流)流动的方向判断 3.根据电极反应类型判断 4.根据电解质溶液离子移动的方向判断 5.根据电极现象来判断 6.燃料电池中
燃料在 反应
氧化剂在 反应 负极正极随堂检测 1、把金属甲和乙分别插入稀硫酸中,观察到金属甲表面有气泡产生,金属乙表面无气泡产生,此实验说明甲的金属活动性比乙的 ;若把这两种金属用导线连接后平行插入稀硫酸中,则可观察到金属 的表面有气泡产生,一段时间后金属 的质量减少。2、已知氧化还原反应
Cu + 2FeCl3 = 2FeCl2 + CuCl2,
利用这一反应设计一个原电池,画出示意图,
标出电极材料,电解质溶液,写出电极反应式。
正极:负极:总反应:Cu-2e - =Cu2+2Fe3++2e- =2Fe2+2Fe3++Cu=2Fe2++Cu2+4.为获得较长时间的稳定电流,如何将由“Zn-稀H2SO4-Cu”组成的原电池(如左下图)进行简单改装?
