原子核外电子运动
图片预览










文档简介
课件38张PPT。原子核外电子的运动专题2第一单元(第一轮复习模式研讨)选修三 物质结构与性质二、原子核外电子的运动特征三、原子核外电子的排布一、人类对原子结构的认识历史复习要点课程标准一、了解核外电子的运动状态
二、了解原子构造原理
三、知道原子核外电子的能级分布
四、能用电子排布式表示常见元素
(1—36号)原子核外电子的排布
一、知识与技能
1、了解人类对原子结构的认识历史。
2、了解原子核外电子的运动状况、能级分布、原子结构构
造原理、及基态原子与激发态原子的能量状况。
3、掌握核外电子排布规律以及表示方法。
二、过程与方法
运用模型化的思想方法将抽象的概念形象化;用演绎、归纳等多种逻辑思维方法培养学生的分析问题解决问题的能力。
三、情感、态度和价值观
通过本节课的复习,进一步感受和体会科学家进行研究和认识物质的科学方法,培养科学的思维方式,激发学生探究未知世界的兴趣和勇气。
?
课标理念感悟1、原子是由哪些基本微粒构成的?
2、构成原子的各种微粒是否带有电荷?为什么原子是电中性的?
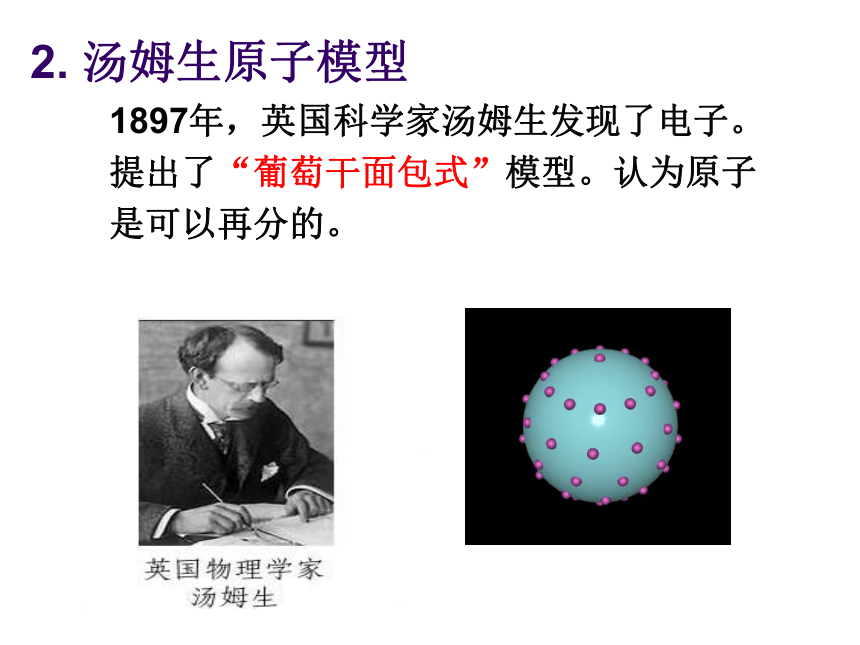
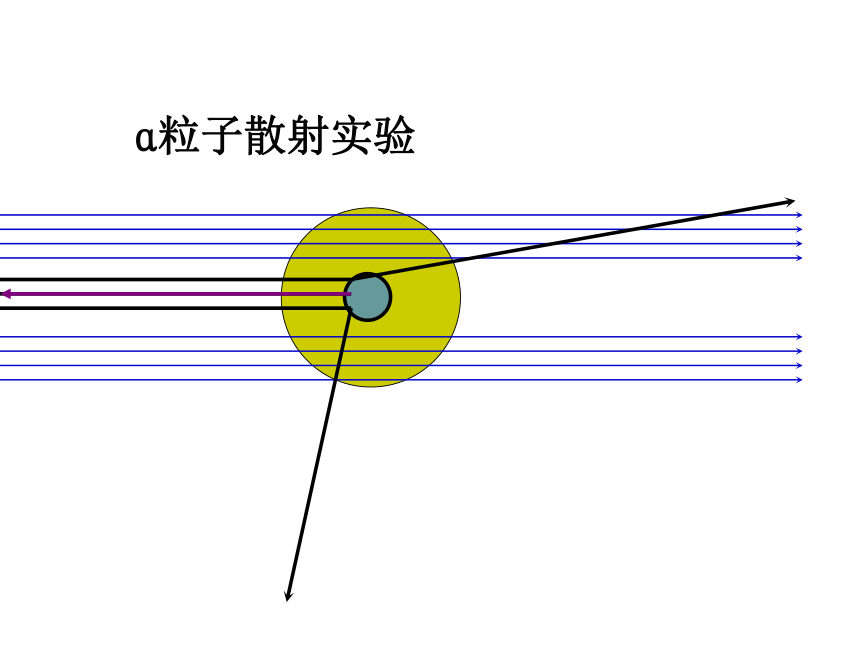
3、构成原子的各种微粒在数量上有什么规律?这些微粒的体积和质量有什么特点?你知道吗?1. 道尔顿原子模型 19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体,在化学反应中保持本性不变。一、原子结构的认识历史课堂求知互动2. 汤姆生原子模型 1897年,英国科学家汤姆生发现了电子。提出了“葡萄干面包式”模型。认为原子 是可以再分的。3. 卢瑟福原子模型 1911年,英国物理学家卢瑟褔通过α粒子散射实验提出带核的原子结构模型。认为原子是由带正电荷的原子核和带负电核外电子构成。卢瑟福认为原子质量主要集中在原子核上,电子在原子核外空间高速运动。卢瑟福——原子之父α粒子散射实验4.波尔原子模型 1913年,丹麦物理学家玻尔把普朗克的相关理论与卢瑟福的原子模型相结合,较好地解释了氢原子光谱,提出新的原子结构模型。
5、电子云模型2 卢瑟福从α粒子散射实验得出了什么结论?
1 道尔顿的原子学说曾经起了很大作用。他的学说中包含有下述论点:①原子是不能再分的微粒;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代的观点看,你认为这3个论点中,不确切的是( )
A.只有③ B.只有①,③
C.只有②③ D.有①②③ A.原子中存在原子核,它占原子中极小的体积
B.原子核带正电荷,且电荷数远大于α粒子
C.金原子核质量远大于α粒子针对训练3 从原子结构模型的演变历史中,我们可得到的启迪是
A.实验是揭示原子结构奥秘的重要手段
B.早期的化学家在研究过程不够细致,所以没有发现正确的原子结构模型
C.玻尔原子结构模型以前的各种原子结构模型都是不正确的,对学习认识原子结构是毫无用处的
D.继承、积累、突破和革命是科学发展的形式 4 1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域做出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。下列说法正确的是
A.化学不做实验就什么都不知道
B.化学不再需要实验
C.化学不再是纯实验科学
D.未来化学的方向是经验化启示:人类对原子结构认识的逐渐深入,都是建立在实验研究基础上的,实验是揭示原子结构的重要手段。
汤姆生、卢瑟福、玻尔等几位科学家都是诺贝尔科学奖获得者,他们勇于怀疑科学上的“定论”,不迷信权威,为科学的发展作出了重要贡献。自然科学就是在不断探索中修正错误而前进的。
请同学们课后搜集有关几位科学家的生平事迹以及他们研究原子结构的过程,相互交流并写出心得体会。原子核外电子的运动状态(原子轨道)二、原子核外电子的排布相关知识链接原子核外电子的运动特征(电子云)原子核外电子的排布规律
1S电子在原子核外出现的概率分布图讨论:原子核外电子运动有哪些特征?人们按照图示的方法制作电子云的轮廓图常把电子出现的概率约为
90%的空间圈出来 S的原子轨道是________形的,电子层序数越大,原子轨道的________。 P的原子轨道是________形的,每个P轨道有_______个轨道,它们互相垂直,分别以_____、______、_______为符号。P原子轨道的平均半径也随电子层序数增大而_____。 问题1:完成下面表格问题2:问题3:完成下面表格电子层 KLMNOP1s2s2p3s3p3d4s4p4d4f轨道核 外 电 子 填 充 顺 序 图轨道能量顺序7↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↑↑↑洪特规则泡利不相容原理能量最低原理用轨道表示式表示出26Fe原子的核外电子排布 二、原子核外电子的排布(1) (2) (3)
(4)
(5)
(6)
违反泡利不相容原理的有 ,违反洪特规则的有 。以下列出的是一些原子的2p轨道和3d轨道中电子排布的情况。试判断,哪些违反了泡利不相容原理?哪些违反了洪特规则?针对训练:1、分别再用原子结构示意图、电子排布式、电子排布式的简化形式、外围电子排布式表示出26Fe原子的核外电子排布
2、请你通过比较、归纳,分别说出这些不同化学用语所能反映的粒子结构信息。 课堂求知互动1.最低能量原理──电子在原子轨道上的排布,要尽可能使电子的能量最低。2.泡利不相容原理──每个原子轨道最多只能容纳两个电子,且自旋方向必须相反。3.洪特规则──电子在等价轨道(能量相同的轨道)上排布时,总是尽可能分占不同的轨道,且自旋方向相同。这种排布,电子的能量最低。针对训练写出下列元素原子结构示意图、电子排布式及其简化形式、外围电子排布式、电子轨道表示式: 根据洪特规则,人们总结出,当同一亚层轨道半充满、全充满以及全空时,是比较稳定的。洪特规则特例:全充满半充满全空本课总结:知识体系1、在物质结构研究的历史上,首先提出原子内有电子学说的是 ( )
A、道尔顿 B、卢瑟福
C、汤姆生 D、波尔课堂反馈 2、下列表达式错误的是 ( ) A .甲烷的电子式
B.氮原子的L层电子轨道表示式:
C.硫离子的核外电子排布式:1s22s22p63s23p4
D.碳-12原子: 6C12
3、以下原子轨道符号正确的是: ( )
A.6s B.2d C.3f D.7p
例13以下电子式排布式不是基态原子的电子式排布式的是
A.1s22s1 B.1s22s22p53s1
C.[Ne]3s23p63d1 D.[Ar] 3d64s2 5、 下列原子或离子,电子式排布式错误的是( )
A.K 1s22s22p63s23p63d1 B.Ca2+ 1s22s22p63s23p6
C.Cl— 1s22s22p63s23p6 D.S 1s22s22p63s23p46、以下电子式排布式不是基态原子的电子式排布式的是
A.1s22s1 B.1s22s22p53s1
C.[Ne]3s23p63d1 D.[Ar] 3d64s2 4、 某电子层n,当它为最外电子层时,容纳的最多电子数与n-1层相同,当它为次外电子层时,其电子数比n+1层最多能多10个,则此电子层应是
A.K层 B.L层 C.M层 D.N层 8、 A的原子中只有一个电子层且只含1 个电子;B的原子3p轨道上得到1个电子后不能再容纳外来电子;C的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;D的原子第三电子层上有8个电子,第四电子层上只有1个电子;E原子的外围电子排布为3s23p6。 则各元素是何种元素?7.同一原子的基态和激发态相比较:( )
A、基态时的能量比激发态时高 B、基态时比较稳定
C、基态时的能量比激发态时低 D、激发态时比较稳定
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。 07山东32题体验高考现有部分短周期元素的性质或原子结构如下表07上海23题(1)写出元素X的离子结构示意图 。
写出元素Z的气态氢化物的电子式 (用元素符号表示)
(2)写出Y元素最高价氧化物水化物的电离方程式
(3)元素T与氯元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a 常温下氯气的颜色比T单质的颜色深
b T的单质通入氯化钠水溶液不能置换出氯气
c 氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之—。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是 ,理由 。
二、了解原子构造原理
三、知道原子核外电子的能级分布
四、能用电子排布式表示常见元素
(1—36号)原子核外电子的排布
一、知识与技能
1、了解人类对原子结构的认识历史。
2、了解原子核外电子的运动状况、能级分布、原子结构构
造原理、及基态原子与激发态原子的能量状况。
3、掌握核外电子排布规律以及表示方法。
二、过程与方法
运用模型化的思想方法将抽象的概念形象化;用演绎、归纳等多种逻辑思维方法培养学生的分析问题解决问题的能力。
三、情感、态度和价值观
通过本节课的复习,进一步感受和体会科学家进行研究和认识物质的科学方法,培养科学的思维方式,激发学生探究未知世界的兴趣和勇气。
?
课标理念感悟1、原子是由哪些基本微粒构成的?
2、构成原子的各种微粒是否带有电荷?为什么原子是电中性的?
3、构成原子的各种微粒在数量上有什么规律?这些微粒的体积和质量有什么特点?你知道吗?1. 道尔顿原子模型 19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体,在化学反应中保持本性不变。一、原子结构的认识历史课堂求知互动2. 汤姆生原子模型 1897年,英国科学家汤姆生发现了电子。提出了“葡萄干面包式”模型。认为原子 是可以再分的。3. 卢瑟福原子模型 1911年,英国物理学家卢瑟褔通过α粒子散射实验提出带核的原子结构模型。认为原子是由带正电荷的原子核和带负电核外电子构成。卢瑟福认为原子质量主要集中在原子核上,电子在原子核外空间高速运动。卢瑟福——原子之父α粒子散射实验4.波尔原子模型 1913年,丹麦物理学家玻尔把普朗克的相关理论与卢瑟福的原子模型相结合,较好地解释了氢原子光谱,提出新的原子结构模型。
5、电子云模型2 卢瑟福从α粒子散射实验得出了什么结论?
1 道尔顿的原子学说曾经起了很大作用。他的学说中包含有下述论点:①原子是不能再分的微粒;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代的观点看,你认为这3个论点中,不确切的是( )
A.只有③ B.只有①,③
C.只有②③ D.有①②③ A.原子中存在原子核,它占原子中极小的体积
B.原子核带正电荷,且电荷数远大于α粒子
C.金原子核质量远大于α粒子针对训练3 从原子结构模型的演变历史中,我们可得到的启迪是
A.实验是揭示原子结构奥秘的重要手段
B.早期的化学家在研究过程不够细致,所以没有发现正确的原子结构模型
C.玻尔原子结构模型以前的各种原子结构模型都是不正确的,对学习认识原子结构是毫无用处的
D.继承、积累、突破和革命是科学发展的形式 4 1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域做出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。下列说法正确的是
A.化学不做实验就什么都不知道
B.化学不再需要实验
C.化学不再是纯实验科学
D.未来化学的方向是经验化启示:人类对原子结构认识的逐渐深入,都是建立在实验研究基础上的,实验是揭示原子结构的重要手段。
汤姆生、卢瑟福、玻尔等几位科学家都是诺贝尔科学奖获得者,他们勇于怀疑科学上的“定论”,不迷信权威,为科学的发展作出了重要贡献。自然科学就是在不断探索中修正错误而前进的。
请同学们课后搜集有关几位科学家的生平事迹以及他们研究原子结构的过程,相互交流并写出心得体会。原子核外电子的运动状态(原子轨道)二、原子核外电子的排布相关知识链接原子核外电子的运动特征(电子云)原子核外电子的排布规律
1S电子在原子核外出现的概率分布图讨论:原子核外电子运动有哪些特征?人们按照图示的方法制作电子云的轮廓图常把电子出现的概率约为
90%的空间圈出来 S的原子轨道是________形的,电子层序数越大,原子轨道的________。 P的原子轨道是________形的,每个P轨道有_______个轨道,它们互相垂直,分别以_____、______、_______为符号。P原子轨道的平均半径也随电子层序数增大而_____。 问题1:完成下面表格问题2:问题3:完成下面表格电子层 KLMNOP1s2s2p3s3p3d4s4p4d4f轨道核 外 电 子 填 充 顺 序 图轨道能量顺序7↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↑↑↑洪特规则泡利不相容原理能量最低原理用轨道表示式表示出26Fe原子的核外电子排布 二、原子核外电子的排布(1) (2) (3)
(4)
(5)
(6)
违反泡利不相容原理的有 ,违反洪特规则的有 。以下列出的是一些原子的2p轨道和3d轨道中电子排布的情况。试判断,哪些违反了泡利不相容原理?哪些违反了洪特规则?针对训练:1、分别再用原子结构示意图、电子排布式、电子排布式的简化形式、外围电子排布式表示出26Fe原子的核外电子排布
2、请你通过比较、归纳,分别说出这些不同化学用语所能反映的粒子结构信息。 课堂求知互动1.最低能量原理──电子在原子轨道上的排布,要尽可能使电子的能量最低。2.泡利不相容原理──每个原子轨道最多只能容纳两个电子,且自旋方向必须相反。3.洪特规则──电子在等价轨道(能量相同的轨道)上排布时,总是尽可能分占不同的轨道,且自旋方向相同。这种排布,电子的能量最低。针对训练写出下列元素原子结构示意图、电子排布式及其简化形式、外围电子排布式、电子轨道表示式: 根据洪特规则,人们总结出,当同一亚层轨道半充满、全充满以及全空时,是比较稳定的。洪特规则特例:全充满半充满全空本课总结:知识体系1、在物质结构研究的历史上,首先提出原子内有电子学说的是 ( )
A、道尔顿 B、卢瑟福
C、汤姆生 D、波尔课堂反馈 2、下列表达式错误的是 ( ) A .甲烷的电子式
B.氮原子的L层电子轨道表示式:
C.硫离子的核外电子排布式:1s22s22p63s23p4
D.碳-12原子: 6C12
3、以下原子轨道符号正确的是: ( )
A.6s B.2d C.3f D.7p
例13以下电子式排布式不是基态原子的电子式排布式的是
A.1s22s1 B.1s22s22p53s1
C.[Ne]3s23p63d1 D.[Ar] 3d64s2 5、 下列原子或离子,电子式排布式错误的是( )
A.K 1s22s22p63s23p63d1 B.Ca2+ 1s22s22p63s23p6
C.Cl— 1s22s22p63s23p6 D.S 1s22s22p63s23p46、以下电子式排布式不是基态原子的电子式排布式的是
A.1s22s1 B.1s22s22p53s1
C.[Ne]3s23p63d1 D.[Ar] 3d64s2 4、 某电子层n,当它为最外电子层时,容纳的最多电子数与n-1层相同,当它为次外电子层时,其电子数比n+1层最多能多10个,则此电子层应是
A.K层 B.L层 C.M层 D.N层 8、 A的原子中只有一个电子层且只含1 个电子;B的原子3p轨道上得到1个电子后不能再容纳外来电子;C的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;D的原子第三电子层上有8个电子,第四电子层上只有1个电子;E原子的外围电子排布为3s23p6。 则各元素是何种元素?7.同一原子的基态和激发态相比较:( )
A、基态时的能量比激发态时高 B、基态时比较稳定
C、基态时的能量比激发态时低 D、激发态时比较稳定
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。 07山东32题体验高考现有部分短周期元素的性质或原子结构如下表07上海23题(1)写出元素X的离子结构示意图 。
写出元素Z的气态氢化物的电子式 (用元素符号表示)
(2)写出Y元素最高价氧化物水化物的电离方程式
(3)元素T与氯元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a 常温下氯气的颜色比T单质的颜色深
b T的单质通入氯化钠水溶液不能置换出氯气
c 氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之—。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是 ,理由 。
