《弱电解质的电离平衡》教学课件
图片预览






文档简介
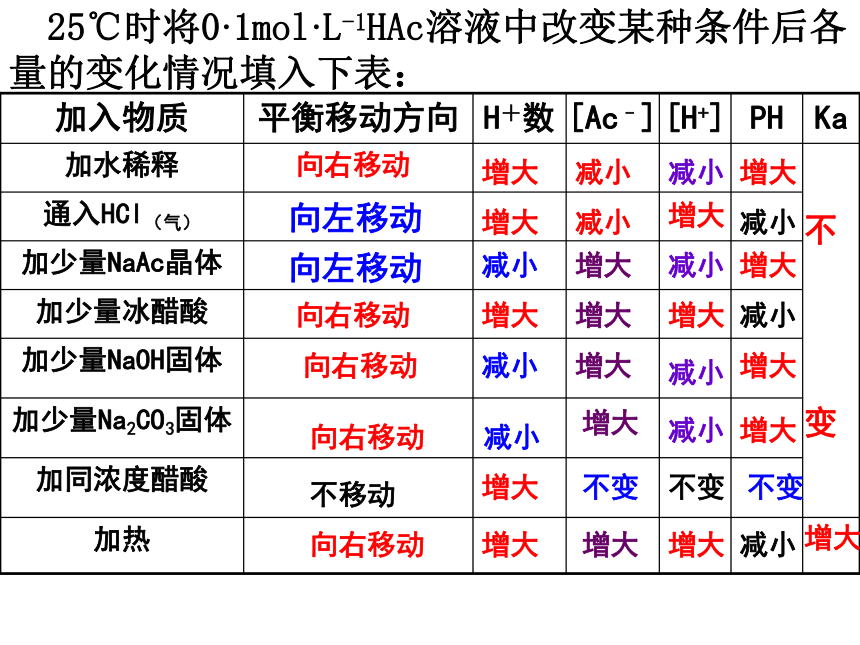
课件16张PPT。弱电解质的电离平衡(二) 25℃时将0·1mol·L-1HAc溶液中改变某种条件后各量的变化情况填入下表: 向右移动向左移动向右移动向右移动向右移动不移动向右移动增大增大增大增大增大增大减小减小减小减小增大增大增大增大不变减小增大减小增大减小减小
不
变不变增大减小增大减小增大增大不变增大减小增大减小向左移动⑴弱电解质的电离平衡 1、概念:在一定条件(如浓度、温度)下,当弱电解质在溶液里分子化速率与离子化速率相等时,电离过程就达到平衡状态,叫电离平衡。弱电解质的电离平衡是动态平衡,勒夏特列原 理同样适用于电离平衡。 2、特点:逆:可逆过程等:分子化速率与离子化速率相等动:动态平衡定:平衡时溶液中分子离子浓度保持不变变:改变条件(C、T等),电离平衡发生移动3、影响因素 温度 浓度外来的酸、碱、盐 4、电离方程式的书写及识别 ①抓强弱电解质如:HAc ? H++Ac-NaHCO3=Na++HCO3-②多元弱酸分步电离分步书写H2S ? H++HS-HS- ? H++ S2-③注意电离方程式与水解方程式的区别:前者方程式后边是阴阳离子,后者是酸碱 ④多元弱酸盐电离:NaHS=Na++HS-HS- ? S2-+H+ 例1、〔99MCE〕用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( ) B 例2、下列溶液中,A、向0.1mol/L氨水中加入同体积的水;B、向0.1mol/LKOH溶液中入同体积的水;C、向0.2mol/L氨水中加入同体积的0.1mol/LHCl;D、向0.1mol/LKOH溶液中加入同体积的0.1mol/LHCl。这四种溶液中,[OH-]由大到小的正确顺序是: B>A>C>D 例3、(2000上海)取pH值均等于2的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是( )
A. 醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C. 醋酸与锌反应速率大
D、盐酸和醋酸分别与锌反应的速率一样大 BC例4、对25℃时的醋酸溶液,若采用下列不同措施:①加少量NaOH固体 ②加少量CaCO3固体 ③加等体积的水 ④加热醋酸溶液使温度升高10℃ ⑤加少量NaAc晶体 ⑥加盐酸,其中能促进醋酸电离的有:( ) A、①③④ B、①②③④ C、①③④⑤ D、①②③④⑤ B 例4、H+离子浓度相同的等体积两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌且放出氢气的质量相同,则下列说法正确的是:①反应所需要的时间B>A,②开始反应时的速率A>B,③参加反应的锌的物质的量A=B,④反应过程的平均速率B > A,⑤盐酸里有锌剩余,⑥醋酸里有锌剩余。
A、③④⑤ B、③④⑥ C、②③⑤ D、②③⑤⑥A⑵电离平衡常数 1、概念: 在一定条件下,弱电解质的电离达到平衡时,弱电解质电离生成的各种离子浓度乘积,跟溶液中未电离的分子浓度的比是一个常数。叫电离平衡常数,简称电离常数,用K表示。2、计算式: 一般弱酸的用Ka表示,弱碱地用Kb表示 HAc ? H+ + Ac-起始量变化量 平衡量当Ka﹤10-4 , NH3·H2O ? NH4+ + OH-起始量变化量 平衡量当Kb﹤10-4, 3、意义: A、K反应了电离平衡时,各组分浓度的关系 B、K值大小可以判断弱电解质相对强弱 4、影响因素 温度 例1:已知电离度是已电离的弱电解质分子数占电解质分子总数的百分数。.在1L浓度为cmol/L的弱酸HA溶液中,HA、H+和A-的物质的量之和ncmol,则HA的电离度是 [ ]C下表是常见弱酸的电离平衡常数(25℃) 2、对于弱酸,在一定条件温度下达到电离平衡时,各微粒的浓度存在一种定量关系:若25℃时,HA ? H++A- , 则 K= 式中:K为电离平衡常数只与温度有关,c为平衡浓度。CH3COOH ? CH3COO-+H+K=1.76×10-5H2S ? H++HS-HCO3- ? H++ CO32-K2=5.61×10-11K1=4.31×10-7H2CO3 ? H++HCO3-HS- ? H++ S2-K1=9.1×10-8K2=1.1×10-12H3PO4 ? H++H2PO4-H2PO4 ? H++HPO42-HPO4 ? H++PO43-K1=7.5×10-3K2=6.23×10-8回答下列各问:K3=2.2×10-13 (1)、K只于温度有关,当温度升高时,K值 。 增大(4)、多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2 、K3之间存在着数量上的规律是: 。(2)、在温度相同时,各弱酸的K值不同,K值越大酸的酸性 。越强(3)、若把CH3COOH ,H2CO3,HCO3-,H2S,HS- ,H3PO4。H2PO4-;HPO42-都看成酸,其中酸性最强的是 ;酸性最强弱的是 。 H3PO4 HPO42-K1>K2 >K35、几个注意的问题: B、稀醋酸和稀磷酸的稀释:电离程度增大,而离子浓度始终是减小的。 ⑴稀释弱电解质溶液(温度不变),电离程度 ,平衡向 移动,自由离子数目 ;离子浓度 ,溶液导电能力 。电离平衡常数 (填变或不变)增大电离方向增多增大或减小增强或减弱不变A、对于冰醋酸和磷酸:加水溶解并不断稀释的过程中,电离程度 平衡向 移动自由离子浓度先 后 ;增大电离方向大小例1:冰醋酸加水溶解并不断稀释过程中,溶液导电能力与加入水的体积有如下变化关系:试回答:a﹥c﹥ b C 相等⑴“0”点导电能力为0的理由是: ⑵a、b、c三点对应溶液的PH值由大到小的顺序是 ⑶a、b、c三点中电离程度最大的是 。电离平衡常数的关系 .①加碱②加碳酸钠③加镁或锌 2、有两瓶pH=2的酸溶液,一瓶是强酸,一瓶是弱酸.现只有石蕊试液、酚酞试液、pH试纸和蒸馏水,而没有其它试剂.简述如何用最简便的实验方法来判别哪瓶是强酸: 各取等体积酸液,用蒸馏水稀释相同倍数,然后用PH试纸分别测其PH值,PH值变化大的那瓶是强酸.
不
变不变增大减小增大减小增大增大不变增大减小增大减小向左移动⑴弱电解质的电离平衡 1、概念:在一定条件(如浓度、温度)下,当弱电解质在溶液里分子化速率与离子化速率相等时,电离过程就达到平衡状态,叫电离平衡。弱电解质的电离平衡是动态平衡,勒夏特列原 理同样适用于电离平衡。 2、特点:逆:可逆过程等:分子化速率与离子化速率相等动:动态平衡定:平衡时溶液中分子离子浓度保持不变变:改变条件(C、T等),电离平衡发生移动3、影响因素 温度 浓度外来的酸、碱、盐 4、电离方程式的书写及识别 ①抓强弱电解质如:HAc ? H++Ac-NaHCO3=Na++HCO3-②多元弱酸分步电离分步书写H2S ? H++HS-HS- ? H++ S2-③注意电离方程式与水解方程式的区别:前者方程式后边是阴阳离子,后者是酸碱 ④多元弱酸盐电离:NaHS=Na++HS-HS- ? S2-+H+ 例1、〔99MCE〕用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( ) B 例2、下列溶液中,A、向0.1mol/L氨水中加入同体积的水;B、向0.1mol/LKOH溶液中入同体积的水;C、向0.2mol/L氨水中加入同体积的0.1mol/LHCl;D、向0.1mol/LKOH溶液中加入同体积的0.1mol/LHCl。这四种溶液中,[OH-]由大到小的正确顺序是: B>A>C>D 例3、(2000上海)取pH值均等于2的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是( )
A. 醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C. 醋酸与锌反应速率大
D、盐酸和醋酸分别与锌反应的速率一样大 BC例4、对25℃时的醋酸溶液,若采用下列不同措施:①加少量NaOH固体 ②加少量CaCO3固体 ③加等体积的水 ④加热醋酸溶液使温度升高10℃ ⑤加少量NaAc晶体 ⑥加盐酸,其中能促进醋酸电离的有:( ) A、①③④ B、①②③④ C、①③④⑤ D、①②③④⑤ B 例4、H+离子浓度相同的等体积两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌且放出氢气的质量相同,则下列说法正确的是:①反应所需要的时间B>A,②开始反应时的速率A>B,③参加反应的锌的物质的量A=B,④反应过程的平均速率B > A,⑤盐酸里有锌剩余,⑥醋酸里有锌剩余。
A、③④⑤ B、③④⑥ C、②③⑤ D、②③⑤⑥A⑵电离平衡常数 1、概念: 在一定条件下,弱电解质的电离达到平衡时,弱电解质电离生成的各种离子浓度乘积,跟溶液中未电离的分子浓度的比是一个常数。叫电离平衡常数,简称电离常数,用K表示。2、计算式: 一般弱酸的用Ka表示,弱碱地用Kb表示 HAc ? H+ + Ac-起始量变化量 平衡量当Ka﹤10-4 , NH3·H2O ? NH4+ + OH-起始量变化量 平衡量当Kb﹤10-4, 3、意义: A、K反应了电离平衡时,各组分浓度的关系 B、K值大小可以判断弱电解质相对强弱 4、影响因素 温度 例1:已知电离度是已电离的弱电解质分子数占电解质分子总数的百分数。.在1L浓度为cmol/L的弱酸HA溶液中,HA、H+和A-的物质的量之和ncmol,则HA的电离度是 [ ]C下表是常见弱酸的电离平衡常数(25℃) 2、对于弱酸,在一定条件温度下达到电离平衡时,各微粒的浓度存在一种定量关系:若25℃时,HA ? H++A- , 则 K= 式中:K为电离平衡常数只与温度有关,c为平衡浓度。CH3COOH ? CH3COO-+H+K=1.76×10-5H2S ? H++HS-HCO3- ? H++ CO32-K2=5.61×10-11K1=4.31×10-7H2CO3 ? H++HCO3-HS- ? H++ S2-K1=9.1×10-8K2=1.1×10-12H3PO4 ? H++H2PO4-H2PO4 ? H++HPO42-HPO4 ? H++PO43-K1=7.5×10-3K2=6.23×10-8回答下列各问:K3=2.2×10-13 (1)、K只于温度有关,当温度升高时,K值 。 增大(4)、多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2 、K3之间存在着数量上的规律是: 。(2)、在温度相同时,各弱酸的K值不同,K值越大酸的酸性 。越强(3)、若把CH3COOH ,H2CO3,HCO3-,H2S,HS- ,H3PO4。H2PO4-;HPO42-都看成酸,其中酸性最强的是 ;酸性最强弱的是 。 H3PO4 HPO42-K1>K2 >K35、几个注意的问题: B、稀醋酸和稀磷酸的稀释:电离程度增大,而离子浓度始终是减小的。 ⑴稀释弱电解质溶液(温度不变),电离程度 ,平衡向 移动,自由离子数目 ;离子浓度 ,溶液导电能力 。电离平衡常数 (填变或不变)增大电离方向增多增大或减小增强或减弱不变A、对于冰醋酸和磷酸:加水溶解并不断稀释的过程中,电离程度 平衡向 移动自由离子浓度先 后 ;增大电离方向大小例1:冰醋酸加水溶解并不断稀释过程中,溶液导电能力与加入水的体积有如下变化关系:试回答:a﹥c﹥ b C 相等⑴“0”点导电能力为0的理由是: ⑵a、b、c三点对应溶液的PH值由大到小的顺序是 ⑶a、b、c三点中电离程度最大的是 。电离平衡常数的关系 .①加碱②加碳酸钠③加镁或锌 2、有两瓶pH=2的酸溶液,一瓶是强酸,一瓶是弱酸.现只有石蕊试液、酚酞试液、pH试纸和蒸馏水,而没有其它试剂.简述如何用最简便的实验方法来判别哪瓶是强酸: 各取等体积酸液,用蒸馏水稀释相同倍数,然后用PH试纸分别测其PH值,PH值变化大的那瓶是强酸.
