《盐类的水解》教学课件
图片预览






文档简介
课件22张PPT。 第三单元
盐类的水解【问题】:
酸溶液显酸性,碱溶液显碱性,
盐溶液是否都显中性?
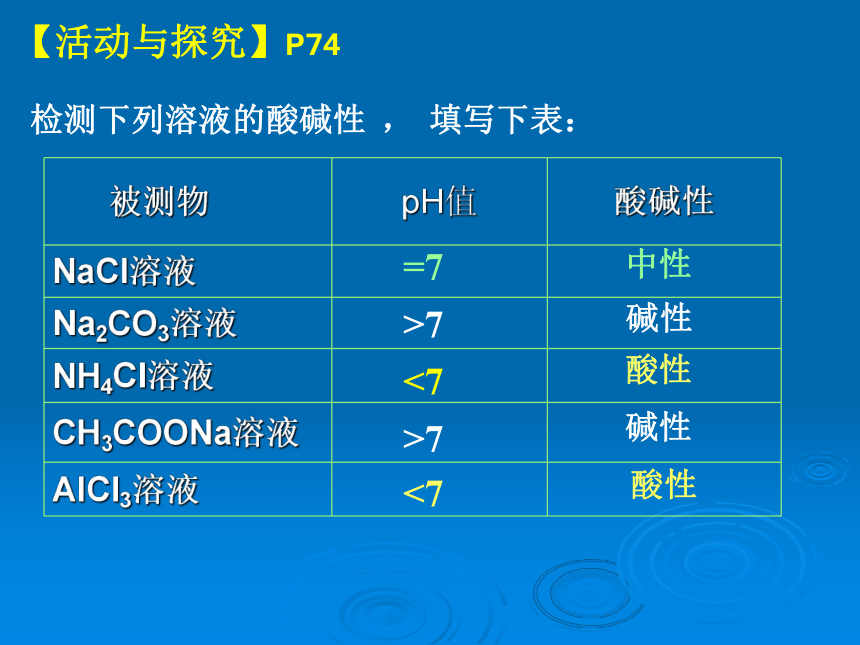
(例如:Na2CO3 是盐,又叫纯碱, 为什么?)检测下列溶液的酸碱性 , 填写下表:中性碱性碱性酸性酸性 【活动与探究】P74=7<7<7>7>7中性碱性酸性强酸弱碱盐弱酸强碱盐强酸强碱盐 探究问题: 试用归纳法找出盐的组成与盐溶液的酸碱性关系思考:为什么不同类型盐溶液的酸碱性不同呢?(1)CH3COONa溶液中存在着几种离子?
(2)哪些离子可能相互结合,对水的电离
平衡有何影响?
(3)为什么CH3COONa溶液显碱性?请思考探究盐溶液呈不同酸碱性的原因:
以CH3COONa溶液为例H2O H+ + OH_
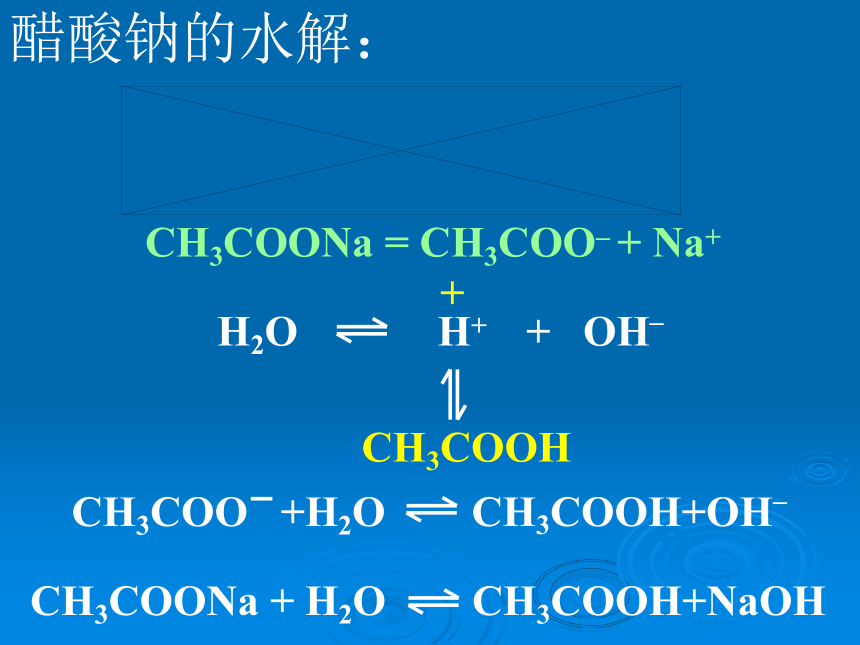
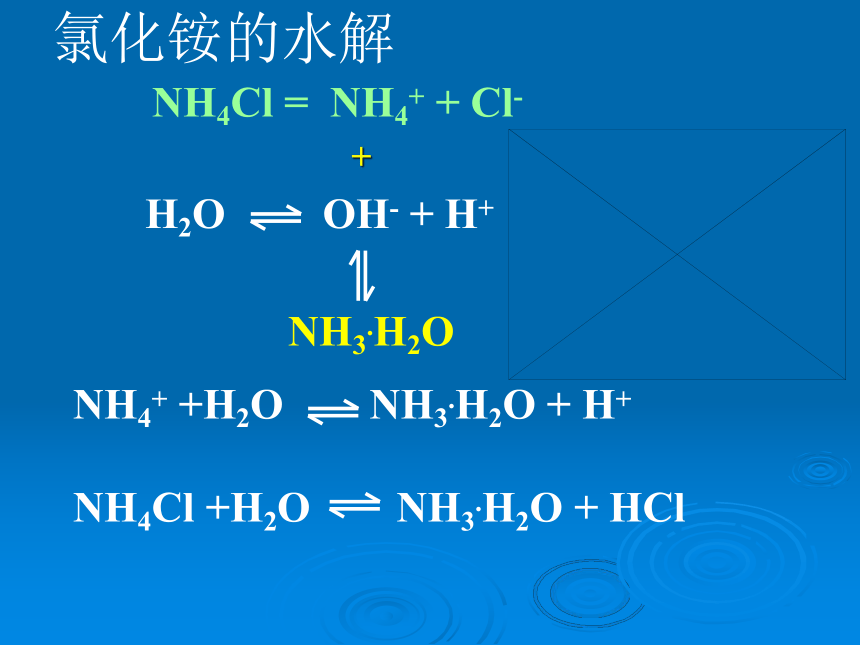
醋酸钠的水解:CH3COONa = CH3COO_ + Na++ CH3COOH CH3COONa + H2O CH3COOH+NaOH氯化铵的水解NH4Cl = NH4+ + Cl-
H2O OH- + H+NH3.H2O
NH4+ +H2O NH3.H2O + H+
NH4Cl +H2O NH3.H2O + HCl+一、盐类的水解1、定义:盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。2、水解的实质:
促进水的电离,使溶液呈酸性或碱性。1、NaF溶液
2、K2S溶液
3、CuCl2溶液
4、NH4Cl溶液
5、Na2SO4溶液
6、KNO3溶液练习:判断以下溶液的酸碱性酸性碱性中性酸性碱性中性3、盐类水解的规律:有弱才水解,无弱不水解;
谁强显谁性,同强显中性;越弱越水解,弱弱双水解!4、水解的特点:①是中和反应的逆反应,存在水解平衡;②吸热反应;③水解程度很小,故水解产物较少,
盐溶液的酸碱性一般较弱。CH3COO - + H2O CH3COOH + OH- △H>0 0.1mol/L的CH3COONa溶液中,
存在哪些离子?
各离子的浓度大小关系如何?
请按从大到小排列习题:c(Na+) > c(CH3COO- ) > c(OH-) > c( H+)5、水解反应方程式的书写 B、一般不用“ ↑、↓ ”C、多元弱酸根离子的水解分步写,一
般只写第一步D、多元弱碱阳离子的水解一步到位练习:写出下列物质水解反应的化学方程式和离子方程式CuCl2:
NaF :
NH4Cl:
Na2S:
练习①在水中加入下列物质,可使水的电离平衡向电离的方向移动的是( )
A、H2SO4 B、KOH
C、FeCl3 D、Ba(NO3)2CD③ 物质的量浓度相同的下列溶液中,含微粒种类最多的是( )
A、CaCl2 B、CH 3COONa
C、NH3 D、K2S④ 为了使Na2CO3溶液中c (Na+)/c(CO32-)的比值接近2:1,可加入的物质是( )
A.水 B.适量Na2CO3粉末
C.适量KOH固体 D.适量NaOH固体DCB作业:课本 P80 4、5、6
倍速 P63-64①不同弱酸对应的盐NaClO CH3COONaMgCl2 AlCl3对应的酸:HClO < CH3COOH碱 性:②不同弱碱对应的盐对应的碱:酸 性:Mg(OH)2>Al(OH)3﹥﹤H2O H+ + OH_
CO32- +H2O HCO3- + OH- (第一步水解)HCO3- +H2O H2CO3+ OH-
(第二步水解,更弱)Na2CO3 = CO32- + 2Na+ +碳酸钠的水解 HCO3- 氯化铜的水解CuCl 2= Cu2+ + 2Cl-
2H2O 2OH- + 2H+Cu(OH) 2
Cu2+ + 2H2O Cu(OH) 2 + 2H+
+谢谢大家!
盐类的水解【问题】:
酸溶液显酸性,碱溶液显碱性,
盐溶液是否都显中性?
(例如:Na2CO3 是盐,又叫纯碱, 为什么?)检测下列溶液的酸碱性 , 填写下表:中性碱性碱性酸性酸性 【活动与探究】P74=7<7<7>7>7中性碱性酸性强酸弱碱盐弱酸强碱盐强酸强碱盐 探究问题: 试用归纳法找出盐的组成与盐溶液的酸碱性关系思考:为什么不同类型盐溶液的酸碱性不同呢?(1)CH3COONa溶液中存在着几种离子?
(2)哪些离子可能相互结合,对水的电离
平衡有何影响?
(3)为什么CH3COONa溶液显碱性?请思考探究盐溶液呈不同酸碱性的原因:
以CH3COONa溶液为例H2O H+ + OH_
醋酸钠的水解:CH3COONa = CH3COO_ + Na++ CH3COOH CH3COONa + H2O CH3COOH+NaOH氯化铵的水解NH4Cl = NH4+ + Cl-
H2O OH- + H+NH3.H2O
NH4+ +H2O NH3.H2O + H+
NH4Cl +H2O NH3.H2O + HCl+一、盐类的水解1、定义:盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。2、水解的实质:
促进水的电离,使溶液呈酸性或碱性。1、NaF溶液
2、K2S溶液
3、CuCl2溶液
4、NH4Cl溶液
5、Na2SO4溶液
6、KNO3溶液练习:判断以下溶液的酸碱性酸性碱性中性酸性碱性中性3、盐类水解的规律:有弱才水解,无弱不水解;
谁强显谁性,同强显中性;越弱越水解,弱弱双水解!4、水解的特点:①是中和反应的逆反应,存在水解平衡;②吸热反应;③水解程度很小,故水解产物较少,
盐溶液的酸碱性一般较弱。CH3COO - + H2O CH3COOH + OH- △H>0 0.1mol/L的CH3COONa溶液中,
存在哪些离子?
各离子的浓度大小关系如何?
请按从大到小排列习题:c(Na+) > c(CH3COO- ) > c(OH-) > c( H+)5、水解反应方程式的书写 B、一般不用“ ↑、↓ ”C、多元弱酸根离子的水解分步写,一
般只写第一步D、多元弱碱阳离子的水解一步到位练习:写出下列物质水解反应的化学方程式和离子方程式CuCl2:
NaF :
NH4Cl:
Na2S:
练习①在水中加入下列物质,可使水的电离平衡向电离的方向移动的是( )
A、H2SO4 B、KOH
C、FeCl3 D、Ba(NO3)2CD③ 物质的量浓度相同的下列溶液中,含微粒种类最多的是( )
A、CaCl2 B、CH 3COONa
C、NH3 D、K2S④ 为了使Na2CO3溶液中c (Na+)/c(CO32-)的比值接近2:1,可加入的物质是( )
A.水 B.适量Na2CO3粉末
C.适量KOH固体 D.适量NaOH固体DCB作业:课本 P80 4、5、6
倍速 P63-64①不同弱酸对应的盐NaClO CH3COONaMgCl2 AlCl3对应的酸:HClO < CH3COOH碱 性:②不同弱碱对应的盐对应的碱:酸 性:Mg(OH)2>Al(OH)3﹥﹤H2O H+ + OH_
CO32- +H2O HCO3- + OH- (第一步水解)HCO3- +H2O H2CO3+ OH-
(第二步水解,更弱)Na2CO3 = CO32- + 2Na+ +碳酸钠的水解 HCO3- 氯化铜的水解CuCl 2= Cu2+ + 2Cl-
2H2O 2OH- + 2H+Cu(OH) 2
Cu2+ + 2H2O Cu(OH) 2 + 2H+
+谢谢大家!
