《分子构型与物质的性质》教学课件
图片预览



文档简介
课件25张PPT。专题4:分子空间结构与物质性质
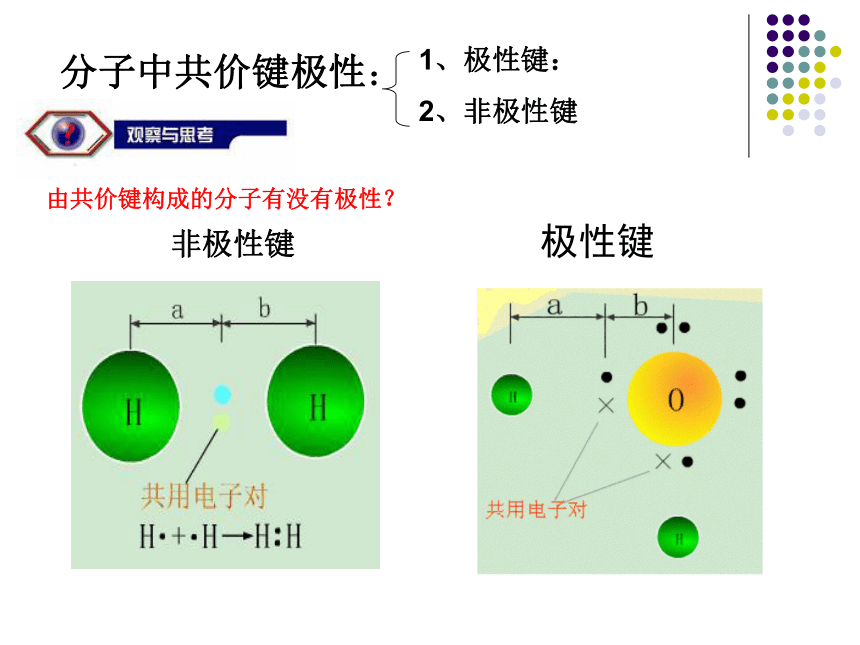
第一单元 分子构型与物质性质第二课时阅读课本65页[实验1] 在培养皿中加入少量四氯化碳,用滴管滴入一滴水(也可滴一滴加了红墨水的水)于培养皿中,将摩擦带电的玻璃棒或塑料棒接近水滴,观察水滴的运动。[实验2] 在盛有2 mL水的试管中加一小粒固体碘,振荡,观察其溶解情况。再向上述试管中加1 mL四氯化碳,振荡。比较碘在水中和四氯化碳中的溶解情况。 我们常说结构决定性质,从上述实验中,你能得到哪些信息?你能试着解释产生不同实验相象的原因吗?由共价键构成的分子有没有极性?分子中共价键极性:1、极性键:
2、非极性键非极性键
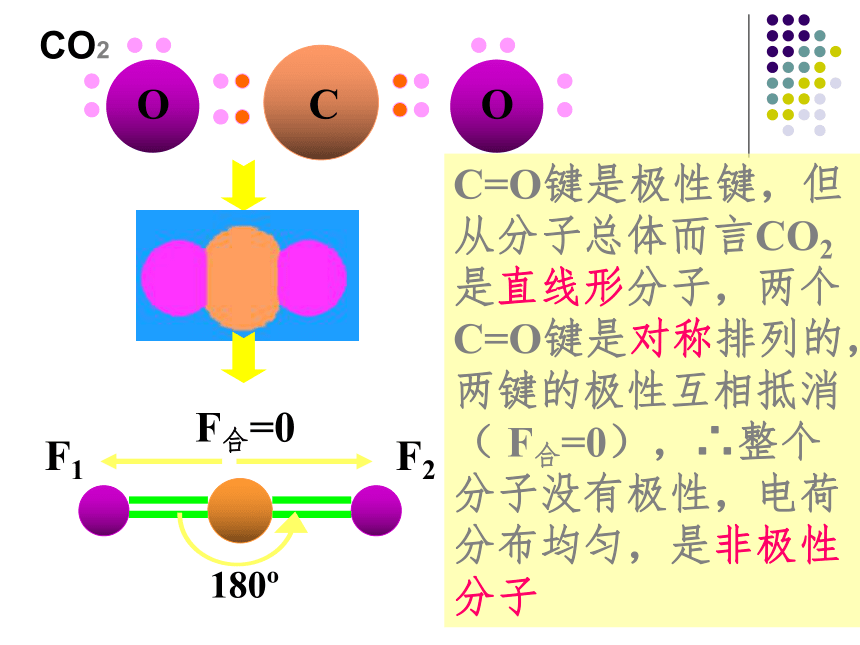
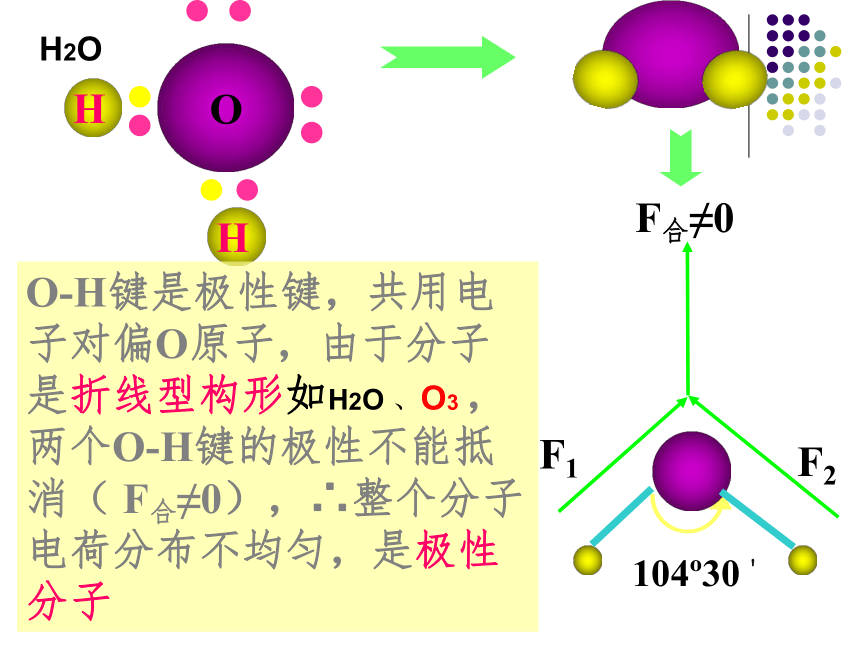
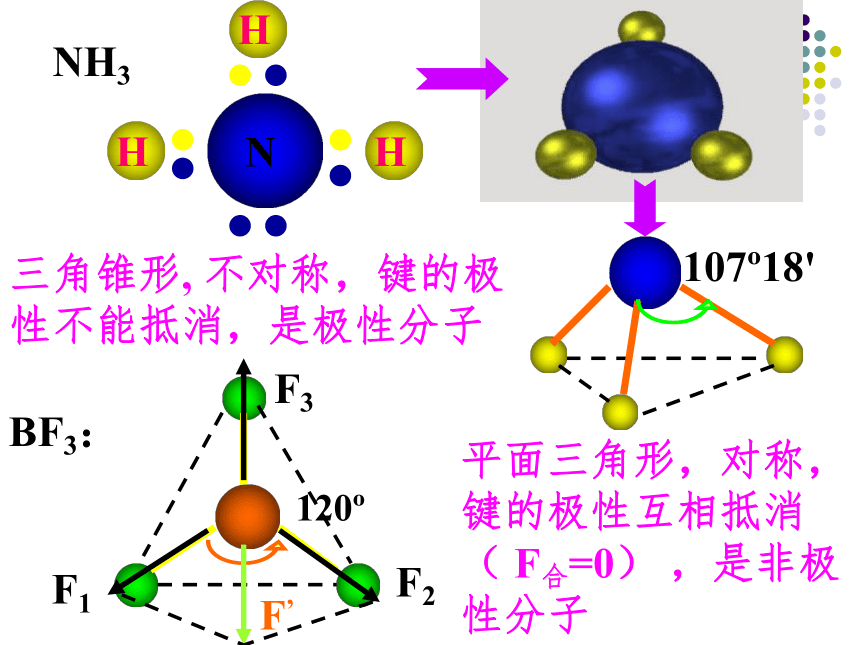
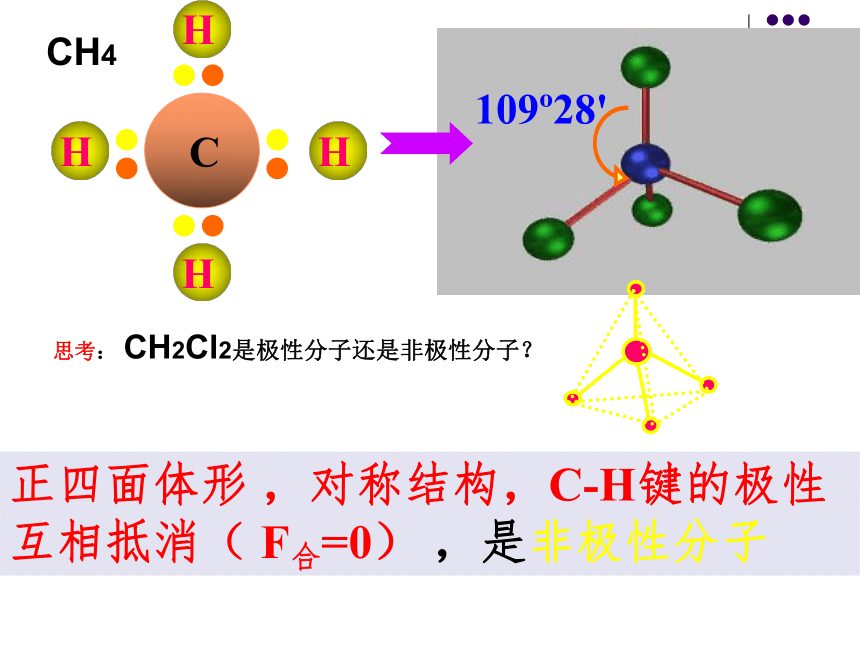
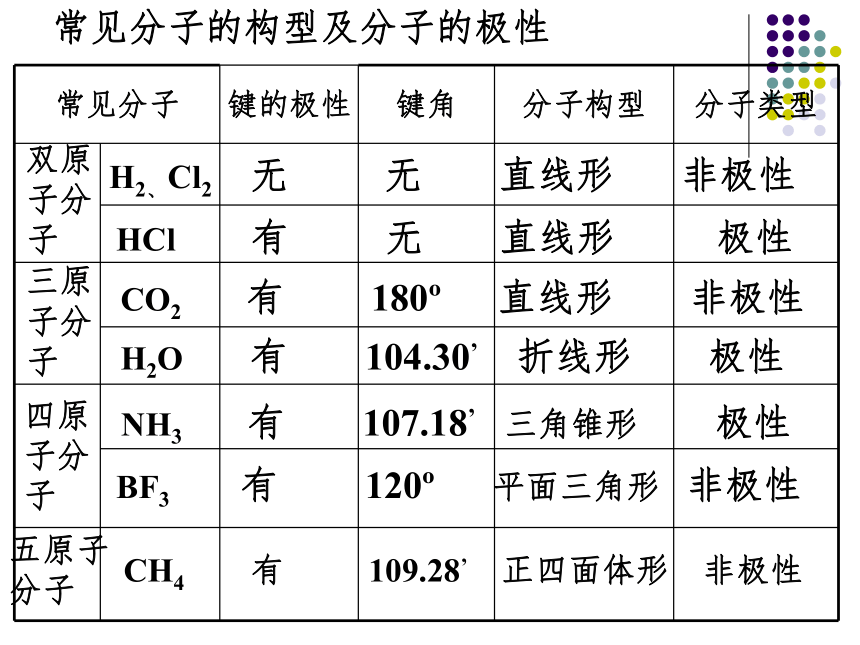
极性键分子的极性类型 正电荷重心和负电荷重心不相重合的分子是极性分子 正电荷重心和负电荷重心相重合的分子是非极性分子1、极性分子: 非极性分子:C=O键是极性键,但从分子总体而言CO2是直线形分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子180oF1F2F合=0CO2104o30'F1F2F合≠0O-H键是极性键,共用电子对偏O原子,由于分子是折线型构形如H2O 、O3 ,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子H2OBF3:NH3120o107o18' 三角锥形, 不对称,键的极性不能抵消,是极性分子F1F2F3F’平面三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子109o28' 正四面体形 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子思考: CH2Cl2是极性分子还是非极性分子? CH4常见分子的构型及分子的极性双原子分子H2、Cl2 无 无 直线形 非极性HCl 有 无 直线形 极性H2O 有 104.30’ 折线形 极性CO2 有 180o 直线形 非极性三原子分子四原子分子NH3 有 107.18’ 三角锥形 极性BF3 有 120o 平面三角形 非极性CH4 有 109.28’ 正四面体形 非极性五原子分子①以极性键结合而形成的异核双原子分子都是
极性分子,如HCl③以极性键结合而形成的多原子分子,既有极性分子,又有非极性分子,分子的空间构型均匀对称的是非极性分子,分子的空间构型不对称的多原子分子为极性分子小结:分子极性的判断:②以非极性键结合而形成的同核双原子分子是非极性分子,如Cl2。还有某些同核多原子分子也是非极性分子,如:P4,应该注意,O3(V形)是极性分子。⑵多原子分子:
取决于分子的空间构型,与键的极性无关。
若分子的空间构型是对称的,则是非极性分子,例:CH4、CO2、BF3;
若分子的空间构型是不对称的,则是极性分子,例:NH3、H2O、CCl3F、O32、分子极性判断方法:取决于成键原子之间的共价键是否有极性以极性键结合的双原子分子是极性分子(异核分子)
以非极性键结合的双原子分子是非极性分子(同核分子)⑴双原子分子:分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定。课本65页直线形直线形非极性极性极性极性非极性非极性非极性直线形折线形三角锥形平面三角形正四面体形思考:价键理论与分子极性关系? ①常见的多原子分子,若中心原子的价电子全部参与成键,形成的分子空间构型往往是对称的,该分子是非极性分子,如三原子分子CO2、CS2(直线形)、四原子的BF3(三角形)、五原子的CH4、CCl4(正四面体形)以及C2H2、C2H4、C6H6等都是非极性分子;复习与提示:价键理论与分子极性 ②若中心原子有不参与成键的电子,形成的分子空间构型往往是不对称的,其分子是极性分子。如H2O、H2S、SO2(V形),NH3(三角锥形);③空间结构对称,但化学键不等性的分子也是极性分子。如CH3Cl、C6H5Br等。3、分子的极性对物质的熔点、沸点、溶解性等物理性质有显著的影响。
——相似相溶规则:一般情况下,由极性分子构成的物质易溶于极性溶剂,由非极性分子构成的物质易溶于非极性溶剂。课本66页 水是极性溶剂,四氯化碳是非极性溶剂,试判断构成下列物质的分子是否是分子,并分析这些物质在水和四氯化碳中的溶解性。
碘单质 氨气 甲烷 氟化氢1.膦的化学式为PH3,在常温下,它是一种无色有大蒜臭味的有毒气体,电石气体中通常含有膦。其分子构型是三角锥形。以下是PH3的叙述中,错误的是( )
A.PH3是极性分子 B.PH3分子中有孤电子对
C.PH3是强氧化剂 D.PH3易溶入水2.根据经验和实际推断,下列叙述中错误的( )
A.卤化氢易溶入水,不易溶入四氯化碳
B.碘易溶入汽油,微溶入水
C.甲烷易溶入苯,难溶入水
D.卤代烃易溶入水,也易溶入有机溶剂练习:CD 2、下列分子中,属于非极性分子的有哪些,属于极性分子的有哪些?
SO2、SiF4、H2S、H2O2、PCl3、BF3非极性分子的有:SiF4、BF3极性分子的有:SO2、H2S、H2O2、、PCl3 3、下列分子中,含有极性键的非极性分子是
A、P4 B、BF3 C、ICl D、PCl3B4.指出下列物质中的共价键类型1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH非极性键极性键极性键(H-O-O-H)极性键 非极性键非极性键极性键观察图中两只相对的手能否重叠?图中的两个乳酸能否重叠?口诀:楔前,实平,虚后1、手性异构体与手性分子:
如果一对分子,它们的组成的原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间里不能重叠,这对分子互称手性异构体。有手性异构体的分子称为手性分子。手性分子2、手性碳原子:连接四个不同的原子或基团的碳原子称为手性碳原子。丙氨酸分子手性分子丙氨酸的结构模型 小结:
1.分子极性的判断
2.手性分子和手性碳原子的判断当堂作业:67页的<<练习与实践>>再见
第一单元 分子构型与物质性质第二课时阅读课本65页[实验1] 在培养皿中加入少量四氯化碳,用滴管滴入一滴水(也可滴一滴加了红墨水的水)于培养皿中,将摩擦带电的玻璃棒或塑料棒接近水滴,观察水滴的运动。[实验2] 在盛有2 mL水的试管中加一小粒固体碘,振荡,观察其溶解情况。再向上述试管中加1 mL四氯化碳,振荡。比较碘在水中和四氯化碳中的溶解情况。 我们常说结构决定性质,从上述实验中,你能得到哪些信息?你能试着解释产生不同实验相象的原因吗?由共价键构成的分子有没有极性?分子中共价键极性:1、极性键:
2、非极性键非极性键
极性键分子的极性类型 正电荷重心和负电荷重心不相重合的分子是极性分子 正电荷重心和负电荷重心相重合的分子是非极性分子1、极性分子: 非极性分子:C=O键是极性键,但从分子总体而言CO2是直线形分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子180oF1F2F合=0CO2104o30'F1F2F合≠0O-H键是极性键,共用电子对偏O原子,由于分子是折线型构形如H2O 、O3 ,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子H2OBF3:NH3120o107o18' 三角锥形, 不对称,键的极性不能抵消,是极性分子F1F2F3F’平面三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子109o28' 正四面体形 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子思考: CH2Cl2是极性分子还是非极性分子? CH4常见分子的构型及分子的极性双原子分子H2、Cl2 无 无 直线形 非极性HCl 有 无 直线形 极性H2O 有 104.30’ 折线形 极性CO2 有 180o 直线形 非极性三原子分子四原子分子NH3 有 107.18’ 三角锥形 极性BF3 有 120o 平面三角形 非极性CH4 有 109.28’ 正四面体形 非极性五原子分子①以极性键结合而形成的异核双原子分子都是
极性分子,如HCl③以极性键结合而形成的多原子分子,既有极性分子,又有非极性分子,分子的空间构型均匀对称的是非极性分子,分子的空间构型不对称的多原子分子为极性分子小结:分子极性的判断:②以非极性键结合而形成的同核双原子分子是非极性分子,如Cl2。还有某些同核多原子分子也是非极性分子,如:P4,应该注意,O3(V形)是极性分子。⑵多原子分子:
取决于分子的空间构型,与键的极性无关。
若分子的空间构型是对称的,则是非极性分子,例:CH4、CO2、BF3;
若分子的空间构型是不对称的,则是极性分子,例:NH3、H2O、CCl3F、O32、分子极性判断方法:取决于成键原子之间的共价键是否有极性以极性键结合的双原子分子是极性分子(异核分子)
以非极性键结合的双原子分子是非极性分子(同核分子)⑴双原子分子:分子极性的判断:分子的极性由共价键的极性及分子的空间构型两个方面共同决定。课本65页直线形直线形非极性极性极性极性非极性非极性非极性直线形折线形三角锥形平面三角形正四面体形思考:价键理论与分子极性关系? ①常见的多原子分子,若中心原子的价电子全部参与成键,形成的分子空间构型往往是对称的,该分子是非极性分子,如三原子分子CO2、CS2(直线形)、四原子的BF3(三角形)、五原子的CH4、CCl4(正四面体形)以及C2H2、C2H4、C6H6等都是非极性分子;复习与提示:价键理论与分子极性 ②若中心原子有不参与成键的电子,形成的分子空间构型往往是不对称的,其分子是极性分子。如H2O、H2S、SO2(V形),NH3(三角锥形);③空间结构对称,但化学键不等性的分子也是极性分子。如CH3Cl、C6H5Br等。3、分子的极性对物质的熔点、沸点、溶解性等物理性质有显著的影响。
——相似相溶规则:一般情况下,由极性分子构成的物质易溶于极性溶剂,由非极性分子构成的物质易溶于非极性溶剂。课本66页 水是极性溶剂,四氯化碳是非极性溶剂,试判断构成下列物质的分子是否是分子,并分析这些物质在水和四氯化碳中的溶解性。
碘单质 氨气 甲烷 氟化氢1.膦的化学式为PH3,在常温下,它是一种无色有大蒜臭味的有毒气体,电石气体中通常含有膦。其分子构型是三角锥形。以下是PH3的叙述中,错误的是( )
A.PH3是极性分子 B.PH3分子中有孤电子对
C.PH3是强氧化剂 D.PH3易溶入水2.根据经验和实际推断,下列叙述中错误的( )
A.卤化氢易溶入水,不易溶入四氯化碳
B.碘易溶入汽油,微溶入水
C.甲烷易溶入苯,难溶入水
D.卤代烃易溶入水,也易溶入有机溶剂练习:CD 2、下列分子中,属于非极性分子的有哪些,属于极性分子的有哪些?
SO2、SiF4、H2S、H2O2、PCl3、BF3非极性分子的有:SiF4、BF3极性分子的有:SO2、H2S、H2O2、、PCl3 3、下列分子中,含有极性键的非极性分子是
A、P4 B、BF3 C、ICl D、PCl3B4.指出下列物质中的共价键类型1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、Na2O2
6 、NaOH非极性键极性键极性键(H-O-O-H)极性键 非极性键非极性键极性键观察图中两只相对的手能否重叠?图中的两个乳酸能否重叠?口诀:楔前,实平,虚后1、手性异构体与手性分子:
如果一对分子,它们的组成的原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间里不能重叠,这对分子互称手性异构体。有手性异构体的分子称为手性分子。手性分子2、手性碳原子:连接四个不同的原子或基团的碳原子称为手性碳原子。丙氨酸分子手性分子丙氨酸的结构模型 小结:
1.分子极性的判断
2.手性分子和手性碳原子的判断当堂作业:67页的<<练习与实践>>再见
