《离子键的形成》教学课件
图片预览




文档简介
课件12张PPT。第二单元 离子键 离子晶体1、构成物质的微粒种类有哪些?各举一例。它们分别靠什么作用结合在一起而构成宏观物质?回想:2、什么叫化学键?它分成哪几类?你通常依据什么来判断化学键的类型? 离
子
键
的
形
成根据元素的金属性和非金属性差异,你知道那些原子之间能形成离子键?
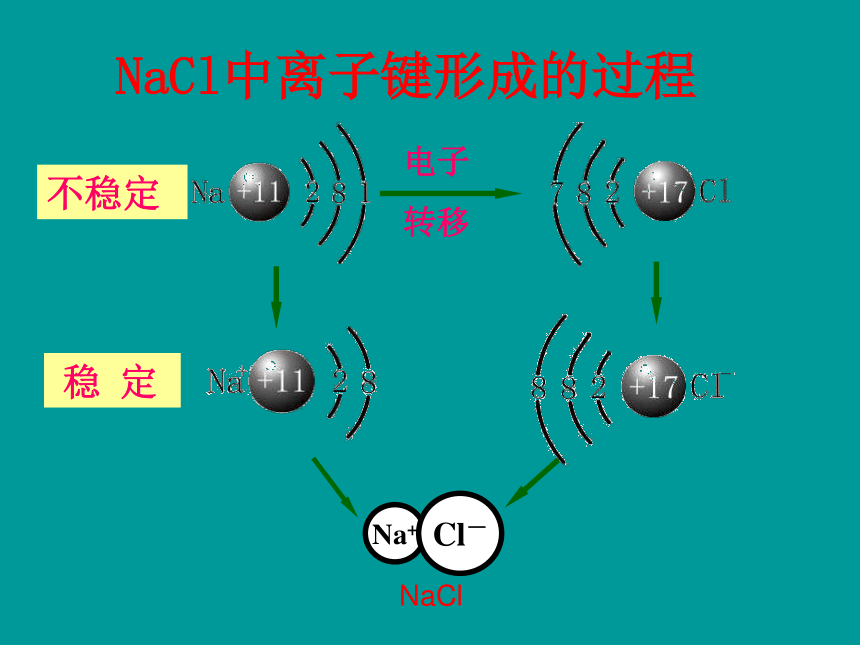
钠原子与氯原子是如何结合形成氯化钠的?你能用电子式表示氯化钠的形成过程吗?NaCl中离子键形成的过程电子
转移不稳定 NaCl1.形成离子键的主要原因 活泼的金属元素和活泼的非金属元素的原子容易发生电子得失,形成相对稳定结构的阴、阳离子,从而产生离子键。2.定义:
使阴、阳离子结合成化合物的静电作用离子键离子键(1)成键粒子:阴、阳离子(3)成键元素(一般情况):(2)成键本质:静电作用(吸引与排斥)活泼金属元素(IA、IIA等)与活泼非金属元素(VIA、VIIA等)形成化合物的元素的电负性的差>1.73、离子化合物 离子化合物包括:(1)活泼的金属元素如(IA、IIA)和活泼的非
金属元素如(VIA、VIIA)形成的化合物。
(2)活泼的金属元素和酸根离子(或氢氧根离
子)形成的盐(或碱)
(3)铵根和酸根离子(或活泼非金属元素离子)
形成的盐。 定义:
含有离子键的化合物原子:离子:离子化合物: 4、用电子式表示离子化合物的形成电子式:在元素符号周围用小点(或×)来表示原
子外层电子,这种式子叫电子式。 1.书写下列物质的电子式MgCl2 NaOH NH4Cl2. 用电子式表示下列物质的形成过程。NaCl MgCl2 注意区分: 用电子式表示物质
用电子式表示物质形成过程小结:书写注意事项。教科书 P35 通常情况下,阴、阳离子可以看成是球形对称的,其电荷分布也是球形对称的,只要空间条件允许,则一个离子可以同时吸引多个带相反电荷的离子。因此离子键没有方向性和饱和性。1. 如果把阴、阳离子看成是球形对称的,阴阳离子的电荷
分布是均匀的,则它们在空间的各个方向上的静电作用是否相同?
2. 如果是相同的,在静电作用能达到的范围内,只要空间
范围许可,一个离子是否应当同时尽可能多得吸引带相
反电荷的离子呢?结论: 离子键的特征谢谢大家!再见!
子
键
的
形
成根据元素的金属性和非金属性差异,你知道那些原子之间能形成离子键?
钠原子与氯原子是如何结合形成氯化钠的?你能用电子式表示氯化钠的形成过程吗?NaCl中离子键形成的过程电子
转移不稳定 NaCl1.形成离子键的主要原因 活泼的金属元素和活泼的非金属元素的原子容易发生电子得失,形成相对稳定结构的阴、阳离子,从而产生离子键。2.定义:
使阴、阳离子结合成化合物的静电作用离子键离子键(1)成键粒子:阴、阳离子(3)成键元素(一般情况):(2)成键本质:静电作用(吸引与排斥)活泼金属元素(IA、IIA等)与活泼非金属元素(VIA、VIIA等)形成化合物的元素的电负性的差>1.73、离子化合物 离子化合物包括:(1)活泼的金属元素如(IA、IIA)和活泼的非
金属元素如(VIA、VIIA)形成的化合物。
(2)活泼的金属元素和酸根离子(或氢氧根离
子)形成的盐(或碱)
(3)铵根和酸根离子(或活泼非金属元素离子)
形成的盐。 定义:
含有离子键的化合物原子:离子:离子化合物: 4、用电子式表示离子化合物的形成电子式:在元素符号周围用小点(或×)来表示原
子外层电子,这种式子叫电子式。 1.书写下列物质的电子式MgCl2 NaOH NH4Cl2. 用电子式表示下列物质的形成过程。NaCl MgCl2 注意区分: 用电子式表示物质
用电子式表示物质形成过程小结:书写注意事项。教科书 P35 通常情况下,阴、阳离子可以看成是球形对称的,其电荷分布也是球形对称的,只要空间条件允许,则一个离子可以同时吸引多个带相反电荷的离子。因此离子键没有方向性和饱和性。1. 如果把阴、阳离子看成是球形对称的,阴阳离子的电荷
分布是均匀的,则它们在空间的各个方向上的静电作用是否相同?
2. 如果是相同的,在静电作用能达到的范围内,只要空间
范围许可,一个离子是否应当同时尽可能多得吸引带相
反电荷的离子呢?结论: 离子键的特征谢谢大家!再见!
