第五单元课题一质量守恒定律课件
文档属性
| 名称 | 第五单元课题一质量守恒定律课件 |
|
|
| 格式 | rar | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-10-26 00:00:00 | ||
图片预览







文档简介
课件27张PPT。第五单元 化学方程式
课题1 质量守恒定律居巢区黄麓中心学校 谢玉荣1.提出问题
化学反应前后各物质的质量和是否会发生变化呢?科学探究(1)参加反应的各物质的质量之和大于生成的各物质的质量之和。
(2)参加反应的各物质的质量之和等于生成的各物质的质量之和。
(3)参加反应的各物质的质量之和小于生成的各物质的质量之和。 让我们用实验和智慧来求证吧!2.猜想与假设3.实验探究 收集证据点燃收集证据实验方案方案一方案一 白磷燃烧前后的质量测定在密闭容器中点燃白磷注意1.白磷燃烧要消耗空气中的氧气,所以一定要在密闭容器中实验
2.白磷的着火点低,易自燃,应保存在水中。
3.白磷有毒性
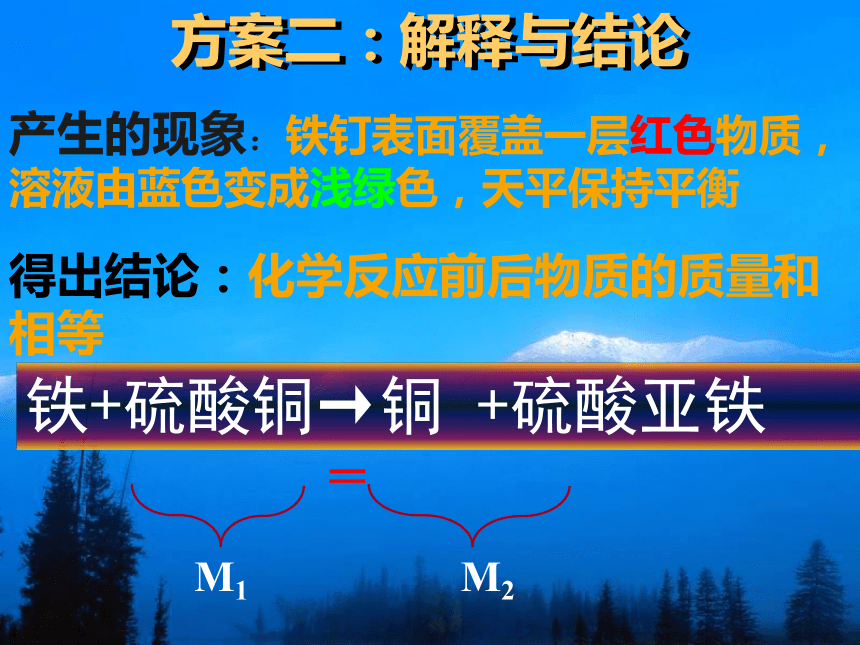
方案二:铁与硫酸铜溶液反应前后质量的测定资料:1、铁钉表面有一层氧化薄膜
2、硫酸铜溶液在空气一般不会变质;但是它有毒性,使用的时候不要用手接触到该溶液
M1 = M2产生的现象为:得出结论:
磷 + 氧气 → 五氧化二磷化学反应前后各物质的质量和相等产生大量白烟,放热,气球先膨胀后收缩,天平保持平衡
方案一:解释与结论点燃方案二:解释与结论方案二:解释与结论产生的现象:铁钉表面覆盖一层红色物质,溶液由蓝色变成浅绿色,天平保持平衡铁+硫酸铜→铜 +硫酸亚铁得出结论:化学反应前后物质的质量和相等讨论:为什么参加化学反应的各物质的质
量总和,等于反应后生成的各物
质的质量总和?
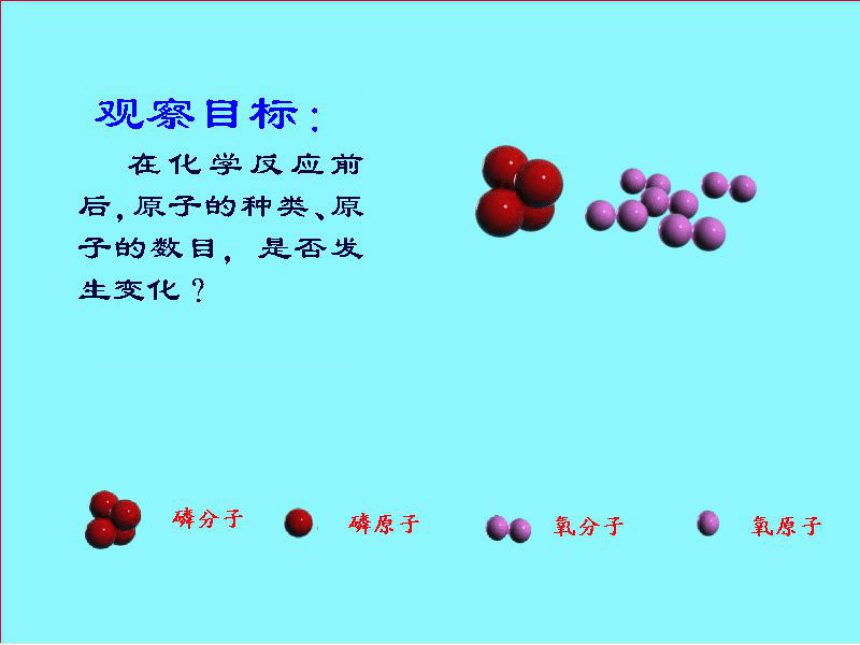
动动脑?磷分子、氧分子模型分子的破裂、原子的重新组合
P4O10分子(2P2O5)
化学反应前后质量守恒的原因原子种类没有改变
原子数目没有增减原子质量没有变化一、质量守恒定律参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
参加反应的
各物质的质
量总 和
生成的各物质的质量总和
4.实验探究 收集证据点燃收集证据实验方案实验5-1: 实验5-2:在实验中,稀盐酸和碳酸钠反应前后物质的总质量为什么不相等呢?盐酸 + 碳酸钠 → 氯化钠 + 水 +二氧化碳实验5-1:
原因: 1、坩埚钳上残留一部分氧化镁。
2、实验过程中随白烟跑走一部分氧化镁。实验5-2:>在开放容器中:实验5-1小结:实验5-2小结:==点燃参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。质量守恒定律概念要点:
2、参加化学反应的各物质的质量总和并不是各物质的任意质量之和,不参加反应的物质的质量不能计算在内。
1、“总和”意味着把各种状态的反应物和生成物都算在内。如沉淀、肉眼看不见的气体也应考虑。3、质量守恒定律的“守恒”,是指质量守恒,而不是体积、反应物的分子个数守恒 。
质量守恒定律的实质:(1)质量守恒的原因(四不变):
宏观:元素的种类不变;
微观:原子的种类不变;
原子的数目不变;
原子的质量不变。 (2)在化学反应中,分子的种类和数目可能发生变化。质量守恒定律的应用: 1 、解释反应前后物质的质量变化及用质量差确定某反应物或生成物的质量。
(1)在A+B=2C 的反应中,足量B与W克A完全反应后,生成12克C,则参加反应的B的质量是____________ 克 (2)在A+B=C+D的反应中,5克A跟一定量的B恰好完全反应,生成3克C和10克D,则B的质量_____克。(12-W)82、推断反应物或生成物的组成元素 酒精在空气中燃烧生成二氧化碳和水,能否根据这一事实,推断出酒精中肯定会有什么元素?可能会有什么元素? 一定有的元素:
可能有的元素:C,HO
有人说他能点石(主要成分CaCO3)成金(Au),他的说法是否有科学道理?
二.化学方程式(用化学式来表示反应的式子)粒子个数比质量比反应物:S、O2。生成物:SO2。条件:点燃表示反应物.生成物及反应条件32 :16×2 :32+16×232 : 32 : 641 : 1 : 1化学方程式的读法:1)本质:硫和氧气在点燃条件下反应生成二氧化硫。和条件生成32 : 32 : 642)质量方面:每32份质量的硫和32份质量的氧气完全反应生成64份质量的二氧化硫。1 : 1 : 13)粒子个数方面:1个硫原子和1个氧分子反应生成1个二氧化硫分子。化学方程式的意义。
课题1 质量守恒定律居巢区黄麓中心学校 谢玉荣1.提出问题
化学反应前后各物质的质量和是否会发生变化呢?科学探究(1)参加反应的各物质的质量之和大于生成的各物质的质量之和。
(2)参加反应的各物质的质量之和等于生成的各物质的质量之和。
(3)参加反应的各物质的质量之和小于生成的各物质的质量之和。 让我们用实验和智慧来求证吧!2.猜想与假设3.实验探究 收集证据点燃收集证据实验方案方案一方案一 白磷燃烧前后的质量测定在密闭容器中点燃白磷注意1.白磷燃烧要消耗空气中的氧气,所以一定要在密闭容器中实验
2.白磷的着火点低,易自燃,应保存在水中。
3.白磷有毒性
方案二:铁与硫酸铜溶液反应前后质量的测定资料:1、铁钉表面有一层氧化薄膜
2、硫酸铜溶液在空气一般不会变质;但是它有毒性,使用的时候不要用手接触到该溶液
M1 = M2产生的现象为:得出结论:
磷 + 氧气 → 五氧化二磷化学反应前后各物质的质量和相等产生大量白烟,放热,气球先膨胀后收缩,天平保持平衡
方案一:解释与结论点燃方案二:解释与结论方案二:解释与结论产生的现象:铁钉表面覆盖一层红色物质,溶液由蓝色变成浅绿色,天平保持平衡铁+硫酸铜→铜 +硫酸亚铁得出结论:化学反应前后物质的质量和相等讨论:为什么参加化学反应的各物质的质
量总和,等于反应后生成的各物
质的质量总和?
动动脑?磷分子、氧分子模型分子的破裂、原子的重新组合
P4O10分子(2P2O5)
化学反应前后质量守恒的原因原子种类没有改变
原子数目没有增减原子质量没有变化一、质量守恒定律参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
参加反应的
各物质的质
量总 和
生成的各物质的质量总和
4.实验探究 收集证据点燃收集证据实验方案实验5-1: 实验5-2:在实验中,稀盐酸和碳酸钠反应前后物质的总质量为什么不相等呢?盐酸 + 碳酸钠 → 氯化钠 + 水 +二氧化碳实验5-1:
原因: 1、坩埚钳上残留一部分氧化镁。
2、实验过程中随白烟跑走一部分氧化镁。实验5-2:>在开放容器中:实验5-1小结:实验5-2小结:==点燃参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。质量守恒定律概念要点:
2、参加化学反应的各物质的质量总和并不是各物质的任意质量之和,不参加反应的物质的质量不能计算在内。
1、“总和”意味着把各种状态的反应物和生成物都算在内。如沉淀、肉眼看不见的气体也应考虑。3、质量守恒定律的“守恒”,是指质量守恒,而不是体积、反应物的分子个数守恒 。
质量守恒定律的实质:(1)质量守恒的原因(四不变):
宏观:元素的种类不变;
微观:原子的种类不变;
原子的数目不变;
原子的质量不变。 (2)在化学反应中,分子的种类和数目可能发生变化。质量守恒定律的应用: 1 、解释反应前后物质的质量变化及用质量差确定某反应物或生成物的质量。
(1)在A+B=2C 的反应中,足量B与W克A完全反应后,生成12克C,则参加反应的B的质量是____________ 克 (2)在A+B=C+D的反应中,5克A跟一定量的B恰好完全反应,生成3克C和10克D,则B的质量_____克。(12-W)82、推断反应物或生成物的组成元素 酒精在空气中燃烧生成二氧化碳和水,能否根据这一事实,推断出酒精中肯定会有什么元素?可能会有什么元素? 一定有的元素:
可能有的元素:C,HO
有人说他能点石(主要成分CaCO3)成金(Au),他的说法是否有科学道理?
二.化学方程式(用化学式来表示反应的式子)粒子个数比质量比反应物:S、O2。生成物:SO2。条件:点燃表示反应物.生成物及反应条件32 :16×2 :32+16×232 : 32 : 641 : 1 : 1化学方程式的读法:1)本质:硫和氧气在点燃条件下反应生成二氧化硫。和条件生成32 : 32 : 642)质量方面:每32份质量的硫和32份质量的氧气完全反应生成64份质量的二氧化硫。1 : 1 : 13)粒子个数方面:1个硫原子和1个氧分子反应生成1个二氧化硫分子。化学方程式的意义。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
