化学:第十一单元第二节铁的性质课件(北京课改版九年级)
文档属性
| 名称 | 化学:第十一单元第二节铁的性质课件(北京课改版九年级) |
|
|
| 格式 | rar | ||
| 文件大小 | 198.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-11-01 00:00:00 | ||
图片预览






文档简介
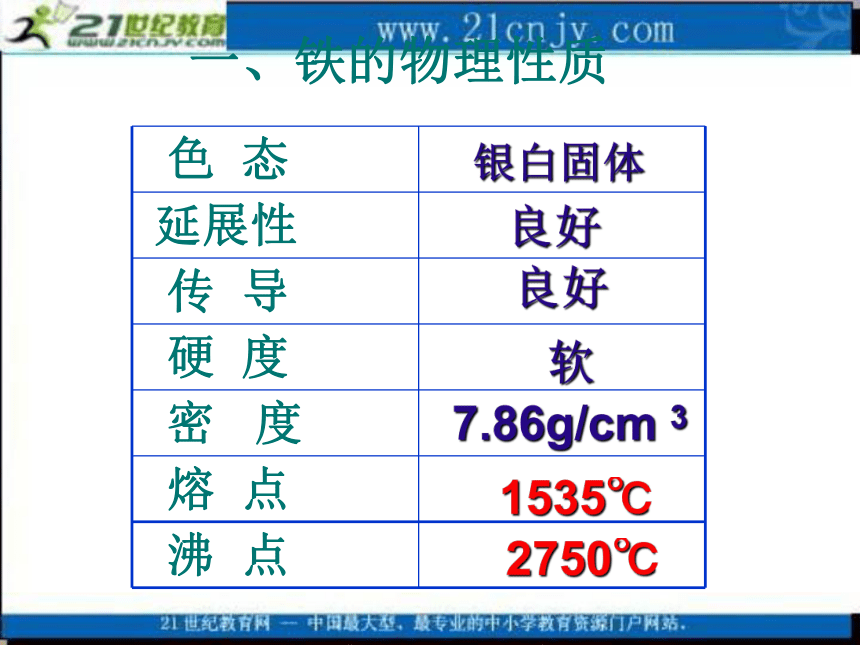
课件15张PPT。第二节 铁的性质一、铁的物理性质 银白固体良好良好软7.86g/cm 31535℃2750℃二、化学性质1、铁和氧气的反应 (火星四射)结论:
①常温下,在干燥的环境中,铁很难
跟氧气反应。
②在隔绝空气的情况下、铁不与水反应。
③在含水分的空气中,铁与水和氧气发
生反应,生成铁锈、铁锈的主要成分是
Fe2O3。
观察:[实验6-3]:铁生锈实验防止铁生锈的方法 :①保持铁制品表面干燥。
②涂上一层保护膜,如:刷油漆、涂油。
③在铁制品表面镀其他金属。
④通过化学反应使铁制品表面生成致密
的氧化膜。如:锯条上的烤蓝。
⑤形成合金:不锈钢。2、铁跟酸的反应[演示实验6-3]:Fe +2HCl = FeCl2 + H2 ↑Fe + H2SO4 = FeSO4 + H2↑现象:产生气体,溶液变成浅绿色。
(FeCl2和FeSO4溶液的颜色)
Fe + CuSO4 = FeSO4 + Cu 3、铁跟硫酸铜溶液的反应[演示实验6-3]:(置换反应)现象:铁表面有红色物质,
成浅绿色课堂练习:1.根据以下铁的实际用途,说明铁具有
的性质。
⑴家用铁制的锅铲上部,常加一木柄或塑料
柄。这说明铁具有 性。
⑵盛放石油产品(如汽油、柴油等)的油罐
车震荡可以产生静电,容易引起火灾,所以
在油罐车尾部有一条拖地的铁链。这是利用
铁的 性。传热性导电性⑶在面盆、痰盂等铁制品的表面烧一
层搪瓷的目的除了美观外,主要是
。
⑷用酸可以除去便池中的污垢,但不能经
常用酸洗便池,是因为 。
⑸工人师傅在切割钢板时,常用硫酸铜
溶液划线。其原因可用化学方程式表
示 。防锈酸能腐蚀铁制管道Fe + CuSO4 = FeSO4 + Cu 2、将三片质量相同的铁片分别放入盛
有相等质量的下列溶液中,①CuSO4溶
液②FeSO4溶液③稀H2SO4的烧杯中,
片刻取出洗涤、烘干后称量,三块金属
片的质量按由大到小的排列顺序的是
(用溶液的序号表示) 。
溶液的质量按由大到小的排列顺序的是
(用溶液的序号表示) 。
①②③③②①D4、国际互联网上报道:“目前世
界上有近20亿人患有‘缺铁性贫血’” ,
这里的铁是指( )
A、铁的氧化物
B、+3价的铁离子
C、+2价的亚铁离子
D、铁单质C
①常温下,在干燥的环境中,铁很难
跟氧气反应。
②在隔绝空气的情况下、铁不与水反应。
③在含水分的空气中,铁与水和氧气发
生反应,生成铁锈、铁锈的主要成分是
Fe2O3。
观察:[实验6-3]:铁生锈实验防止铁生锈的方法 :①保持铁制品表面干燥。
②涂上一层保护膜,如:刷油漆、涂油。
③在铁制品表面镀其他金属。
④通过化学反应使铁制品表面生成致密
的氧化膜。如:锯条上的烤蓝。
⑤形成合金:不锈钢。2、铁跟酸的反应[演示实验6-3]:Fe +2HCl = FeCl2 + H2 ↑Fe + H2SO4 = FeSO4 + H2↑现象:产生气体,溶液变成浅绿色。
(FeCl2和FeSO4溶液的颜色)
Fe + CuSO4 = FeSO4 + Cu 3、铁跟硫酸铜溶液的反应[演示实验6-3]:(置换反应)现象:铁表面有红色物质,
成浅绿色课堂练习:1.根据以下铁的实际用途,说明铁具有
的性质。
⑴家用铁制的锅铲上部,常加一木柄或塑料
柄。这说明铁具有 性。
⑵盛放石油产品(如汽油、柴油等)的油罐
车震荡可以产生静电,容易引起火灾,所以
在油罐车尾部有一条拖地的铁链。这是利用
铁的 性。传热性导电性⑶在面盆、痰盂等铁制品的表面烧一
层搪瓷的目的除了美观外,主要是
。
⑷用酸可以除去便池中的污垢,但不能经
常用酸洗便池,是因为 。
⑸工人师傅在切割钢板时,常用硫酸铜
溶液划线。其原因可用化学方程式表
示 。防锈酸能腐蚀铁制管道Fe + CuSO4 = FeSO4 + Cu 2、将三片质量相同的铁片分别放入盛
有相等质量的下列溶液中,①CuSO4溶
液②FeSO4溶液③稀H2SO4的烧杯中,
片刻取出洗涤、烘干后称量,三块金属
片的质量按由大到小的排列顺序的是
(用溶液的序号表示) 。
溶液的质量按由大到小的排列顺序的是
(用溶液的序号表示) 。
①②③③②①D4、国际互联网上报道:“目前世
界上有近20亿人患有‘缺铁性贫血’” ,
这里的铁是指( )
A、铁的氧化物
B、+3价的铁离子
C、+2价的亚铁离子
D、铁单质C
同课章节目录
