氧化还原反应
图片预览







文档简介
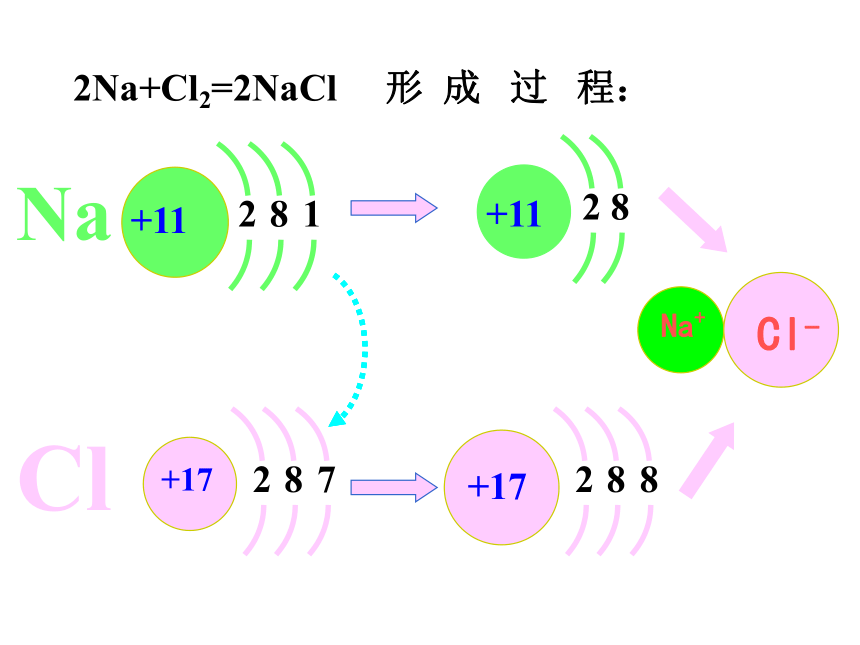
课件25张PPT。2氧化还原反应感受氧化还原反应的存在 刚削好的苹果放置30分钟以后的苹果刚泡好的绿茶放置2小时后的绿茶感受氧化还原反应的存在 感受氧化还原反应的存在 好吃的月饼幕后的英雄感受氧化还原反应的存在 金属生锈2Na+Cl2=2NaCl 形 成 过 程:一、氧化还原反应
概念:
特征: ( 判断依据)
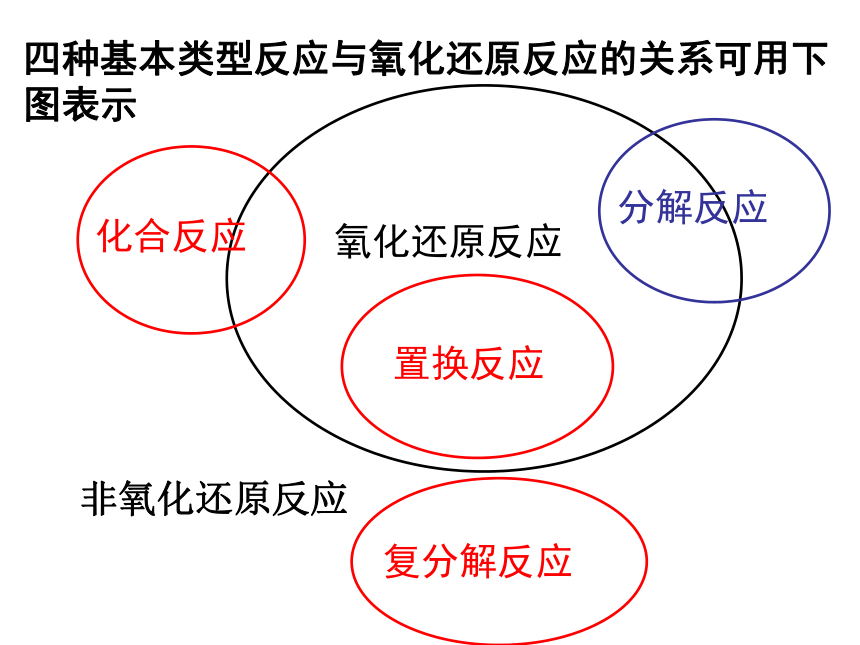
本质:凡有电子转移(得失或偏移)的化学反应电子转移化合价发生了变化用化合价升降的观点去判断下面的反应,哪些是氧化还原反应?凡是有化合价升降的化学反应都是氧化还原反应四种基本类型反应与氧化还原反应的关系可用下图表示非氧化还原反应二、氧化剂和还原剂的相关概念氧化剂:得到电子的物质生成还原产物化合价降低发生还原反应失去电子的物质还原剂:0 0 +1 -1
还原剂 氧化剂氧化产物 还原产物氧化还原反应分析 还原剂→失电子→化合价升高→氧化反应→氧化产物
氧化剂→得电子→化合价降低→ 还原反应→还原产物
2Na +Cl2 == 2NaCl 失 升(被)氧化 还原剂 得 降(被)还原 氧化剂4)Cl2 + 2NaOH== NaCl + NaClO+H2O指出下列氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物 +4 -1 +2 0 氧化剂 还原剂 还原产物 氧化产物 -1 +1 0 0 还原剂 氧化剂 还原产物 氧化产物 0 0 +3 -1还原剂 氧化剂 既是还原产物又是氧化产物 0 -1 +1 既是还原剂又是氧化剂 还原产物 氧化产物1. 某元素在化学反应中,由化合态变为游离态,则该元素( )
A. 一定被氧化 B. 一定被还原
C. 可能被氧化,也可能被还原
D. 化合价降低为0
2. 需加入适当的氧化剂才能实现的反应是
A. B.
C. D.CA DBC5、溴化碘与水反应的化学方程式为
IBr+H2O=HBr+HIO,下列叙述正确的是
A、上述反应中,IBr既是氧化剂又是还原剂
B、上述反应中,H2O是氧化剂
C、上述反应中,溴被还原,碘被氧化
D、上述反应不是氧化还原反应 D从元素化合价升降、电子得失角度分析:0+10-1得电子,化合价降低,被还原,发生还原反应 化合价升高,失电子,被氧化,发生氧化反应 还原剂 氧化剂得电子总数=失电子总数
=电子转移总数(1)双线桥法+4+2-10得2e-失2e-步骤:①标价态②连双线③注得失三、氧化还原反应电子转移的表示方法MnO2 + 4HCl(浓) = MnCl2 + Cl2 + 2H2O得电子总数=失电子总数
=电子转移总数用双线桥分析氧化还原反应3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O0 +5 +2 +2化合价升高,失3×2e-,被氧化化合价降低,得2×3e-,被还原氧化剂___________ 还原剂___________
氧化产物__________ 还原产物_________
转移的电子数____________HNO3 CuCu(NO3)2NO6e-用双线桥表示下列氧化还原反应失2e-得2e-失2xe-得2xe-失2x3e-得6xe-在反应中,氧化剂是_____,氧化产物是________,氧化产物与还原产物的物质的量之比为_________,若有7.3g HCl被氧化,产生的Cl2质量为________g,电子转移的总数为_____,MnO2Cl21:17.10.4mol失2e-得2e-四、氧化性还原性强弱的比较氧化性: 氧化剂 > 氧化产物
还原性:还原剂 > 还原产物 已知:判断下列物质的氧化能力由强到弱的顺序是( )
A. B. C.。 D. B2、⑴根据金属活动性顺序进行判断K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属性减弱,单质的还原性减弱 五、氧化性还原性与元素价态的关系最高价态:只具有氧化性
如:浓H2SO4 HNO3 FeCl3 KMnO4
最低价态:只具有还原性
如: KI H2S Zn HCl
中间价态:既具有氧化性又有还原性
如: FeCl2 S SO2 Cl2 CO 在几种微粒中,只有氧化性的是________,只有还原性的是__________,既有氧化性又有还原性的是_________。
概念:
特征: ( 判断依据)
本质:凡有电子转移(得失或偏移)的化学反应电子转移化合价发生了变化用化合价升降的观点去判断下面的反应,哪些是氧化还原反应?凡是有化合价升降的化学反应都是氧化还原反应四种基本类型反应与氧化还原反应的关系可用下图表示非氧化还原反应二、氧化剂和还原剂的相关概念氧化剂:得到电子的物质生成还原产物化合价降低发生还原反应失去电子的物质还原剂:0 0 +1 -1
还原剂 氧化剂氧化产物 还原产物氧化还原反应分析 还原剂→失电子→化合价升高→氧化反应→氧化产物
氧化剂→得电子→化合价降低→ 还原反应→还原产物
2Na +Cl2 == 2NaCl 失 升(被)氧化 还原剂 得 降(被)还原 氧化剂4)Cl2 + 2NaOH== NaCl + NaClO+H2O指出下列氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物 +4 -1 +2 0 氧化剂 还原剂 还原产物 氧化产物 -1 +1 0 0 还原剂 氧化剂 还原产物 氧化产物 0 0 +3 -1还原剂 氧化剂 既是还原产物又是氧化产物 0 -1 +1 既是还原剂又是氧化剂 还原产物 氧化产物1. 某元素在化学反应中,由化合态变为游离态,则该元素( )
A. 一定被氧化 B. 一定被还原
C. 可能被氧化,也可能被还原
D. 化合价降低为0
2. 需加入适当的氧化剂才能实现的反应是
A. B.
C. D.CA DBC5、溴化碘与水反应的化学方程式为
IBr+H2O=HBr+HIO,下列叙述正确的是
A、上述反应中,IBr既是氧化剂又是还原剂
B、上述反应中,H2O是氧化剂
C、上述反应中,溴被还原,碘被氧化
D、上述反应不是氧化还原反应 D从元素化合价升降、电子得失角度分析:0+10-1得电子,化合价降低,被还原,发生还原反应 化合价升高,失电子,被氧化,发生氧化反应 还原剂 氧化剂得电子总数=失电子总数
=电子转移总数(1)双线桥法+4+2-10得2e-失2e-步骤:①标价态②连双线③注得失三、氧化还原反应电子转移的表示方法MnO2 + 4HCl(浓) = MnCl2 + Cl2 + 2H2O得电子总数=失电子总数
=电子转移总数用双线桥分析氧化还原反应3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O0 +5 +2 +2化合价升高,失3×2e-,被氧化化合价降低,得2×3e-,被还原氧化剂___________ 还原剂___________
氧化产物__________ 还原产物_________
转移的电子数____________HNO3 CuCu(NO3)2NO6e-用双线桥表示下列氧化还原反应失2e-得2e-失2xe-得2xe-失2x3e-得6xe-在反应中,氧化剂是_____,氧化产物是________,氧化产物与还原产物的物质的量之比为_________,若有7.3g HCl被氧化,产生的Cl2质量为________g,电子转移的总数为_____,MnO2Cl21:17.10.4mol失2e-得2e-四、氧化性还原性强弱的比较氧化性: 氧化剂 > 氧化产物
还原性:还原剂 > 还原产物 已知:判断下列物质的氧化能力由强到弱的顺序是( )
A. B. C.。 D. B2、⑴根据金属活动性顺序进行判断K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属性减弱,单质的还原性减弱 五、氧化性还原性与元素价态的关系最高价态:只具有氧化性
如:浓H2SO4 HNO3 FeCl3 KMnO4
最低价态:只具有还原性
如: KI H2S Zn HCl
中间价态:既具有氧化性又有还原性
如: FeCl2 S SO2 Cl2 CO 在几种微粒中,只有氧化性的是________,只有还原性的是__________,既有氧化性又有还原性的是_________。
