物质分离和提纯
图片预览



文档简介
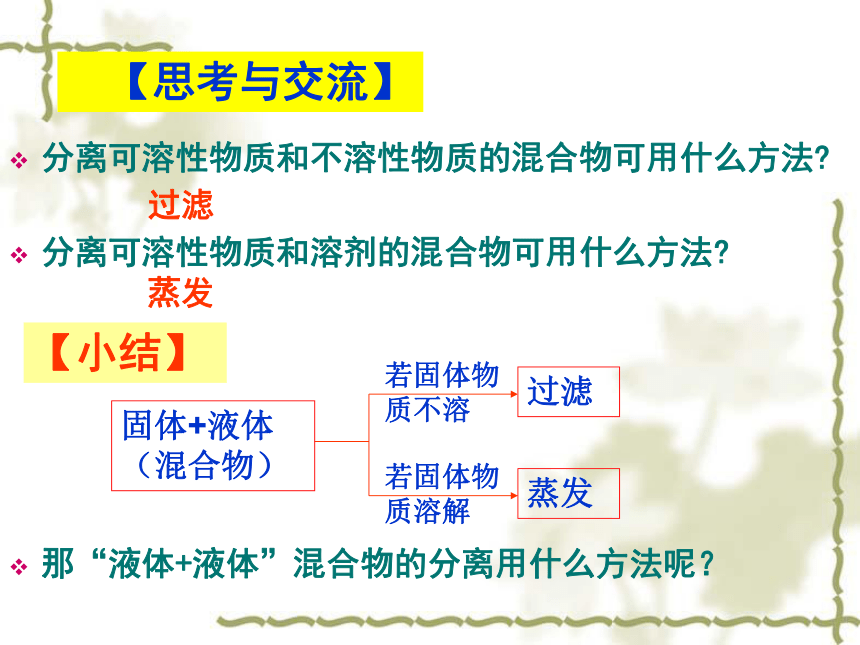
课件10张PPT。第一章 从实验学化学第一节 化学实验基本方法第3课时、混合物的分离与提纯 【思考与交流】分离可溶性物质和不溶性物质的混合物可用什么方法?分离可溶性物质和溶剂的混合物可用什么方法?那“液体+液体”混合物的分离用什么方法呢?过滤蒸发固体+液体
(混合物)若固体物
质不溶过滤若固体物
质溶解蒸发【小结】1、蒸馏讨论:我们饮用的自来水是纯净水吗?实验1-3:实验室通过蒸馏的方法除去自来水中的Cl-
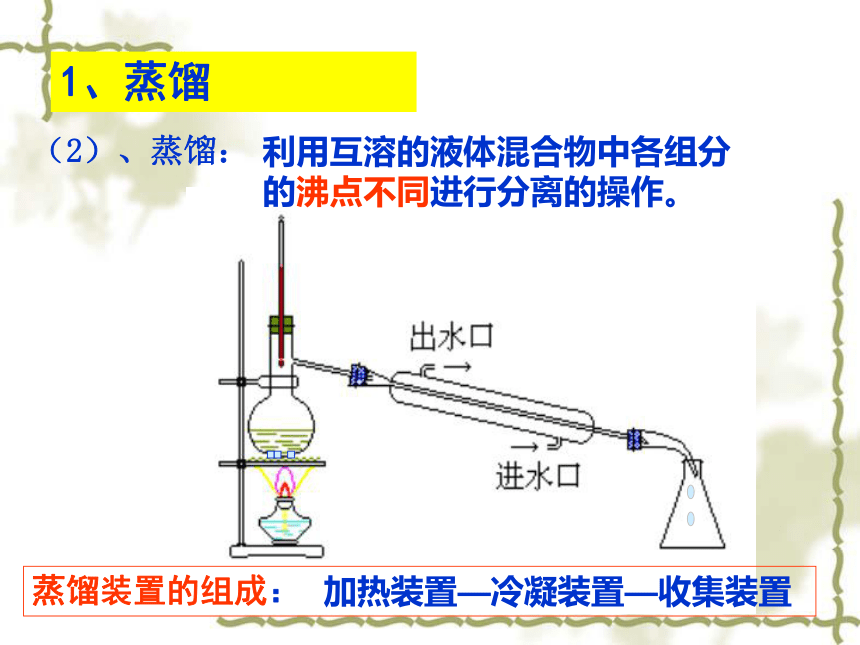
等杂质制取蒸馏水(Cl-的化合物难挥发)(1)、检验Cl-的方法:试剂:稀硝酸和AgNO3溶液现象:产生白色沉淀NaCl+AgNO3=AgCl↓+NaNO3蒸馏装置的组成:1、蒸馏(2)、蒸馏:利用互溶的液体混合物中各组分 的沸点不同进行分离的操作。加热装置—冷凝装置—收集装置1、温度计水银球的位置:在蒸馏烧瓶的支管口处1、蒸馏(2)、蒸馏:利用互溶的液体混合物中各组分 的沸点不同进行分离的操作。注意事项2、蒸馏烧瓶中所盛的液体不超过2/3,也不少于1/33、沸石的作用:防止液体暴沸4、加热的温度:不能超过混合物中沸点最高物质的沸点5、冷凝管中冷水从下口进,上口出6、实验开始时,先打开冷凝水从,后加热;实验结束时,先停止加热,后关冷凝水。蒸馏使用的范围:沸点不同的液态混合物1、蒸馏讨论:通过蒸馏后所收集的水中还含有Cl-离子吗?(3)、检验蒸馏水中是否含有Cl-的方法:试剂:稀硝酸和AgNO3溶液现象:无白色沉淀产生结论:蒸馏水中无Cl-离子讨论:对于互溶的液体,可以采取蒸馏的方法分离,如果互不溶的液体我们用什么方法分离呢?2、萃取和分液(1)定义:分液:
萃取:强调:萃取剂的选择的原则:把两种互不相溶、密度也不同的液体分开的方法用一种溶质在互不相溶的溶剂里的溶解度不同,
用一种溶剂把溶质从它与另一种溶剂所组成的
溶液中提取出来的方法。①萃取剂与原溶剂(水)不互溶
②溶质在萃取剂的溶解度比原溶剂(水)大
③萃取剂与溶液不发生反应2、萃取和分液实验1-4:用CCl4萃取碘的饱和水溶液的步骤及注意事项。检验分液 漏斗是否 漏水在分液漏斗中加溶液和萃取剂振
荡静置分层分液将溶液和萃取剂依次从上口注入分液漏斗,溶液总量不超过其容积2/3.右手压住分液漏斗口部,左手握住活塞部分,,倒转分液漏斗并用力振荡。
把分液漏斗放在铁架台的铁圈中静置、分层。
打开上口玻璃塞和分液漏斗下面的活塞(目的:平衡大气压,使下层液体能顺利流出),使下层液体慢慢流出,上层液体从上口倒出。固体+液体 (混合物)若固体物
质不溶过滤若固体物
质溶解蒸发【小结】液体+液体 (混合物)若相溶蒸馏若互不
相溶萃取固体+固体 (混合物)若有升华
的物质升华若有不稳
定的物质加热
质不溶过滤若固体物
质溶解蒸发【小结】1、蒸馏讨论:我们饮用的自来水是纯净水吗?实验1-3:实验室通过蒸馏的方法除去自来水中的Cl-
等杂质制取蒸馏水(Cl-的化合物难挥发)(1)、检验Cl-的方法:试剂:稀硝酸和AgNO3溶液现象:产生白色沉淀NaCl+AgNO3=AgCl↓+NaNO3蒸馏装置的组成:1、蒸馏(2)、蒸馏:利用互溶的液体混合物中各组分 的沸点不同进行分离的操作。加热装置—冷凝装置—收集装置1、温度计水银球的位置:在蒸馏烧瓶的支管口处1、蒸馏(2)、蒸馏:利用互溶的液体混合物中各组分 的沸点不同进行分离的操作。注意事项2、蒸馏烧瓶中所盛的液体不超过2/3,也不少于1/33、沸石的作用:防止液体暴沸4、加热的温度:不能超过混合物中沸点最高物质的沸点5、冷凝管中冷水从下口进,上口出6、实验开始时,先打开冷凝水从,后加热;实验结束时,先停止加热,后关冷凝水。蒸馏使用的范围:沸点不同的液态混合物1、蒸馏讨论:通过蒸馏后所收集的水中还含有Cl-离子吗?(3)、检验蒸馏水中是否含有Cl-的方法:试剂:稀硝酸和AgNO3溶液现象:无白色沉淀产生结论:蒸馏水中无Cl-离子讨论:对于互溶的液体,可以采取蒸馏的方法分离,如果互不溶的液体我们用什么方法分离呢?2、萃取和分液(1)定义:分液:
萃取:强调:萃取剂的选择的原则:把两种互不相溶、密度也不同的液体分开的方法用一种溶质在互不相溶的溶剂里的溶解度不同,
用一种溶剂把溶质从它与另一种溶剂所组成的
溶液中提取出来的方法。①萃取剂与原溶剂(水)不互溶
②溶质在萃取剂的溶解度比原溶剂(水)大
③萃取剂与溶液不发生反应2、萃取和分液实验1-4:用CCl4萃取碘的饱和水溶液的步骤及注意事项。检验分液 漏斗是否 漏水在分液漏斗中加溶液和萃取剂振
荡静置分层分液将溶液和萃取剂依次从上口注入分液漏斗,溶液总量不超过其容积2/3.右手压住分液漏斗口部,左手握住活塞部分,,倒转分液漏斗并用力振荡。
把分液漏斗放在铁架台的铁圈中静置、分层。
打开上口玻璃塞和分液漏斗下面的活塞(目的:平衡大气压,使下层液体能顺利流出),使下层液体慢慢流出,上层液体从上口倒出。固体+液体 (混合物)若固体物
质不溶过滤若固体物
质溶解蒸发【小结】液体+液体 (混合物)若相溶蒸馏若互不
相溶萃取固体+固体 (混合物)若有升华
的物质升华若有不稳
定的物质加热
