共价键的形成
图片预览






文档简介
课件31张PPT。专题3:第三单元 共价键 原子晶体第一课时 共价键的形成学习目标了解共价键的形成过程和形成条件以加深对共价键的认识。
理解共价键的特性 饱和性和方向性
能比较熟练地用电子式表示共价化合物的形成过程。
通过必修2的学习,你能回答下列问题吗?
什么是共价键?通常哪些元素之间可以形成共价键?
如何表示共价键?你能用电子式表示H2 、 HCl、Cl2 分子的形成过程吗?
含有共价键的物质是否一定是共价分子? 你能举例说明?
知识回顾 思考1、下列物质中,只含共价键的是 A.H2O B.NaOH C.KBr D.NH4Cl
2、下列元素的原子在形成不同物质时,既能形成离子键,又能形成共价键的是( )
A. K B. Ca C. I D. Ne
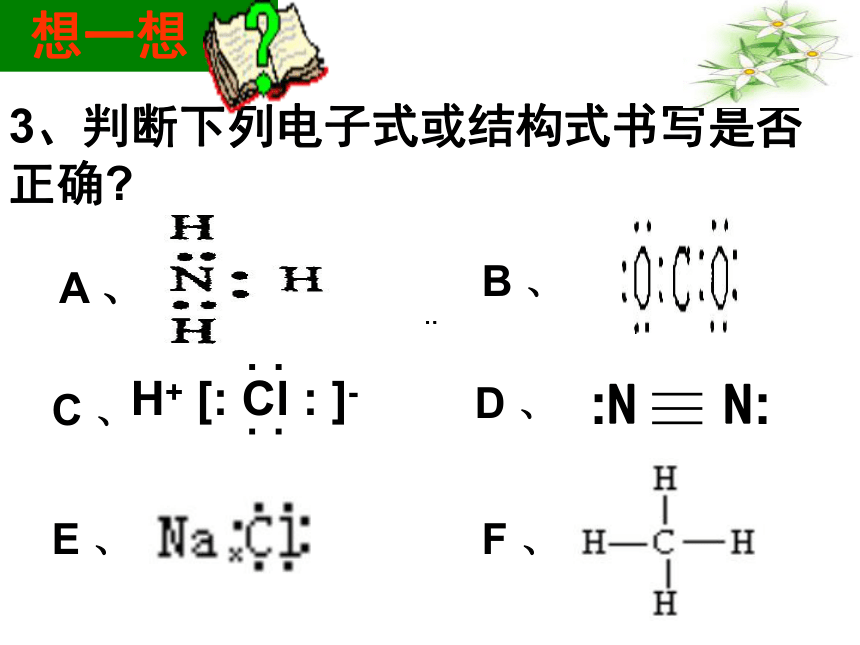
自我检测CA3、判断下列电子式或结构式书写是否正确?
········A 、B 、C 、D 、E 、F 、H+ [: Cl : ]-· ·· · 想一想联想 质疑1.为什么原子间可以通过共用电子对形成稳定的分子?
2.共价键究竟是怎样形成的?其本质及特征又如何呢?
一、共价键的形成请同学们阅读课本P39~40,并思考下列问题。
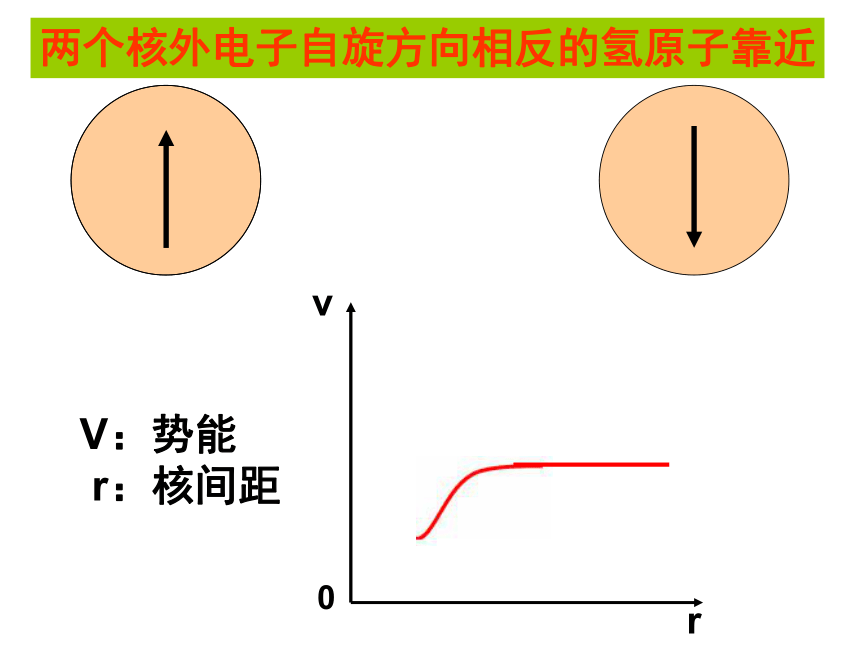
(1)氢原子的价电子构型如何?氢原子在形成氢分子的过程中的能量是怎样变化的?氢分子中的共价键是如何形成的?2个氢原子一定能形成氢分子吗?
(2) 共价键有何特征?如何理解?1、相距很远的两个自旋方向相反的H原子相互逐渐接近,在这一过程中体系能量将 ( )
A、先变大后变小 B、先变小后变大
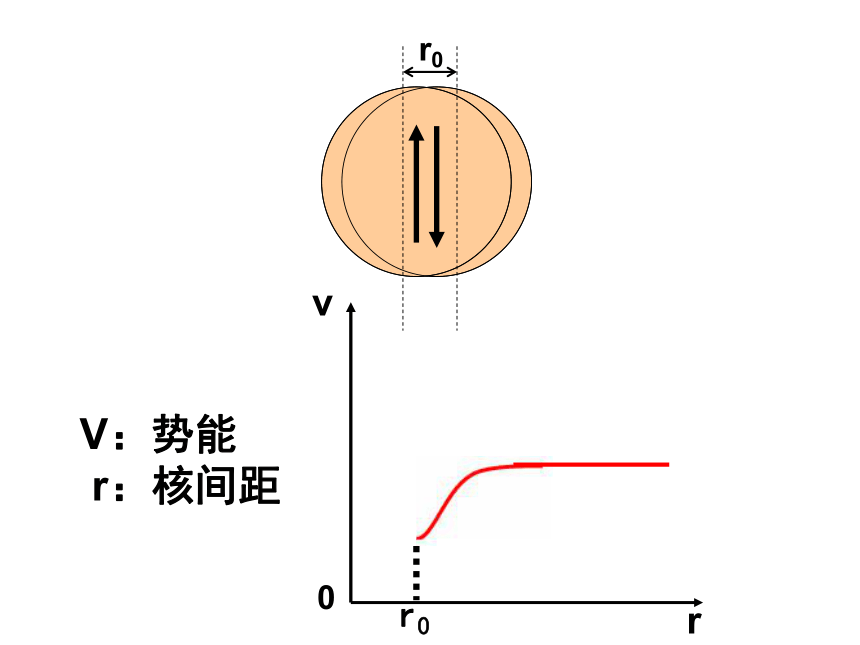
C、逐渐变小 D、逐渐增大B 自我检测vr0V:势能
r:核间距两个核外电子自旋方向相反的氢原子靠近r0vr0r0V:势能
r:核间距r0vr0r0V:势能
r:核间距vr0V:势能
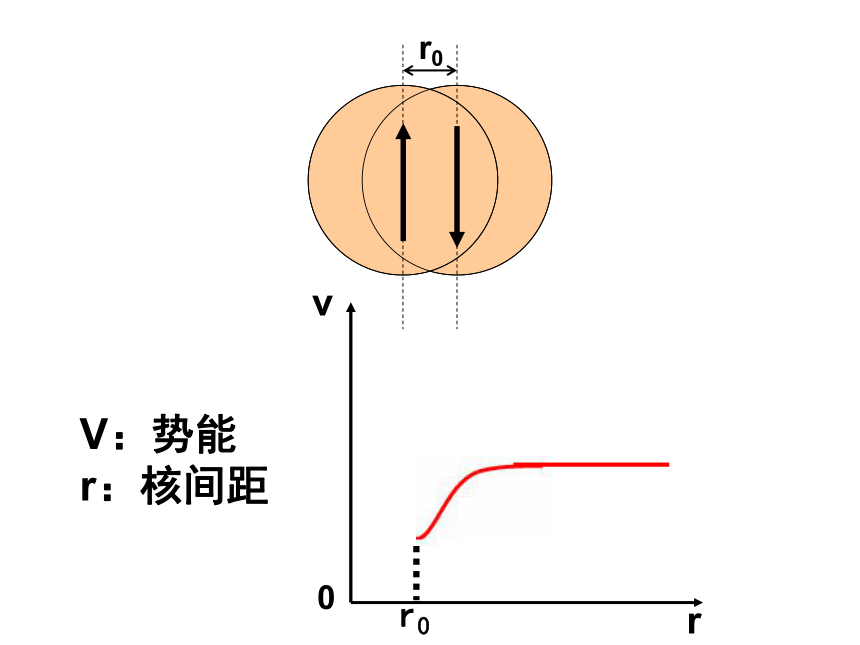
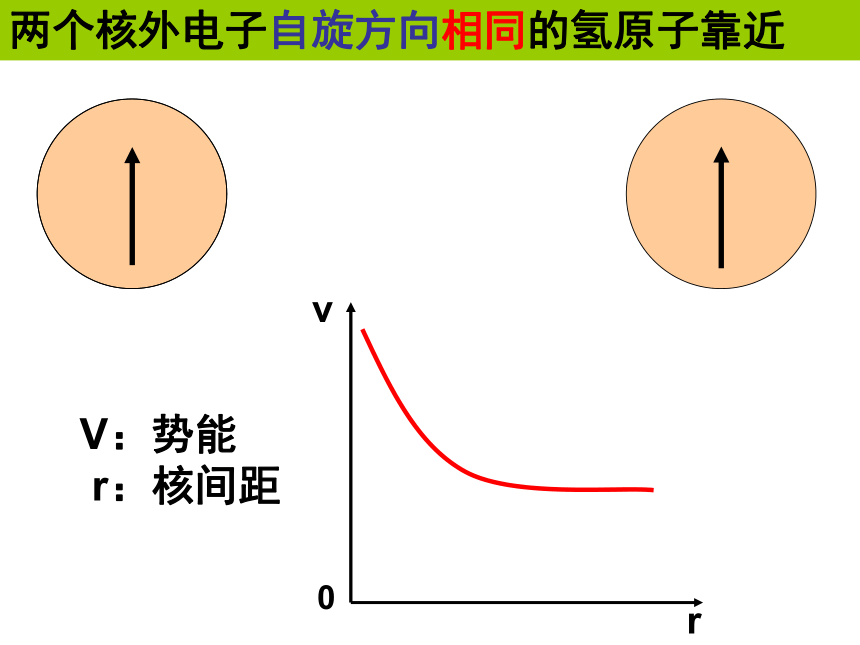
r:核间距两个核外电子自旋方向相同的氢原子靠近1.共价键形成的本质和条件两个氢原子结合成氢分子时电子云的变化共价键形成的本质是:
共价键的形成条件:
①电负性相同或相差很小 ②一般成键原子有未成对电子(自旋相反)。
③成键原子的原子轨道在空间重叠
成键原子相互接近时,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对,两原子核间的电子密度增大,体系的能量降低。
2、下列不属于共价键的成键因素的是 ( )
A、共用电子对在两核间高频率出现
B、共用的电子必须配对
C、成键后体系能量降低,趋于稳定
D、两原子核体积大小要适中D 自我检测完成下列问题并以HCl、H2O为例描述共价键的形成过程0.91.4重叠重叠有有1. 是不是所有的价电子都参与了成键?
氢原子与氯原子结合成氯化氢分子时原子个数比为什么为 1:1,而与氧原子结合成水分子时原子个数比却为2:1?(电负性:H 2.1 O 3.5 Cl 3.0)思考:2.共价键的特点 (1)具有饱和性
形成的共价键数=未成对电子数(2)、具有方向性ppx—px+p-p 重叠 σ键的形成②肩并肩重叠——π键σ键成键方式 “头碰头” 自我小结π键成键方式 “肩并肩”1.A原子的价电子排布式为:2s22p3,则:
① A原子未成对电子数为 ;与
氢原子结合形成的分子式为 ;
电子式为 。
② 形成的单质分子A2中共用电子对数有
其结构式 。3.稀有气体为什么不能形成双原子分子?水分子的组成为什么是H2O而不是H3O? 自我检测2. 根据H+H → H2每生成1mol H2同时放出436kJ热量,判断下列说法正确的是( )
A.氢分子比氢原子稳定
B.氢分子跟氢原子一样稳定
C.氢原子比氢分子能量高
D.氢原子比氢分子稳定巩固练习 AC巩固练习 3. 分析下列化学式中划有横线的元素,选出符合①②③ 要求的物质编号,填写在横线上。
A. NH3 B. H2O C. HCl D. CH4 E. N2
① 所有的价电子都参与形成共价键的是 ;
② 只有一个价电子参与形成共价键的是 ;
③ 最外层有未参与成键电子对的是 ; DCA、B、C、E4. H2S分子中两个共价键的夹角接近90。,其原因是( )
A.共价键的饱和性
B. S原子电子排布
C.共价键的方向性
D. S原子中p轨道的形状 自我提高CD小 结:共价键与离子键的比较两种相同或不同的非金属化合活泼金属与活泼非金属化合 原 子阴、阳离子形成共用电子对静电作用课堂练习CC、DC共价键的形成本质和条件共价键的特点:
饱和性和方向性
小 结作业1.课本P48 1 2 3 4
2.预习第二课时
3.上网查阅共价键理论发展的相关资料谢谢!p—ss-p重叠 σ键的形成
理解共价键的特性 饱和性和方向性
能比较熟练地用电子式表示共价化合物的形成过程。
通过必修2的学习,你能回答下列问题吗?
什么是共价键?通常哪些元素之间可以形成共价键?
如何表示共价键?你能用电子式表示H2 、 HCl、Cl2 分子的形成过程吗?
含有共价键的物质是否一定是共价分子? 你能举例说明?
知识回顾 思考1、下列物质中,只含共价键的是 A.H2O B.NaOH C.KBr D.NH4Cl
2、下列元素的原子在形成不同物质时,既能形成离子键,又能形成共价键的是( )
A. K B. Ca C. I D. Ne
自我检测CA3、判断下列电子式或结构式书写是否正确?
········A 、B 、C 、D 、E 、F 、H+ [: Cl : ]-· ·· · 想一想联想 质疑1.为什么原子间可以通过共用电子对形成稳定的分子?
2.共价键究竟是怎样形成的?其本质及特征又如何呢?
一、共价键的形成请同学们阅读课本P39~40,并思考下列问题。
(1)氢原子的价电子构型如何?氢原子在形成氢分子的过程中的能量是怎样变化的?氢分子中的共价键是如何形成的?2个氢原子一定能形成氢分子吗?
(2) 共价键有何特征?如何理解?1、相距很远的两个自旋方向相反的H原子相互逐渐接近,在这一过程中体系能量将 ( )
A、先变大后变小 B、先变小后变大
C、逐渐变小 D、逐渐增大B 自我检测vr0V:势能
r:核间距两个核外电子自旋方向相反的氢原子靠近r0vr0r0V:势能
r:核间距r0vr0r0V:势能
r:核间距vr0V:势能
r:核间距两个核外电子自旋方向相同的氢原子靠近1.共价键形成的本质和条件两个氢原子结合成氢分子时电子云的变化共价键形成的本质是:
共价键的形成条件:
①电负性相同或相差很小 ②一般成键原子有未成对电子(自旋相反)。
③成键原子的原子轨道在空间重叠
成键原子相互接近时,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对,两原子核间的电子密度增大,体系的能量降低。
2、下列不属于共价键的成键因素的是 ( )
A、共用电子对在两核间高频率出现
B、共用的电子必须配对
C、成键后体系能量降低,趋于稳定
D、两原子核体积大小要适中D 自我检测完成下列问题并以HCl、H2O为例描述共价键的形成过程0.91.4重叠重叠有有1. 是不是所有的价电子都参与了成键?
氢原子与氯原子结合成氯化氢分子时原子个数比为什么为 1:1,而与氧原子结合成水分子时原子个数比却为2:1?(电负性:H 2.1 O 3.5 Cl 3.0)思考:2.共价键的特点 (1)具有饱和性
形成的共价键数=未成对电子数(2)、具有方向性ppx—px+p-p 重叠 σ键的形成②肩并肩重叠——π键σ键成键方式 “头碰头” 自我小结π键成键方式 “肩并肩”1.A原子的价电子排布式为:2s22p3,则:
① A原子未成对电子数为 ;与
氢原子结合形成的分子式为 ;
电子式为 。
② 形成的单质分子A2中共用电子对数有
其结构式 。3.稀有气体为什么不能形成双原子分子?水分子的组成为什么是H2O而不是H3O? 自我检测2. 根据H+H → H2每生成1mol H2同时放出436kJ热量,判断下列说法正确的是( )
A.氢分子比氢原子稳定
B.氢分子跟氢原子一样稳定
C.氢原子比氢分子能量高
D.氢原子比氢分子稳定巩固练习 AC巩固练习 3. 分析下列化学式中划有横线的元素,选出符合①②③ 要求的物质编号,填写在横线上。
A. NH3 B. H2O C. HCl D. CH4 E. N2
① 所有的价电子都参与形成共价键的是 ;
② 只有一个价电子参与形成共价键的是 ;
③ 最外层有未参与成键电子对的是 ; DCA、B、C、E4. H2S分子中两个共价键的夹角接近90。,其原因是( )
A.共价键的饱和性
B. S原子电子排布
C.共价键的方向性
D. S原子中p轨道的形状 自我提高CD小 结:共价键与离子键的比较两种相同或不同的非金属化合活泼金属与活泼非金属化合 原 子阴、阳离子形成共用电子对静电作用课堂练习CC、DC共价键的形成本质和条件共价键的特点:
饱和性和方向性
小 结作业1.课本P48 1 2 3 4
2.预习第二课时
3.上网查阅共价键理论发展的相关资料谢谢!p—ss-p重叠 σ键的形成
