山东名校2009高三化学试题分类汇编(实验探究1)
文档属性
| 名称 | 山东名校2009高三化学试题分类汇编(实验探究1) |

|
|
| 格式 | rar | ||
| 文件大小 | 293.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-11-13 00:00:00 | ||
图片预览


文档简介
山东名校2009高三试题分类汇编(实验探究1)
1. 【09枣庄调考模拟试卷】(7分)如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
序号
内容
实验现象
1
常温下将铁丝放在干燥空气中一个月
干燥的铁丝表面依然光亮
2
常温下将铁丝放在潮湿空气中一小时
铁丝表面依然光亮
3
常温下将铁丝放在潮湿的空气中一个月
铁丝表面已变得灰暗
4
将潮湿的铁丝放在常温的氧气流中一小时
铁丝表面略显灰暗
5
将潮湿的铁丝放在高于常温的氧气流中一小时
铁丝表面已变得灰暗
6
将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时
铁丝表面灰暗程度比实验5严重
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) __________; 在电化学腐 蚀中,负极反应是______________; 正极反应是______________________;
(2)由该实验可知,可以影响铁锈蚀速率的因素是__________________________; (3)为防止铁的锈蚀,工业上普遍采用的方法是______________(答两种方法)
答案.(1)3、5、6 负极反应:2Fe 2Fe2+ +4e-
正极反应:O2+2H2O +4e- 4OH-
(2)O2的浓度和电解质的强弱 (3)涂防锈漆、电镀等
2. 【潍坊市2009届3月份高考模拟化学】(12分)某固体混合物可能由Al 、(NH4)2SO4、MgCl2 、FeCl2 、AlCl3 中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换
算成标准状况下的体积):
回答下列问题:
(1)写出反应④的离子方程式___________________________________________.
(2)填写下表中的空白。(注:若混合物中不存在该成分,则“质量”栏中填“0”;
画斜线的表格不需填写)
成分
质量
判断依据或计算推理过程
Al
(NH4)2SO4
MgCl2
FeCl2
AlCl3
选做题(10分)
说明:请考生从23、24两题中任选一题作答。若两题都做,则只批阅23题
答案(1)[Al(OH)4]-+H+ =Al(OH)3 ↓+H2O [或AlO2― +H+ =Al(OH)3 ↓](2分)
(2)
成分
质量
判断依据或计算推理过程
Al
2.7g
(1分)
2Al +2NaOH +6H2O =Na[Al(OH)4]+3H2↑
54g 67.2L
m(Al) 3.36L
m(Al)=54g×3.36L/67.2L=2.7g…(2分)
(NH4)2SO4
6.6g
(1分)
MgCl2
4.75g
(1分)
FeCl2
0
(1分)
Fe(OH)2 在空气中会转化为红褐色Fe(OH)3,但步骤③中白色沉淀久置无明显变化(1分)
AlCl3
0
(1分)
原固体中只含有Al 、(NH4)2SO4和MgCl2 ,三种物质的质量之和刚好等于14.05g,所以一定没有AlCl3 (2分,加着重号的为要点,每个要点1分)
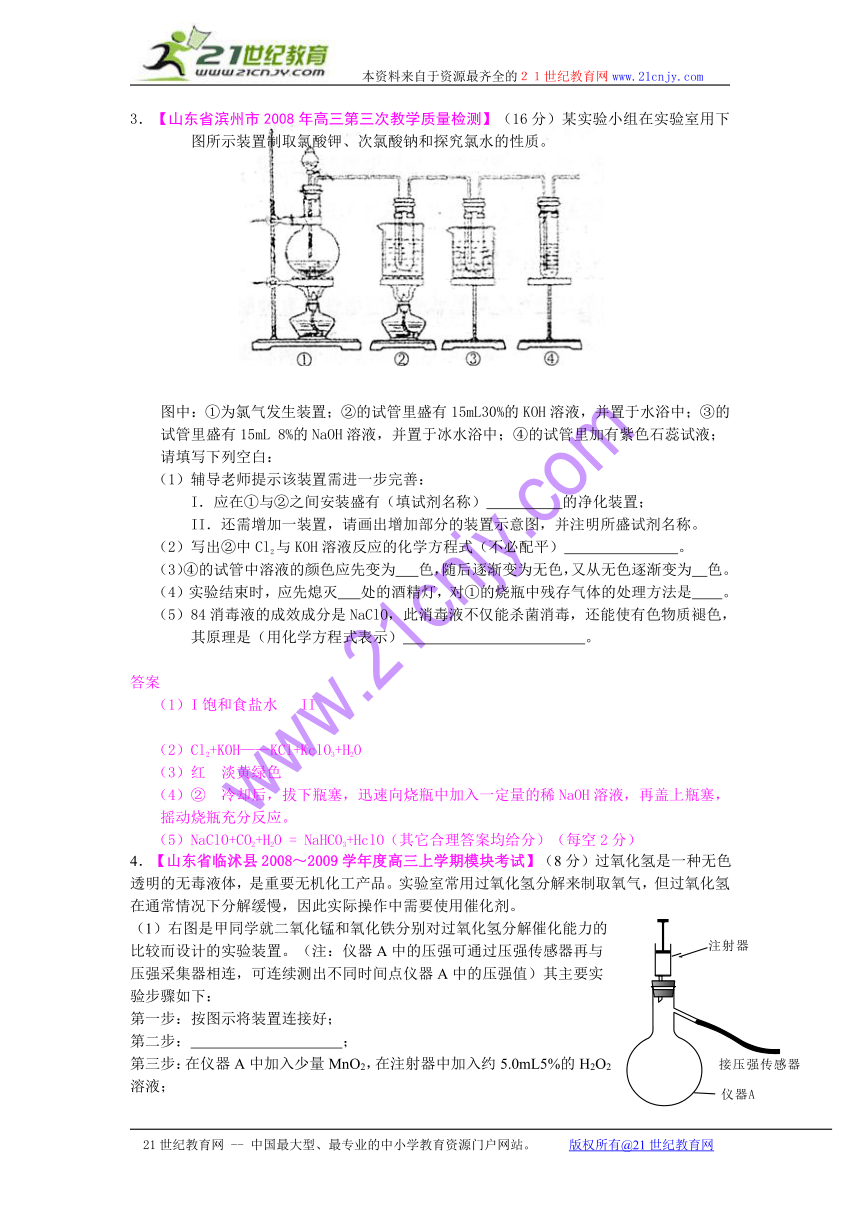
3.【山东省滨州市2008年高三第三次教学质量检测】(16分)某实验小组在实验室用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15mL30%的KOH溶液,并置于水浴中;③的试管里盛有15mL 8%的NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;
请填写下列空白:
(1)辅导老师提示该装置需进一步完善:
I.应在①与②之间安装盛有(填试剂名称) 的净化装置;
II.还需增加一装置,请画出增加部分的装置示意图,并注明所盛试剂名称。
(2)写出②中Cl2与KOH溶液反应的化学方程式(不必配平) 。
(3)④的试管中溶液的颜色应先变为 色,随后逐渐变为无色,又从无色逐渐变为 色。
(4)实验结束时,应先熄灭 处的酒精灯,对①的烧瓶中残存气体的处理方法是 。
(5)84消毒液的成效成分是NaClO,此消毒液不仅能杀菌消毒,还能使有色物质褪色,其原理是(用化学方程式表示) 。
答案
(1)I饱和食盐水 II
(2)Cl2+KOH——KCl+KclO3+H2O
(3)红 淡黄绿色
(4)② 冷却后,拔下瓶塞,迅速向烧瓶中加入一定量的稀NaOH溶液,再盖上瓶塞,摇动烧瓶充分反应。
(5)NaClO+CO2+H2O = NaHCO3+HclO(其它合理答案均给分)(每空2分)
4.【山东省临沭县2008~2009学年度高三上学期模块考试】(8分)过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。实验室常用过氧化氢分解来制取氧气,但过氧化氢在通常情况下分解缓慢,因此实际操作中需要使用催化剂。
(1)右图是甲同学就二氧化锰和氧化铁分别对过氧化氢分解催化能力的比较而设计的实验装置。(注:仪器A中的压强可通过压强传感器再与压强采集器相连,可连续测出不同时间点仪器A中的压强值)其主要实验步骤如下:
第一步:按图示将装置连接好;
第二步: ;
第三步:在仪器A中加入少量MnO2,在注射器中加入约5.0mL5%的H2O2溶液;
第四步:接通采集器电源,设置每隔1s测量一次仪器A中的压强,测定点数为70点;
第五步:向仪器A中注入2.0mL H2O2溶液并保持注射器活塞不移动,同时开始测定仪器A中的压强。 再选择氧化铁代替二氧化锰重复上述操作。回答下列问题:
①保存过氧化氢试剂瓶上最适合贴上的一个标签是 (填序号);
②仪器A的名称是 ;
③上述第二步实验步骤是 ;
④右图是氧化铁和二氧化锰分别催化分解过氧化氢时体系压强的变化曲线(a线表示二氧化锰,b线表示氧化铁),则A点数据的含义是 ,
二氧化锰对过氧化氢分解的催化能力比氧化铁 ,判断依据是 。
(2)右图是实验室制取氢气的常用装置,但却不能用于过氧化氢在二氧化锰催化作用下分解制氧气。乙同学经过认真研究,将二氧化锰粉末与水泥按一定比例制成块状固体后终于创造性地解决了上述问题。你认为他这样做的优点有① ,
②
答案.(8分)(1)①B(1分) ②蒸馏烧瓶(1分,只答烧瓶或者圆底烧瓶不得分)
③检查气密性(1分)
④大气压(或开始时烧瓶内的压强)(1分) 强(1分)
开始一段时间内曲线a的变化值大于曲线b。或答a先达到平衡。(1分)
(2)①随开随用,随关随停 ②有利于控制氧气的量 ③有利于控制氧气的生成速率 ④有利于二氧化锰的回收 (答出任意两点即可,每空1分)
5.【山东省临沭县2008~2009学年度高三上学期模块考试】(8分)为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积
方案Ⅱ:铜铝混合物 测定剩余固体的质量
回答下列问题:
(1)小组成员一致认为两个方案都可行,你认为在实验室中选择方案 更便于实施。
(2)小组成员一致认为两个方案中可供选择的溶液A和B有很多,你认为在两个方案中溶液A和B均可选用的是 。(填编号)
A.稀盐酸 B.氢氧化钠溶液 C.硫酸铜溶液
(3)小组成员为探究Cu2+、Al3+在溶液中是否可以依次转化为沉淀而析出,设计了如下实验:向含有0.01molHNO3、0.001molCu(NO3)2、0.045molAl(NO3)3的溶液中逐滴加入一定浓度的NH3·H2O溶液,使混合溶液的pH值不断升高,当加至溶液的体积为45 mL时Al3+开始反应生成沉淀,当加至溶液的体积为50 mL时Cu2+开始反应生成沉淀。(不考虑溶液的体积变化)(常温下Ksp[Al(OH)3]=1.0×10-33mol·L-4,
Ksp[Cu(OH)2]=2.0×10-20mol·L-3。)
①Al(OH)3开始析出时溶液的pH为______________
②若溶液中离子的浓度约为1.0×10-5 mol/L时可视为沉淀完全,则当Al(OH)3沉淀完全时Cu(OH)2是否析出?__________________,
理由_________________________________________________________________。
答案(1)Ⅱ (1分)
(2)A、B (共2分,多选或者少选或者错选都不得分。)
(3)①PH=3(2分)
(计算得Al(OH)3开始沉淀析出时c(OH-)=1.0×10-11mol·L-1 ,PH=3
②否 (1分)
同理,计算得 PH=5,Cu(OH)2开始析出(1分)
PH≈4.7,Al(OH)3沉淀完全(1分)
故 Al(OH)3沉淀完全时,无Cu(OH)2析出。
6【宁阳二中09届高三化学上学期期末模拟题】.(16分)现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
I探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将mg铁碳合金样品放人A中,再加入适量的浓硫酸。未点燃酒精灯前,A、B均无明显现象,其原因是:_____________________________________________________________ ______________________________________________________________________。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式________________________________________(任写一个)。B中的现象是________________________________________,由此可得到浓硫酸具有__________性。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式:
__________________________________________________(任写一个)。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是____________________________________________________________。
Ⅱ测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。
铁碳合金中铁的质量分数为____________________(写表达式)。
(7)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是__________(填写代号)。
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、称量残渣的质量
C.测定反应前后装置和药品的总质量
答案.(16分)(2)常温下,FE被浓硫酸钝化,碳不与浓硫酸反应;
(3)2Fe+6H2SO4(浓)Fe2(SO4)3+3SO2↑+6H2O
(或C+2H2SO4(浓)CO2↑+2SO2↑+2H2O);品红溶液逐渐褪色;强氧化;
(4)2Fe3++Fe==3Fe2+(或Fe+2H+==Fe2++H2↑);
(5)勿碳在溶液中形成原电池;
(6)(或或);(7)C(各2分)。
1. 【09枣庄调考模拟试卷】(7分)如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
序号
内容
实验现象
1
常温下将铁丝放在干燥空气中一个月
干燥的铁丝表面依然光亮
2
常温下将铁丝放在潮湿空气中一小时
铁丝表面依然光亮
3
常温下将铁丝放在潮湿的空气中一个月
铁丝表面已变得灰暗
4
将潮湿的铁丝放在常温的氧气流中一小时
铁丝表面略显灰暗
5
将潮湿的铁丝放在高于常温的氧气流中一小时
铁丝表面已变得灰暗
6
将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时
铁丝表面灰暗程度比实验5严重
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) __________; 在电化学腐 蚀中,负极反应是______________; 正极反应是______________________;
(2)由该实验可知,可以影响铁锈蚀速率的因素是__________________________; (3)为防止铁的锈蚀,工业上普遍采用的方法是______________(答两种方法)
答案.(1)3、5、6 负极反应:2Fe 2Fe2+ +4e-
正极反应:O2+2H2O +4e- 4OH-
(2)O2的浓度和电解质的强弱 (3)涂防锈漆、电镀等
2. 【潍坊市2009届3月份高考模拟化学】(12分)某固体混合物可能由Al 、(NH4)2SO4、MgCl2 、FeCl2 、AlCl3 中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换
算成标准状况下的体积):
回答下列问题:
(1)写出反应④的离子方程式___________________________________________.
(2)填写下表中的空白。(注:若混合物中不存在该成分,则“质量”栏中填“0”;
画斜线的表格不需填写)
成分
质量
判断依据或计算推理过程
Al
(NH4)2SO4
MgCl2
FeCl2
AlCl3
选做题(10分)
说明:请考生从23、24两题中任选一题作答。若两题都做,则只批阅23题
答案(1)[Al(OH)4]-+H+ =Al(OH)3 ↓+H2O [或AlO2― +H+ =Al(OH)3 ↓](2分)
(2)
成分
质量
判断依据或计算推理过程
Al
2.7g
(1分)
2Al +2NaOH +6H2O =Na[Al(OH)4]+3H2↑
54g 67.2L
m(Al) 3.36L
m(Al)=54g×3.36L/67.2L=2.7g…(2分)
(NH4)2SO4
6.6g
(1分)
MgCl2
4.75g
(1分)
FeCl2
0
(1分)
Fe(OH)2 在空气中会转化为红褐色Fe(OH)3,但步骤③中白色沉淀久置无明显变化(1分)
AlCl3
0
(1分)
原固体中只含有Al 、(NH4)2SO4和MgCl2 ,三种物质的质量之和刚好等于14.05g,所以一定没有AlCl3 (2分,加着重号的为要点,每个要点1分)
3.【山东省滨州市2008年高三第三次教学质量检测】(16分)某实验小组在实验室用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15mL30%的KOH溶液,并置于水浴中;③的试管里盛有15mL 8%的NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;
请填写下列空白:
(1)辅导老师提示该装置需进一步完善:
I.应在①与②之间安装盛有(填试剂名称) 的净化装置;
II.还需增加一装置,请画出增加部分的装置示意图,并注明所盛试剂名称。
(2)写出②中Cl2与KOH溶液反应的化学方程式(不必配平) 。
(3)④的试管中溶液的颜色应先变为 色,随后逐渐变为无色,又从无色逐渐变为 色。
(4)实验结束时,应先熄灭 处的酒精灯,对①的烧瓶中残存气体的处理方法是 。
(5)84消毒液的成效成分是NaClO,此消毒液不仅能杀菌消毒,还能使有色物质褪色,其原理是(用化学方程式表示) 。
答案
(1)I饱和食盐水 II
(2)Cl2+KOH——KCl+KclO3+H2O
(3)红 淡黄绿色
(4)② 冷却后,拔下瓶塞,迅速向烧瓶中加入一定量的稀NaOH溶液,再盖上瓶塞,摇动烧瓶充分反应。
(5)NaClO+CO2+H2O = NaHCO3+HclO(其它合理答案均给分)(每空2分)
4.【山东省临沭县2008~2009学年度高三上学期模块考试】(8分)过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。实验室常用过氧化氢分解来制取氧气,但过氧化氢在通常情况下分解缓慢,因此实际操作中需要使用催化剂。
(1)右图是甲同学就二氧化锰和氧化铁分别对过氧化氢分解催化能力的比较而设计的实验装置。(注:仪器A中的压强可通过压强传感器再与压强采集器相连,可连续测出不同时间点仪器A中的压强值)其主要实验步骤如下:
第一步:按图示将装置连接好;
第二步: ;
第三步:在仪器A中加入少量MnO2,在注射器中加入约5.0mL5%的H2O2溶液;
第四步:接通采集器电源,设置每隔1s测量一次仪器A中的压强,测定点数为70点;
第五步:向仪器A中注入2.0mL H2O2溶液并保持注射器活塞不移动,同时开始测定仪器A中的压强。 再选择氧化铁代替二氧化锰重复上述操作。回答下列问题:
①保存过氧化氢试剂瓶上最适合贴上的一个标签是 (填序号);
②仪器A的名称是 ;
③上述第二步实验步骤是 ;
④右图是氧化铁和二氧化锰分别催化分解过氧化氢时体系压强的变化曲线(a线表示二氧化锰,b线表示氧化铁),则A点数据的含义是 ,
二氧化锰对过氧化氢分解的催化能力比氧化铁 ,判断依据是 。
(2)右图是实验室制取氢气的常用装置,但却不能用于过氧化氢在二氧化锰催化作用下分解制氧气。乙同学经过认真研究,将二氧化锰粉末与水泥按一定比例制成块状固体后终于创造性地解决了上述问题。你认为他这样做的优点有① ,
②
答案.(8分)(1)①B(1分) ②蒸馏烧瓶(1分,只答烧瓶或者圆底烧瓶不得分)
③检查气密性(1分)
④大气压(或开始时烧瓶内的压强)(1分) 强(1分)
开始一段时间内曲线a的变化值大于曲线b。或答a先达到平衡。(1分)
(2)①随开随用,随关随停 ②有利于控制氧气的量 ③有利于控制氧气的生成速率 ④有利于二氧化锰的回收 (答出任意两点即可,每空1分)
5.【山东省临沭县2008~2009学年度高三上学期模块考试】(8分)为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积
方案Ⅱ:铜铝混合物 测定剩余固体的质量
回答下列问题:
(1)小组成员一致认为两个方案都可行,你认为在实验室中选择方案 更便于实施。
(2)小组成员一致认为两个方案中可供选择的溶液A和B有很多,你认为在两个方案中溶液A和B均可选用的是 。(填编号)
A.稀盐酸 B.氢氧化钠溶液 C.硫酸铜溶液
(3)小组成员为探究Cu2+、Al3+在溶液中是否可以依次转化为沉淀而析出,设计了如下实验:向含有0.01molHNO3、0.001molCu(NO3)2、0.045molAl(NO3)3的溶液中逐滴加入一定浓度的NH3·H2O溶液,使混合溶液的pH值不断升高,当加至溶液的体积为45 mL时Al3+开始反应生成沉淀,当加至溶液的体积为50 mL时Cu2+开始反应生成沉淀。(不考虑溶液的体积变化)(常温下Ksp[Al(OH)3]=1.0×10-33mol·L-4,
Ksp[Cu(OH)2]=2.0×10-20mol·L-3。)
①Al(OH)3开始析出时溶液的pH为______________
②若溶液中离子的浓度约为1.0×10-5 mol/L时可视为沉淀完全,则当Al(OH)3沉淀完全时Cu(OH)2是否析出?__________________,
理由_________________________________________________________________。
答案(1)Ⅱ (1分)
(2)A、B (共2分,多选或者少选或者错选都不得分。)
(3)①PH=3(2分)
(计算得Al(OH)3开始沉淀析出时c(OH-)=1.0×10-11mol·L-1 ,PH=3
②否 (1分)
同理,计算得 PH=5,Cu(OH)2开始析出(1分)
PH≈4.7,Al(OH)3沉淀完全(1分)
故 Al(OH)3沉淀完全时,无Cu(OH)2析出。
6【宁阳二中09届高三化学上学期期末模拟题】.(16分)现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
I探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
(2)将mg铁碳合金样品放人A中,再加入适量的浓硫酸。未点燃酒精灯前,A、B均无明显现象,其原因是:_____________________________________________________________ ______________________________________________________________________。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式________________________________________(任写一个)。B中的现象是________________________________________,由此可得到浓硫酸具有__________性。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式:
__________________________________________________(任写一个)。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是____________________________________________________________。
Ⅱ测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。
铁碳合金中铁的质量分数为____________________(写表达式)。
(7)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是__________(填写代号)。
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、称量残渣的质量
C.测定反应前后装置和药品的总质量
答案.(16分)(2)常温下,FE被浓硫酸钝化,碳不与浓硫酸反应;
(3)2Fe+6H2SO4(浓)Fe2(SO4)3+3SO2↑+6H2O
(或C+2H2SO4(浓)CO2↑+2SO2↑+2H2O);品红溶液逐渐褪色;强氧化;
(4)2Fe3++Fe==3Fe2+(或Fe+2H+==Fe2++H2↑);
(5)勿碳在溶液中形成原电池;
(6)(或或);(7)C(各2分)。
同课章节目录
