山东名校2009高三化学试题分类汇编(实验探究2)
文档属性
| 名称 | 山东名校2009高三化学试题分类汇编(实验探究2) |
|
|
| 格式 | rar | ||
| 文件大小 | 250.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-11-13 00:00:00 | ||
图片预览


文档简介
山东名校2009高三化学试题汇编(实验探究2)
1.【山东省临清一中2009届高考理科综合全真模拟试题(十)】在一个小烧杯里混合10mL 0.01mol·L-1FeCl3溶液和 10mL 0.01mol·L-1KSCN溶液,将此红色混和溶液分装在甲、乙、丙三支试管中,向甲试管中加入少量KCl晶体,乙试管中通入SO2气体,再与丙试管对照,结果发现甲试管颜色不变,乙试管颜色变浅,下列说法不正确的是 ( B )
A.溶液中的K+、Cl-离子没有参加离子反应
B.SO2的漂白作用使溶液颜色变浅
C.Fe3+和SO2发生了氧化还原反应
D.丙溶液起对照作用,不能省去
2【2009届高考临清一中理科综合全真模拟化学试题(四)】下列除去杂质(试样中括号内的物质是杂质)时,选用的试剂正确的是 【C】
A
B
C
D
试样
Na2CO3(NaHCO3)
FeCl2(FeCl3)
Fe(A1)
CO2(SO2)
除杂试剂
澄清石灰水
NaOH溶液
NaOH溶液
饱和NaHSO3溶液
3. 【2009届高考临清一中理科综合全真模拟化学试题(三)】下列各选项正确的是 ( A )
A.用盐析的方法分离油脂皂化反应的产物
B.用25 mL酸式滴定管量出14.8 mLNa 2CO3溶液
C.把浓硝酸保存在带胶塞的试剂瓶里
D.pH试纸、石蕊试纸、淀粉-Kl试纸在使用前均需用蒸馏水润湿
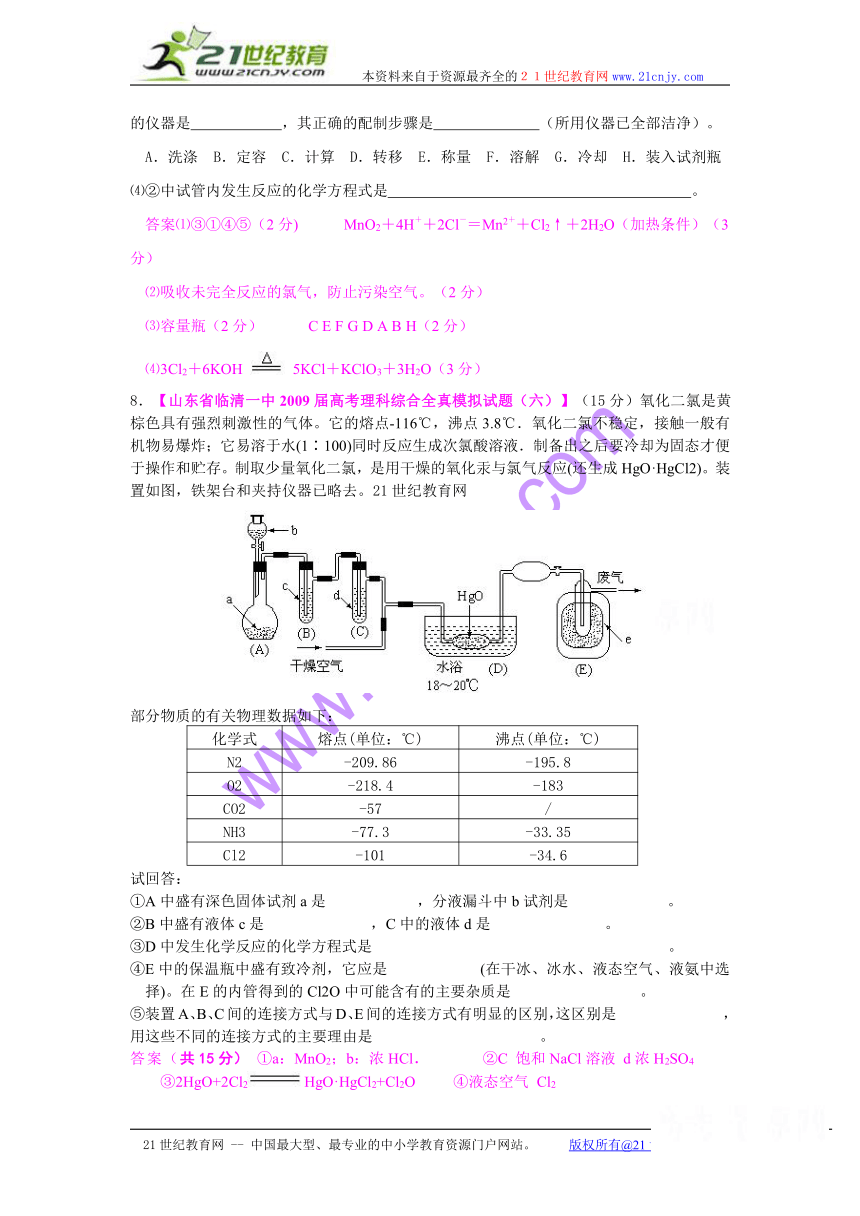
4.下图所示为常见气体制备、分离、干爆和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氯化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应 ,活塞b应 。需要加热的仪器装置有 (填代号),m中反应的化学方程式为 。
(3)若气体入口改通空气,分液漏斗内改装浓氨水,圆底烧瓶内改装 NaOH 固体,E 内装置铂铑合金网,按A→G→E→D装置程序制取干燥氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有: 。
②实验中观察到E内有红棕色气体现出,证明氨气具有 性。
答案(1)ACBECF;AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变混浊。
(2)关闭;打开;k;m;2CH3CH2OH+O2 2CH3CHO+2H2O
(3)氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。 还原。
5.【山东省临清一中2009届高考理科综合全真模拟试题(十)】(14分)制取氟的氧氯化物X可采用特制的耐氟容器,使氟气缓缓地与10%的HClO4反应。X中各元素的质量分数为:Cl占30%,O占54%,F占16%。其实验装置如下图所示:
已知有关有资料如下:21世纪教育网 ①无水KF易吸F2、HF和H2O
②X的熔点为-167℃,沸点为
-15.9℃,易分解或接触有机物发生爆炸
③F2的沸点为-188℃,HF的沸点为
19.54℃,O2的沸点为-183℃ 试回答: (1)X的化学式是 。 (2)实验中生成X的化学方程式
是 。 (3)D装置的作用是 。 (4)B中冷却剂选用液氧的理由是
。
(5)A中填充环状物的作用是
(6)有人用石墨为填充剂,结果无X生成。石墨加入导致不能生成X的主要理由是 。
答案(14分)(1)ClO4F(2分)(2)HClO4 + F2 = ClO4F + HF(2分)
(3)吸收生成的HF(2分)(4)因为液氧提供的低温可以使X成为固体,便于X的分离(3分)(5)增大F2与HClO4的接触面积,以利于反应朝预定方向进行(3分)(6)C与HClO4发生反应。(2分)
6.【山东省临清一中2009届高考理科综合全真模拟试题(七)】(11分)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学的反应制取胆矾。其设计的实验过程为:
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使 ,灼烧后的坩埚应放在
上,不能直接放在桌面上。
实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是 。
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径II实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种斜径制取胆矾,与途径I相比,途径II有明显的两个优点是: 、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,若测定结果x 值偏高,可能的原因是 。
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
答案.(14分)(1)c?;e?;b (3分) (2)a、b(2分) (3)蒸发;过滤(2分) (4)产生等量胆矾途径Ⅱ消耗硫酸少;途径Ⅱ不会产生污染大气的气体(4分) (5)a(3分)
7【山东2009届高三理科综合练习】(共16分)将Cl2通入到浓、热的KOH溶液中可以得到氯酸钾,现要制备纯净的KClO3晶体,并且保证不污染空气。制备过程中浓KOH溶液需用水浴加热,实验中所需的仪器如图所示。
⑴组装制备纯净Cl2(不考虑水蒸气)的装置,应选用的仪器有 (填编号);①装置中发生反应的离子方程式是 。
⑵在实验装置的最后要连接⑤装置,其作用是 。
⑶仪器②中的试管里需要40ml 7.5mol/L的KOH溶液,现要配制该溶液,需要一种容积精确的仪器是 ,其正确的配制步骤是 (所用仪器已全部洁净)。
A.洗涤 B.定容 C.计算 D.转移 E.称量 F.溶解 G.冷却 H.装入试剂瓶
⑷②中试管内发生反应的化学方程式是 。
答案⑴③①④⑤(2分) MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O(加热条件)(3分)
⑵吸收未完全反应的氯气,防止污染空气。(2分)
⑶容量瓶(2分) C E F G D A B H(2分)
⑷3Cl2+6KOH 5KCl+KClO3+3H2O(3分)
8.【山东省临清一中2009届高考理科综合全真模拟试题(六)】(15分)氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液.制备出之后要冷却为固态才便于操作和贮存。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,铁架台和夹持仪器已略去。21世纪教育网 部分物质的有关物理数据如下:?21世纪教育网
化学式
熔点(单位:℃)
沸点(单位:℃)
N2
-209.86
-195.8
O2
-218.4
-183
CO2
-57
/
NH3
-77.3
-33.35
Cl2
-101
-34.6
试回答:? ①A中盛有深色固体试剂a是 ,分液漏斗中b试剂是 。
②B中盛有液体c是 ,C中的液体d是 。?
③D中发生化学反应的化学方程式是 。
④E中的保温瓶中盛有致冷剂,它应是 (在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是 。
⑤装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是 ,用这些不同的连接方式的主要理由是 。
答案(共15分) ①a:MnO2;b:浓HCl. ②C 饱和NaCl溶液 d浓H2SO4
③2HgO+2Cl2HgO·HgCl2+Cl2O ④液态空气 Cl2
⑤D、E中无橡胶塞,氧化二氯接触有机物而爆炸。(每小题均3分)
9.【山东省临清一中2009届高考理科综合全真模拟试题(六)】(13分)下表是四种盐在不同温度下的溶解度(g/100g水):
NaNO3
KNO3
NaCl
KCl
10℃
80.5
21.2
35.7
31.0
100℃
175
246
39.1
56.6
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
某同学设计用物质的量之比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图所示:
(1)在①和②的实验过程中,需要控制的关键的实验条件是___________,
在上述晶体中,______(填“A”或“C”)应为硝酸钾晶体。
(2)在①的实验过程中,需要进行的操作依次是___________、____________、_________。
(3)粗产品中可能含有杂质离子_______,检验其中一种离子的方法是_________。
(4)为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是___________(填编号)。
a.热水 b.冰水 c.95%的酒精 d.四氯化碳
(5)如取34.0g硝酸钠和29.8g氯化钾,加入70g水,在100℃蒸发掉50g水,维持该温度,过滤,析出晶体的质量为_______________。
答案共13分)(1)(2分)温度 C (2)(3分)加水溶解、蒸发浓缩、趁热过滤
(3)(4分)Na+、Clˉ 用洁净的铂丝或铁丝蘸取粗产品在火焰上灼烧,若火焰呈黄
色,证明有Na+;或 取粗产品少许,加水配成溶液,加入硝酸酸化的硝酸银溶液,若有
白色沉淀产生,证明有Clˉ。
(4)(2分)bc (5)(2分)15.6g
10.【山东省临清一中2009届高考理科综合全真模拟试题(九)】(15分 )某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
请回答下列问题。21世纪教育网
(1)仪器中装入的试剂:B_________ 、C________、D___________;
(2)连接好装置后应首先_________________________,其方法是________________
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是 _______________。在这两步之间还应进行的操作是____________________________;
(4)反应过程中G管逸出的气体是________________,其处理方法是_____
(5)从实验中测得了下列数据
①空E管的质量a ; ②E管和WO3的总质量b ;③反应后E管和W粉的总质量c(冷却到室温称量);④反应前F管及内盛物的总质量d ;⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(W)=____________;计算式2:Ar(W)=____________。
答案)(1)锌粒, 水,浓硫酸;(3分 )(2)检查气密性,将G弯管浸没在盛有水的烧杯中,温热烧瓶B,观察G管口,若有气泡逸出,说明装置的气密性良好;(3分 )
(3)先从A瓶逐滴滴加液体; 检验H2的纯度(3分 )
(4)氢气;在G管出口处点燃;(2分 )(5) (2分 ) ? (2分 )
11..【山东省临清一中2009届高考理科综合全真模拟试题(九)】(13分)M、R都是生括中常见的金属单质,其中R是用量最多的金属。甲、乙是化合物,其中甲是黑色晶体,可由R在X中燃烧得到。21世纪教育网
(1) M与甲在高温下反应的化学方程式是 。
(2) 电解法制R低价氢氧化物的装置如图。a是4mol·L-1NaCl、1mol·L-1NaOH的混合溶液。
① 配制a时需要除去蒸馏水中溶解的O2,常采用
的方法。
② 石墨电极应与电源的 (填“正”或“负”)极相连接,通电后,R电极附近的现象是 ,R极的电极反应式是 .
③ 停止实验一段时间后,在R极上部有红褐色物质产生,反应的化学方程式是 。
(3) 把R的某氧化物粉末与M粉末混合后分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是a:b,则R的氧化物的化学式是 。
答案(1) (2分)
(2)①煮沸 (1分)
②负(1分):生成白色沉淀(1分):(2分)
(3)FeaOb (3分)
12.【山东省临清一中2009届高考理综全真模拟试题(八)】(12分)某研究性学习小组,用下列仪器、药品验证合金(由Cu、Fe、Zn三种物质组成)和适量浓硝酸反应产生的气体中含NO (N2和O2的用量可自由控制,气体液化温度:NO2 21℃(特定条件下) ;—NO —152℃)
(1)在图2中选择恰当的仪器将图1补充完整,所选择仪器的连接顺序(按左→右连接,填各仪器编号)为
(2)反应前先通入N2目的是
(3)确认气体中含NO的现象是
(4)如果O2过量,则装置F中发生反应的化学方程式为:
(5)反应结束后,关闭K1、K2、K3,将D中的烧瓶从烧杯中拿出,观察到的现象
是 解释是
(6)本题中,浓硝酸(含溶质amol)完全反应,还原产物只有NO和NO2,被还原硝酸的物质的量n的取值范围为
答案.(15分)(1) EDF (3分 漏选1个扣1分 )
(2) 排尽装置中的空气,防止NO被氧化 (2分)
(3) D中烧瓶内通入O2后,无色气体变成红棕色 (2分)
(4) 4NO2 + O2 + 4NaOH = 4NaNO3 (2分)
(5) 气体颜色变浅,烧瓶拿出后,气体温度降低,平衡2NO2N2O4 △H<0向右移动,NO2的浓度减小,气体颜色变浅。(3分)
(6) a/4 mol< n < a/2 mol (3分)
13.(【山东省临清一中2009届高考理综全真模拟试题(八)】15分)某课外小组对一些金属单质和化合物的性质进行研究。21世纪教育网
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应 ;
化合反应 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是 。
解释此现象的离子方程式是 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示) 。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶 液中,MnO2溶解产生Mn2+,该反应的离子方程式是 。
答案.(15分)(1)2Al+6H+=====2Al3++3H2↑
(CuCl2水解)或2Al+3Cu2+====2Al3++3Cu(3分 )
2Cu+O2+H2O+CO2====Cu2(OH)2CO3(2分 )
(2)白色沉淀生成,后沉淀逐渐溶解至消失(3分 )
Al3++3OH-====Al(OH)3↓ (电解阴极H+放电产生OH-,与Al3+反应)(3分 )
Al(OH)3+OH-====[Al(OH)4]-- (2分 )
(3)①3MnO2+4Al 3Mn+2Al2O3 ( 铝热反应) (2分 )
②MnO2+H2O2+2H+====Mn2++O2↑+2H2O(2分 )
1.【山东省临清一中2009届高考理科综合全真模拟试题(十)】在一个小烧杯里混合10mL 0.01mol·L-1FeCl3溶液和 10mL 0.01mol·L-1KSCN溶液,将此红色混和溶液分装在甲、乙、丙三支试管中,向甲试管中加入少量KCl晶体,乙试管中通入SO2气体,再与丙试管对照,结果发现甲试管颜色不变,乙试管颜色变浅,下列说法不正确的是 ( B )
A.溶液中的K+、Cl-离子没有参加离子反应
B.SO2的漂白作用使溶液颜色变浅
C.Fe3+和SO2发生了氧化还原反应
D.丙溶液起对照作用,不能省去
2【2009届高考临清一中理科综合全真模拟化学试题(四)】下列除去杂质(试样中括号内的物质是杂质)时,选用的试剂正确的是 【C】
A
B
C
D
试样
Na2CO3(NaHCO3)
FeCl2(FeCl3)
Fe(A1)
CO2(SO2)
除杂试剂
澄清石灰水
NaOH溶液
NaOH溶液
饱和NaHSO3溶液
3. 【2009届高考临清一中理科综合全真模拟化学试题(三)】下列各选项正确的是 ( A )
A.用盐析的方法分离油脂皂化反应的产物
B.用25 mL酸式滴定管量出14.8 mLNa 2CO3溶液
C.把浓硝酸保存在带胶塞的试剂瓶里
D.pH试纸、石蕊试纸、淀粉-Kl试纸在使用前均需用蒸馏水润湿
4.下图所示为常见气体制备、分离、干爆和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氯化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应 ,活塞b应 。需要加热的仪器装置有 (填代号),m中反应的化学方程式为 。
(3)若气体入口改通空气,分液漏斗内改装浓氨水,圆底烧瓶内改装 NaOH 固体,E 内装置铂铑合金网,按A→G→E→D装置程序制取干燥氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有: 。
②实验中观察到E内有红棕色气体现出,证明氨气具有 性。
答案(1)ACBECF;AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变混浊。
(2)关闭;打开;k;m;2CH3CH2OH+O2 2CH3CHO+2H2O
(3)氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。 还原。
5.【山东省临清一中2009届高考理科综合全真模拟试题(十)】(14分)制取氟的氧氯化物X可采用特制的耐氟容器,使氟气缓缓地与10%的HClO4反应。X中各元素的质量分数为:Cl占30%,O占54%,F占16%。其实验装置如下图所示:
已知有关有资料如下:21世纪教育网 ①无水KF易吸F2、HF和H2O
②X的熔点为-167℃,沸点为
-15.9℃,易分解或接触有机物发生爆炸
③F2的沸点为-188℃,HF的沸点为
19.54℃,O2的沸点为-183℃ 试回答: (1)X的化学式是 。 (2)实验中生成X的化学方程式
是 。 (3)D装置的作用是 。 (4)B中冷却剂选用液氧的理由是
。
(5)A中填充环状物的作用是
(6)有人用石墨为填充剂,结果无X生成。石墨加入导致不能生成X的主要理由是 。
答案(14分)(1)ClO4F(2分)(2)HClO4 + F2 = ClO4F + HF(2分)
(3)吸收生成的HF(2分)(4)因为液氧提供的低温可以使X成为固体,便于X的分离(3分)(5)增大F2与HClO4的接触面积,以利于反应朝预定方向进行(3分)(6)C与HClO4发生反应。(2分)
6.【山东省临清一中2009届高考理科综合全真模拟试题(七)】(11分)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学的反应制取胆矾。其设计的实验过程为:
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使 ,灼烧后的坩埚应放在
上,不能直接放在桌面上。
实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是 。
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径II实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种斜径制取胆矾,与途径I相比,途径II有明显的两个优点是: 、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,若测定结果x 值偏高,可能的原因是 。
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
答案.(14分)(1)c?;e?;b (3分) (2)a、b(2分) (3)蒸发;过滤(2分) (4)产生等量胆矾途径Ⅱ消耗硫酸少;途径Ⅱ不会产生污染大气的气体(4分) (5)a(3分)
7【山东2009届高三理科综合练习】(共16分)将Cl2通入到浓、热的KOH溶液中可以得到氯酸钾,现要制备纯净的KClO3晶体,并且保证不污染空气。制备过程中浓KOH溶液需用水浴加热,实验中所需的仪器如图所示。
⑴组装制备纯净Cl2(不考虑水蒸气)的装置,应选用的仪器有 (填编号);①装置中发生反应的离子方程式是 。
⑵在实验装置的最后要连接⑤装置,其作用是 。
⑶仪器②中的试管里需要40ml 7.5mol/L的KOH溶液,现要配制该溶液,需要一种容积精确的仪器是 ,其正确的配制步骤是 (所用仪器已全部洁净)。
A.洗涤 B.定容 C.计算 D.转移 E.称量 F.溶解 G.冷却 H.装入试剂瓶
⑷②中试管内发生反应的化学方程式是 。
答案⑴③①④⑤(2分) MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O(加热条件)(3分)
⑵吸收未完全反应的氯气,防止污染空气。(2分)
⑶容量瓶(2分) C E F G D A B H(2分)
⑷3Cl2+6KOH 5KCl+KClO3+3H2O(3分)
8.【山东省临清一中2009届高考理科综合全真模拟试题(六)】(15分)氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液.制备出之后要冷却为固态才便于操作和贮存。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,铁架台和夹持仪器已略去。21世纪教育网 部分物质的有关物理数据如下:?21世纪教育网
化学式
熔点(单位:℃)
沸点(单位:℃)
N2
-209.86
-195.8
O2
-218.4
-183
CO2
-57
/
NH3
-77.3
-33.35
Cl2
-101
-34.6
试回答:? ①A中盛有深色固体试剂a是 ,分液漏斗中b试剂是 。
②B中盛有液体c是 ,C中的液体d是 。?
③D中发生化学反应的化学方程式是 。
④E中的保温瓶中盛有致冷剂,它应是 (在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是 。
⑤装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是 ,用这些不同的连接方式的主要理由是 。
答案(共15分) ①a:MnO2;b:浓HCl. ②C 饱和NaCl溶液 d浓H2SO4
③2HgO+2Cl2HgO·HgCl2+Cl2O ④液态空气 Cl2
⑤D、E中无橡胶塞,氧化二氯接触有机物而爆炸。(每小题均3分)
9.【山东省临清一中2009届高考理科综合全真模拟试题(六)】(13分)下表是四种盐在不同温度下的溶解度(g/100g水):
NaNO3
KNO3
NaCl
KCl
10℃
80.5
21.2
35.7
31.0
100℃
175
246
39.1
56.6
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
某同学设计用物质的量之比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图所示:
(1)在①和②的实验过程中,需要控制的关键的实验条件是___________,
在上述晶体中,______(填“A”或“C”)应为硝酸钾晶体。
(2)在①的实验过程中,需要进行的操作依次是___________、____________、_________。
(3)粗产品中可能含有杂质离子_______,检验其中一种离子的方法是_________。
(4)为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是___________(填编号)。
a.热水 b.冰水 c.95%的酒精 d.四氯化碳
(5)如取34.0g硝酸钠和29.8g氯化钾,加入70g水,在100℃蒸发掉50g水,维持该温度,过滤,析出晶体的质量为_______________。
答案共13分)(1)(2分)温度 C (2)(3分)加水溶解、蒸发浓缩、趁热过滤
(3)(4分)Na+、Clˉ 用洁净的铂丝或铁丝蘸取粗产品在火焰上灼烧,若火焰呈黄
色,证明有Na+;或 取粗产品少许,加水配成溶液,加入硝酸酸化的硝酸银溶液,若有
白色沉淀产生,证明有Clˉ。
(4)(2分)bc (5)(2分)15.6g
10.【山东省临清一中2009届高考理科综合全真模拟试题(九)】(15分 )某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
请回答下列问题。21世纪教育网
(1)仪器中装入的试剂:B_________ 、C________、D___________;
(2)连接好装置后应首先_________________________,其方法是________________
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是 _______________。在这两步之间还应进行的操作是____________________________;
(4)反应过程中G管逸出的气体是________________,其处理方法是_____
(5)从实验中测得了下列数据
①空E管的质量a ; ②E管和WO3的总质量b ;③反应后E管和W粉的总质量c(冷却到室温称量);④反应前F管及内盛物的总质量d ;⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(W)=____________;计算式2:Ar(W)=____________。
答案)(1)锌粒, 水,浓硫酸;(3分 )(2)检查气密性,将G弯管浸没在盛有水的烧杯中,温热烧瓶B,观察G管口,若有气泡逸出,说明装置的气密性良好;(3分 )
(3)先从A瓶逐滴滴加液体; 检验H2的纯度(3分 )
(4)氢气;在G管出口处点燃;(2分 )(5) (2分 ) ? (2分 )
11..【山东省临清一中2009届高考理科综合全真模拟试题(九)】(13分)M、R都是生括中常见的金属单质,其中R是用量最多的金属。甲、乙是化合物,其中甲是黑色晶体,可由R在X中燃烧得到。21世纪教育网
(1) M与甲在高温下反应的化学方程式是 。
(2) 电解法制R低价氢氧化物的装置如图。a是4mol·L-1NaCl、1mol·L-1NaOH的混合溶液。
① 配制a时需要除去蒸馏水中溶解的O2,常采用
的方法。
② 石墨电极应与电源的 (填“正”或“负”)极相连接,通电后,R电极附近的现象是 ,R极的电极反应式是 .
③ 停止实验一段时间后,在R极上部有红褐色物质产生,反应的化学方程式是 。
(3) 把R的某氧化物粉末与M粉末混合后分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是a:b,则R的氧化物的化学式是 。
答案(1) (2分)
(2)①煮沸 (1分)
②负(1分):生成白色沉淀(1分):(2分)
(3)FeaOb (3分)
12.【山东省临清一中2009届高考理综全真模拟试题(八)】(12分)某研究性学习小组,用下列仪器、药品验证合金(由Cu、Fe、Zn三种物质组成)和适量浓硝酸反应产生的气体中含NO (N2和O2的用量可自由控制,气体液化温度:NO2 21℃(特定条件下) ;—NO —152℃)
(1)在图2中选择恰当的仪器将图1补充完整,所选择仪器的连接顺序(按左→右连接,填各仪器编号)为
(2)反应前先通入N2目的是
(3)确认气体中含NO的现象是
(4)如果O2过量,则装置F中发生反应的化学方程式为:
(5)反应结束后,关闭K1、K2、K3,将D中的烧瓶从烧杯中拿出,观察到的现象
是 解释是
(6)本题中,浓硝酸(含溶质amol)完全反应,还原产物只有NO和NO2,被还原硝酸的物质的量n的取值范围为
答案.(15分)(1) EDF (3分 漏选1个扣1分 )
(2) 排尽装置中的空气,防止NO被氧化 (2分)
(3) D中烧瓶内通入O2后,无色气体变成红棕色 (2分)
(4) 4NO2 + O2 + 4NaOH = 4NaNO3 (2分)
(5) 气体颜色变浅,烧瓶拿出后,气体温度降低,平衡2NO2N2O4 △H<0向右移动,NO2的浓度减小,气体颜色变浅。(3分)
(6) a/4 mol< n < a/2 mol (3分)
13.(【山东省临清一中2009届高考理综全真模拟试题(八)】15分)某课外小组对一些金属单质和化合物的性质进行研究。21世纪教育网
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应 ;
化合反应 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是 。
解释此现象的离子方程式是 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示) 。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶 液中,MnO2溶解产生Mn2+,该反应的离子方程式是 。
答案.(15分)(1)2Al+6H+=====2Al3++3H2↑
(CuCl2水解)或2Al+3Cu2+====2Al3++3Cu(3分 )
2Cu+O2+H2O+CO2====Cu2(OH)2CO3(2分 )
(2)白色沉淀生成,后沉淀逐渐溶解至消失(3分 )
Al3++3OH-====Al(OH)3↓ (电解阴极H+放电产生OH-,与Al3+反应)(3分 )
Al(OH)3+OH-====[Al(OH)4]-- (2分 )
(3)①3MnO2+4Al 3Mn+2Al2O3 ( 铝热反应) (2分 )
②MnO2+H2O2+2H+====Mn2++O2↑+2H2O(2分 )
同课章节目录
