氧化剂和还原剂
图片预览






文档简介
课件20张PPT。 第3节
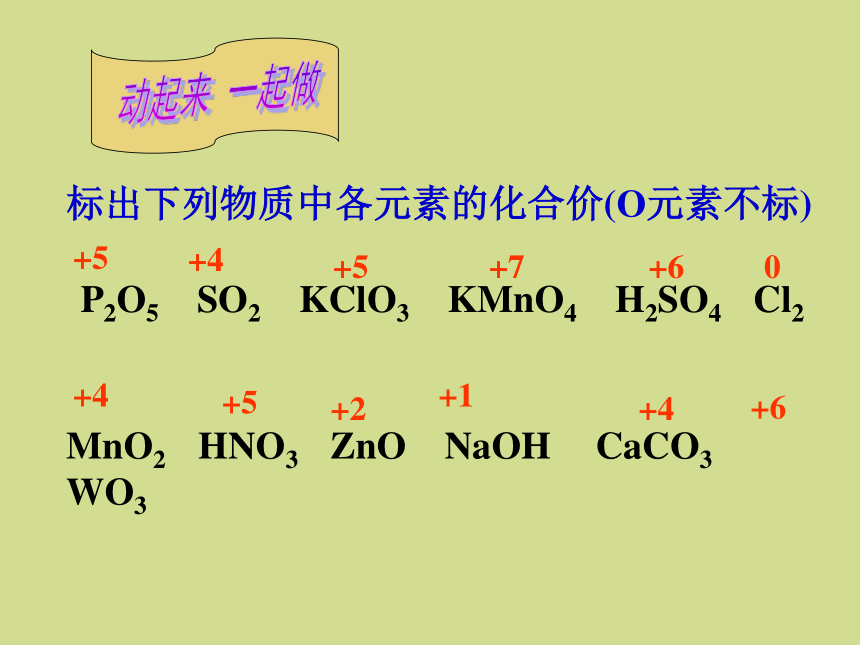
氧化剂和还原剂标出下列物质中各元素的化合价(O元素不标) P2O5 SO2 KClO3 KMnO4 H2SO4 Cl2+5MnO2 HNO3 ZnO NaOH CaCO3 WO3+4+4 +5 +7+60+5+2+1 +4 +6动起来 一起做 写出下列反应的化学方程式,分析各物质所含元素的化合价在反应前后是否发生变化.1、铜与氧气反应(化合)
2、氧化铜与氢气反应(置换)
3、碳酸钙高温加热(分解)
4、铁与硫酸铜溶液反应(置换)
5、NaCl溶液与AgNO3溶液反应(复分解)一、氧化还原反应:
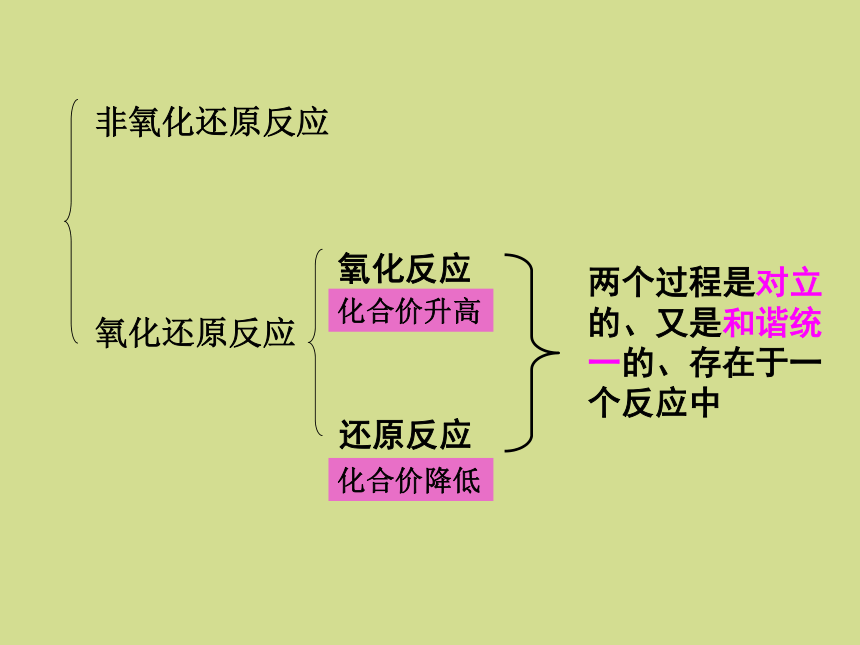
在反应过程中有元素化合价变化的
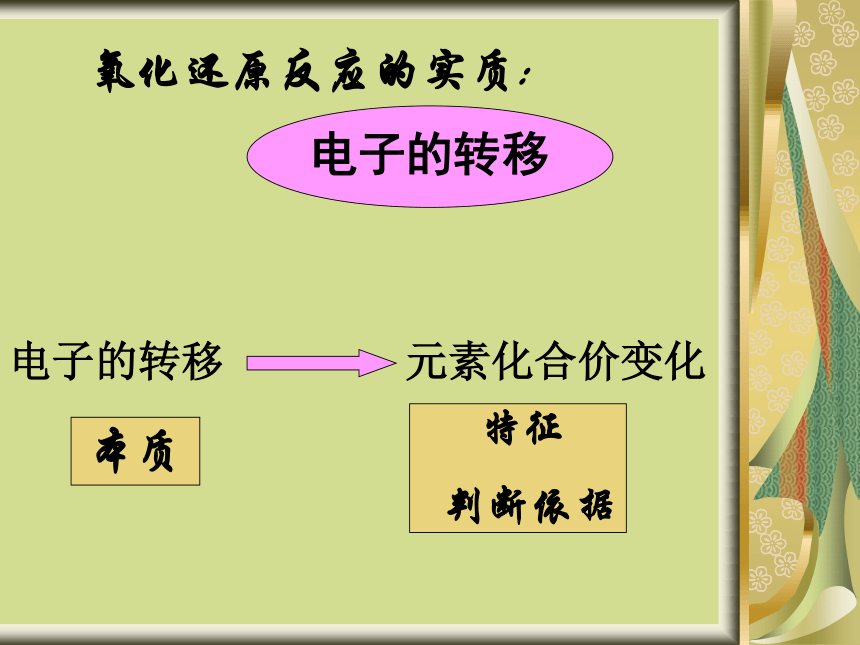
化学反应叫做氧化还原反应反应物所含元素化合价升高的反应为 氧化反应反应物所含元素化合价降低的反应为 还原反应(或者说这种物质被氧化了)(或者说这种物质被还原了)两个过程是对立的、又是和谐统一的、存在于一个反应中 化合价升高化合价降低 例 : 钠在氯气中燃烧探究氧化还原反应的本质:例 : 铁和硫酸铜溶液Cl2+ 2 Na == 2Na ClFe+CuSO4 ===FeSO4 +Cu0 0 +1 -1得电子、化合价降低(被还原)失电子、化合价升高(被氧化)0 +2 +2 0失电子、化合价升高(被氧化)得电子、化合价降低(被还原)氧化还原反应的实质:电子的转移电子的转移元素化合价变化1、化合 4Na+O2===2Na2O CO2 + H2O === H2CO3 2、分解2HClO==2HCl+O2↑ CaCO3==CO2↑+CaO3、置换Fe+2HCl===FeCl2+H2↑ 4、复分解NaCl + AgNO3 === AgCl↓ + NaNO3 高温氧化还原反应化合反应分解反应置换反应复分解反应氧化还原反应与四种基本类型的关系:二、氧化剂和还原剂交流 研讨1、Cu+Cl2 CuCl2
2、Zn+H2SO4 ZnSO4+H2 点 燃3、CaCO3+2HCl CaCl2 +H20 + CO2+200-10+2+10氧化剂还原剂氧化剂还原剂Cl2+H2O HCl+HClOFe+4HNO3(稀) Fe(NO3)3+2H2O+NOBaCl2+H2SO4 BaSO4 + 2HCl0-1+10+5+3+2氧化剂还原剂氧化剂: 还原剂:所含元素的化合价降低的反应物 所含元素的化合价升高的反应物 具有氧化性,得电子具有还原性,失电子物质中的元素为最高价时:
只能做氧化剂,显氧化性
物质中的元素为最低价时:
只能做还原剂,显还原性
物质中的 元素为中间价态的时候:
既可以做氧化剂又可以做还原剂;
元素的化合价与物质的氧化性、还原性有何关系?活泼的非金属单质:氧气,氯气等
高价态的含氧酸:硝酸,浓硫酸等
含高价态元素的盐:高锰酸钾,氯化铁等
KMnO4 FeCl3常见的氧化剂和还原剂:氧化剂活泼的金属单质:铁,钠,锌
非金属单质:氢气,炭
低价态的氧化物和盐:CO, 亚硫酸钠(Na2SO3),
SO2 硫酸亚铁(FeSO4)还原剂
下列对属于氧化还原反应的进行分析,并
指出氧化剂和还原剂。
A、HCl + NH3 NH4Cl
B、2FeCl2+ Cl2 2FeCl3
C、NH4HCO3 NH3 ↑+ H20 +CO2↑
D、MnO2 + 4HCl MnCl2 + Cl2↑ + 2H2O ▲自我
评价▲本节小结1、氧化还原反应的特征元素的化合价发生了变化2、氧化还原反应的实质有电子的得失和转移3、氧化剂得电子,被还原的物质还原剂失电子,被氧化的物质
氧化剂和还原剂标出下列物质中各元素的化合价(O元素不标) P2O5 SO2 KClO3 KMnO4 H2SO4 Cl2+5MnO2 HNO3 ZnO NaOH CaCO3 WO3+4+4 +5 +7+60+5+2+1 +4 +6动起来 一起做 写出下列反应的化学方程式,分析各物质所含元素的化合价在反应前后是否发生变化.1、铜与氧气反应(化合)
2、氧化铜与氢气反应(置换)
3、碳酸钙高温加热(分解)
4、铁与硫酸铜溶液反应(置换)
5、NaCl溶液与AgNO3溶液反应(复分解)一、氧化还原反应:
在反应过程中有元素化合价变化的
化学反应叫做氧化还原反应反应物所含元素化合价升高的反应为 氧化反应反应物所含元素化合价降低的反应为 还原反应(或者说这种物质被氧化了)(或者说这种物质被还原了)两个过程是对立的、又是和谐统一的、存在于一个反应中 化合价升高化合价降低 例 : 钠在氯气中燃烧探究氧化还原反应的本质:例 : 铁和硫酸铜溶液Cl2+ 2 Na == 2Na ClFe+CuSO4 ===FeSO4 +Cu0 0 +1 -1得电子、化合价降低(被还原)失电子、化合价升高(被氧化)0 +2 +2 0失电子、化合价升高(被氧化)得电子、化合价降低(被还原)氧化还原反应的实质:电子的转移电子的转移元素化合价变化1、化合 4Na+O2===2Na2O CO2 + H2O === H2CO3 2、分解2HClO==2HCl+O2↑ CaCO3==CO2↑+CaO3、置换Fe+2HCl===FeCl2+H2↑ 4、复分解NaCl + AgNO3 === AgCl↓ + NaNO3 高温氧化还原反应化合反应分解反应置换反应复分解反应氧化还原反应与四种基本类型的关系:二、氧化剂和还原剂交流 研讨1、Cu+Cl2 CuCl2
2、Zn+H2SO4 ZnSO4+H2 点 燃3、CaCO3+2HCl CaCl2 +H20 + CO2+200-10+2+10氧化剂还原剂氧化剂还原剂Cl2+H2O HCl+HClOFe+4HNO3(稀) Fe(NO3)3+2H2O+NOBaCl2+H2SO4 BaSO4 + 2HCl0-1+10+5+3+2氧化剂还原剂氧化剂: 还原剂:所含元素的化合价降低的反应物 所含元素的化合价升高的反应物 具有氧化性,得电子具有还原性,失电子物质中的元素为最高价时:
只能做氧化剂,显氧化性
物质中的元素为最低价时:
只能做还原剂,显还原性
物质中的 元素为中间价态的时候:
既可以做氧化剂又可以做还原剂;
元素的化合价与物质的氧化性、还原性有何关系?活泼的非金属单质:氧气,氯气等
高价态的含氧酸:硝酸,浓硫酸等
含高价态元素的盐:高锰酸钾,氯化铁等
KMnO4 FeCl3常见的氧化剂和还原剂:氧化剂活泼的金属单质:铁,钠,锌
非金属单质:氢气,炭
低价态的氧化物和盐:CO, 亚硫酸钠(Na2SO3),
SO2 硫酸亚铁(FeSO4)还原剂
下列对属于氧化还原反应的进行分析,并
指出氧化剂和还原剂。
A、HCl + NH3 NH4Cl
B、2FeCl2+ Cl2 2FeCl3
C、NH4HCO3 NH3 ↑+ H20 +CO2↑
D、MnO2 + 4HCl MnCl2 + Cl2↑ + 2H2O ▲自我
评价▲本节小结1、氧化还原反应的特征元素的化合价发生了变化2、氧化还原反应的实质有电子的得失和转移3、氧化剂得电子,被还原的物质还原剂失电子,被氧化的物质
