铁及其化合物性质
图片预览





文档简介
课件15张PPT。B案知识检查1.铁是人类应用较早,当前应用量最大的金属元素。下列有关铁及其化合物的有关说法正确的是( )
A.赤铁矿的主要成分是Fe3O4
B.铁在氧气中燃烧生成Fe2O3
C除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D用焦炭还原铁矿石得到的铁是纯铁
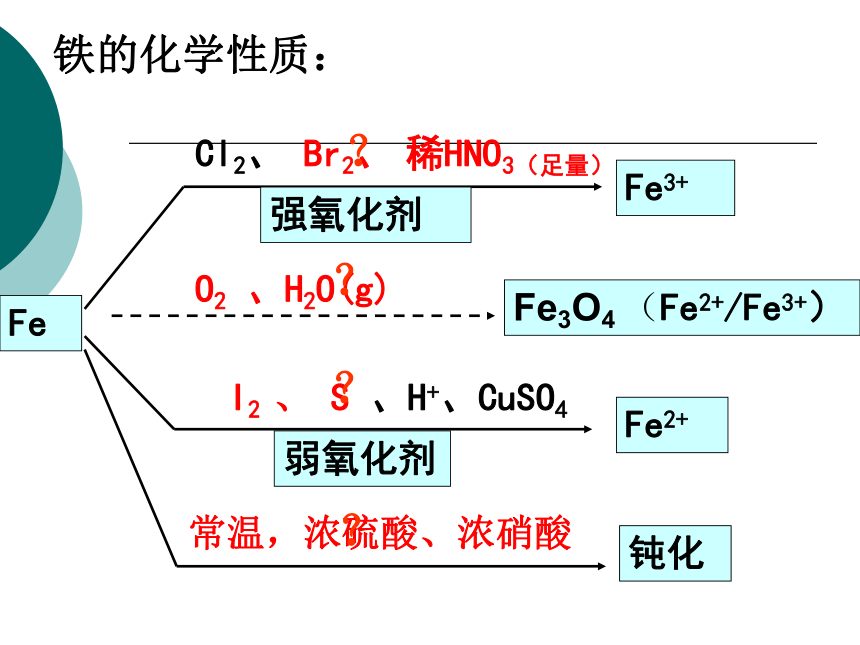
CFeFe2+Fe3+Fe3O4 (Fe2+/Fe3+)Cl2、 Br2、 稀HNO3(足量)O2 、H2O(g)I2 、 S 、H+、CuSO4强氧化剂弱氧化剂铁的化学性质:常温,浓硫酸、浓硝酸钝化????3. Fe(OH)3分别与足量的HCl、 HI反应时有什么不同?Fe(OH)3作为一种碱与酸反应生成盐和水,
但Fe3+有较强的氧化性,若与之反应的酸
为还原性酸(如H2S、HI)则再发生氧化还
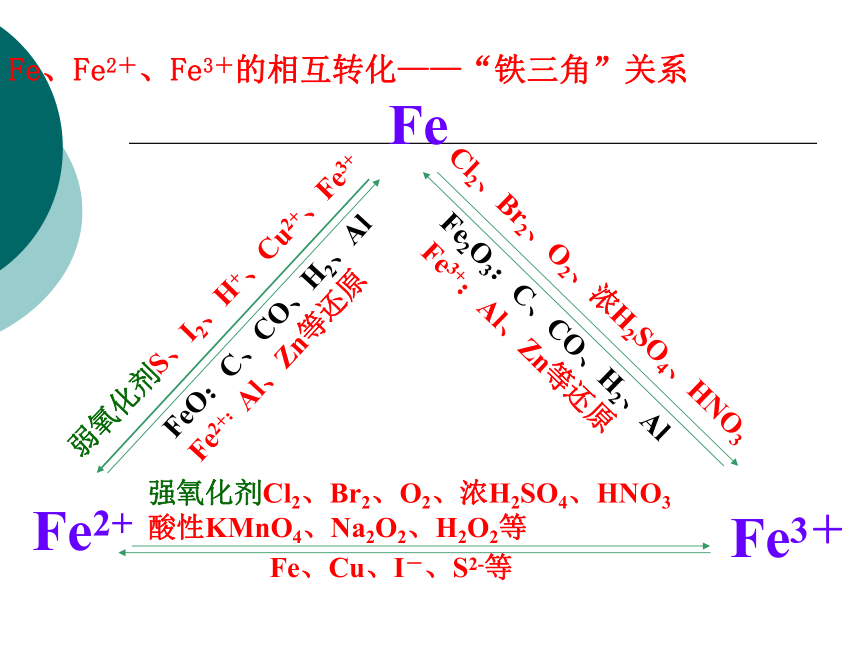
原反应问题探究如何用简单方法将铝粉和铁粉混合物分开?铁与I2 、 S反应时能否生成FeI3和 Fe2S3?FeO与稀HNO3反应的化学方程式如何写?例1(1)在FeCl2溶液中存在平衡FeCl2+2H2O Fe(OH)2 +2HCl加热时,HCl挥发,平衡右移,生成Fe(OH)2 Fe(OH)2很快氧化成 Fe(OH)3,灼烧后生成Fe2O3弱氧化剂:H+、Cu2+、S、I2、Fe3+等 强氧化剂:Cl2、Br2、热浓H2SO4、HNO3等Fe、Fe2+、Fe3+的相互转化Zn(不足)、Fe、Cu、S2-、I-、SO2Fe、Fe2+、Fe3+的相互转化——“铁三角”关系FeFe3+Fe2+弱氧化剂S、I2、H+、Cu2+、Fe3+Cl2、Br2、O2、浓H2SO4、HNO3
Fe2O3:C、CO、H2、Al
Fe3+:Al、Zn等还原
FeO:C、CO、H2、Al
Fe2+:Al、Zn等还原强氧化剂Cl2、Br2、O2、浓H2SO4、HNO3
酸性KMnO4、Na2O2、H2O2等Fe、Cu、I-、S2-等活学活用答案1nm~100nm
Fe FeS H2SO4
2 Fe 2+ + H2O2 +2H+=2 Fe 3+ +2 H2O
取少量E于试管中,用胶头滴管加入浓氢氧化钠溶液,加热,在试管口放一湿润的红色石蕊试纸,试纸变蓝色,说明有NH4+Fe2+和Fe3+的检验方法一 取少量被检验的溶液,滴加KSCN溶液,无现象,再通入Cl2,若变成血红色溶液,说明有Fe2+方法二 取少量被检验溶液,加入NaOH溶液,产生白色沉淀,沉淀迅速转变成灰绿色,最后变成红褐色,说明有Fe2+方法二: 取少量被检验溶液,加入KSCN溶液,如果溶液变成血红色,说明含有Fe3+方法一:取少量被检验溶液,加入NaOH溶液,如果生成红褐色沉淀,说明含有Fe3+重点注意:
铁和稀硝酸的反应铁粉不足:
Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
n (Fe) :n( HNO3 )= (3∶12)
铁粉过量:
3Fe+8HNO3=3Fe(NO3)2 +2NO ↑ +4H2O
n (Fe) :n( HNO3 )= (3∶8)将14克铁粉溶于1L稀硝酸中恰好完全反应,放出NO气体后称量所得溶液,发现比原溶液质量增加8克,则原溶液中硝酸的浓度是( )
A 0.4mol/L B 0.6mol/L
C 0.8mol/L D 1.0mol/LC将Fe粉、Cu粉、FeCl3溶液、 FeCl2溶液、 CuCl2溶液混合于某容器中充分反应,试判断下列情况下溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有________________
(2)若氯化铁和氯化铜都有剩余,则容器中不可能有______ __一定有________________
(3)若氯化铁有剩余,则容器中不可能有_________________
Fe3+ Cu2+Fe CuFe2+Fe Cu
A.赤铁矿的主要成分是Fe3O4
B.铁在氧气中燃烧生成Fe2O3
C除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D用焦炭还原铁矿石得到的铁是纯铁
CFeFe2+Fe3+Fe3O4 (Fe2+/Fe3+)Cl2、 Br2、 稀HNO3(足量)O2 、H2O(g)I2 、 S 、H+、CuSO4强氧化剂弱氧化剂铁的化学性质:常温,浓硫酸、浓硝酸钝化????3. Fe(OH)3分别与足量的HCl、 HI反应时有什么不同?Fe(OH)3作为一种碱与酸反应生成盐和水,
但Fe3+有较强的氧化性,若与之反应的酸
为还原性酸(如H2S、HI)则再发生氧化还
原反应问题探究如何用简单方法将铝粉和铁粉混合物分开?铁与I2 、 S反应时能否生成FeI3和 Fe2S3?FeO与稀HNO3反应的化学方程式如何写?例1(1)在FeCl2溶液中存在平衡FeCl2+2H2O Fe(OH)2 +2HCl加热时,HCl挥发,平衡右移,生成Fe(OH)2 Fe(OH)2很快氧化成 Fe(OH)3,灼烧后生成Fe2O3弱氧化剂:H+、Cu2+、S、I2、Fe3+等 强氧化剂:Cl2、Br2、热浓H2SO4、HNO3等Fe、Fe2+、Fe3+的相互转化Zn(不足)、Fe、Cu、S2-、I-、SO2Fe、Fe2+、Fe3+的相互转化——“铁三角”关系FeFe3+Fe2+弱氧化剂S、I2、H+、Cu2+、Fe3+Cl2、Br2、O2、浓H2SO4、HNO3
Fe2O3:C、CO、H2、Al
Fe3+:Al、Zn等还原
FeO:C、CO、H2、Al
Fe2+:Al、Zn等还原强氧化剂Cl2、Br2、O2、浓H2SO4、HNO3
酸性KMnO4、Na2O2、H2O2等Fe、Cu、I-、S2-等活学活用答案1nm~100nm
Fe FeS H2SO4
2 Fe 2+ + H2O2 +2H+=2 Fe 3+ +2 H2O
取少量E于试管中,用胶头滴管加入浓氢氧化钠溶液,加热,在试管口放一湿润的红色石蕊试纸,试纸变蓝色,说明有NH4+Fe2+和Fe3+的检验方法一 取少量被检验的溶液,滴加KSCN溶液,无现象,再通入Cl2,若变成血红色溶液,说明有Fe2+方法二 取少量被检验溶液,加入NaOH溶液,产生白色沉淀,沉淀迅速转变成灰绿色,最后变成红褐色,说明有Fe2+方法二: 取少量被检验溶液,加入KSCN溶液,如果溶液变成血红色,说明含有Fe3+方法一:取少量被检验溶液,加入NaOH溶液,如果生成红褐色沉淀,说明含有Fe3+重点注意:
铁和稀硝酸的反应铁粉不足:
Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
n (Fe) :n( HNO3 )= (3∶12)
铁粉过量:
3Fe+8HNO3=3Fe(NO3)2 +2NO ↑ +4H2O
n (Fe) :n( HNO3 )= (3∶8)将14克铁粉溶于1L稀硝酸中恰好完全反应,放出NO气体后称量所得溶液,发现比原溶液质量增加8克,则原溶液中硝酸的浓度是( )
A 0.4mol/L B 0.6mol/L
C 0.8mol/L D 1.0mol/LC将Fe粉、Cu粉、FeCl3溶液、 FeCl2溶液、 CuCl2溶液混合于某容器中充分反应,试判断下列情况下溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有________________
(2)若氯化铁和氯化铜都有剩余,则容器中不可能有______ __一定有________________
(3)若氯化铁有剩余,则容器中不可能有_________________
Fe3+ Cu2+Fe CuFe2+Fe Cu
