水的电离和溶液的酸碱性
图片预览




文档简介
课件10张PPT。 水的电离和溶液的酸碱性一、水的电离H2O + H2O H3O+ + OH-讨论:
纯水的组成微粒有哪些?
作为弱电解质,水的电离平衡受哪些外界因素影响?
温度、离子浓度(H+、OH-)等影响在水中投入金属钠,对水的电离平衡有无影响? 1、水电离特点[讨论]阅读教材P47---P48
思考1:纯水中c(H+)与c(OH-)大小有何关系?
思考2:在25℃下, c(H+) 、 c(OH-)等于多少?
说明水的电离程度如何?
由水电离出的H+、OH-的物质的量相等25℃时,水电离出来的 c(H+) = c(OH-)=10-7mol/L
水是一种极弱的电解质(通常的电流表无法检验其中离子)一、水的电离1、水电离特点Kw=[H+][OH—](1)表达式:KW 叫做水的离子积常数,简称水的离子积。2、水的离子积常数——KW=10-14例.水是一种极弱的电解质,在室温下,平均每n个分子只有1个分子发生电离,则n值是:
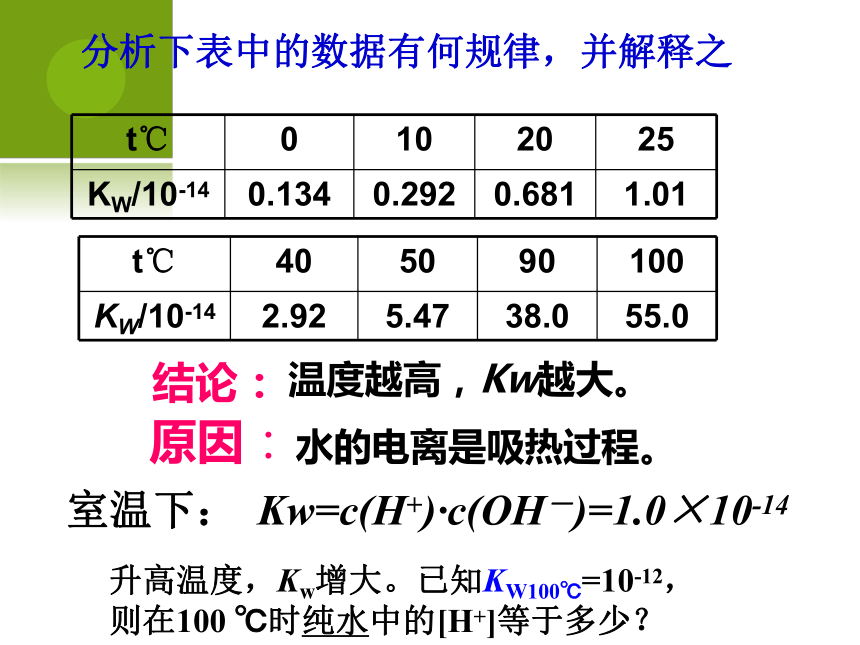
A、10-14 B、55.6×107 C、107 D、55.6温度越高,Kw越大。水的电离是吸热过程。结论:原因:室温下: Kw=c(H+)·c(OH-)=1.0×10-14分析下表中的数据有何规律,并解释之 升高温度,Kw增大。已知KW100℃=10-12,
则在100 ℃时纯水中的[H+]等于多少?思考:含有H+的溶液一定是酸,含OH-的溶液一定是碱吗?
任何酸中只含H+任何碱中只含OH-吗?
结论:
在任何水溶液中,均存在水的电离平衡,也就是任何水溶液中都是H+、OH-共存的。
任何水溶液中都存在Kw=c(H+) . c(OH-)
(Kw 25℃ =10-14 )加少量
盐 酸加 少 量
氢氧化钠纯水c(H+)/mol·L-1c(OH-) /mol·L-11.0×10-7
1.0×10-7
c(H+)>
c(OH-)c(H+)<
c(OH-)>1.0×10-7
>1.0×10-7
<1.0×10-7
<1.0×10-7
水的离子积不仅使用于纯水,也
适用于稀的电解质水溶液酸性中性碱性思考:已知溶液中c(H+),如何求出溶液中c(OH-)? 牛刀小试:1、求0.1mol/L的NaOH溶液中c(H+)和c(OH-)?2、求0.1mol/L的H2SO4溶液中c(H+)和c(OH-)?
由水电离出的c(H+)水和c(OH-)水?3、求0.1mol/L的NaCl溶液中c(H+)和c(OH-)?
由水电离出的c(H+)水和c(OH-)水? (1)纯水在10℃和50℃的H+浓度,前者与后者的关系是( ) . B【课堂练习】(2)下列微粒中不能破坏水的电离平衡的是( ) .
A、H+ B、OH-
C、NO3- D、Na+
CD(3)某温度下纯水中c(H+) = 2×10-7 mol/L,则此时溶液中的c(OH-) = ___________。
若温度不变,滴入稀盐酸使c(H+) = 5×10-6 mol/L,则此时溶液中的c(OH-) = ___________。2×10-7 mol/L8×10-9 mol/L
纯水的组成微粒有哪些?
作为弱电解质,水的电离平衡受哪些外界因素影响?
温度、离子浓度(H+、OH-)等影响在水中投入金属钠,对水的电离平衡有无影响? 1、水电离特点[讨论]阅读教材P47---P48
思考1:纯水中c(H+)与c(OH-)大小有何关系?
思考2:在25℃下, c(H+) 、 c(OH-)等于多少?
说明水的电离程度如何?
由水电离出的H+、OH-的物质的量相等25℃时,水电离出来的 c(H+) = c(OH-)=10-7mol/L
水是一种极弱的电解质(通常的电流表无法检验其中离子)一、水的电离1、水电离特点Kw=[H+][OH—](1)表达式:KW 叫做水的离子积常数,简称水的离子积。2、水的离子积常数——KW=10-14例.水是一种极弱的电解质,在室温下,平均每n个分子只有1个分子发生电离,则n值是:
A、10-14 B、55.6×107 C、107 D、55.6温度越高,Kw越大。水的电离是吸热过程。结论:原因:室温下: Kw=c(H+)·c(OH-)=1.0×10-14分析下表中的数据有何规律,并解释之 升高温度,Kw增大。已知KW100℃=10-12,
则在100 ℃时纯水中的[H+]等于多少?思考:含有H+的溶液一定是酸,含OH-的溶液一定是碱吗?
任何酸中只含H+任何碱中只含OH-吗?
结论:
在任何水溶液中,均存在水的电离平衡,也就是任何水溶液中都是H+、OH-共存的。
任何水溶液中都存在Kw=c(H+) . c(OH-)
(Kw 25℃ =10-14 )加少量
盐 酸加 少 量
氢氧化钠纯水c(H+)/mol·L-1c(OH-) /mol·L-11.0×10-7
1.0×10-7
c(H+)>
c(OH-)c(H+)<
c(OH-)>1.0×10-7
>1.0×10-7
<1.0×10-7
<1.0×10-7
水的离子积不仅使用于纯水,也
适用于稀的电解质水溶液酸性中性碱性思考:已知溶液中c(H+),如何求出溶液中c(OH-)? 牛刀小试:1、求0.1mol/L的NaOH溶液中c(H+)和c(OH-)?2、求0.1mol/L的H2SO4溶液中c(H+)和c(OH-)?
由水电离出的c(H+)水和c(OH-)水?3、求0.1mol/L的NaCl溶液中c(H+)和c(OH-)?
由水电离出的c(H+)水和c(OH-)水? (1)纯水在10℃和50℃的H+浓度,前者与后者的关系是( ) . B【课堂练习】(2)下列微粒中不能破坏水的电离平衡的是( ) .
A、H+ B、OH-
C、NO3- D、Na+
CD(3)某温度下纯水中c(H+) = 2×10-7 mol/L,则此时溶液中的c(OH-) = ___________。
若温度不变,滴入稀盐酸使c(H+) = 5×10-6 mol/L,则此时溶液中的c(OH-) = ___________。2×10-7 mol/L8×10-9 mol/L
