物质的分离和提纯
图片预览








文档简介
课件29张PPT。 物质的分离和提纯分离和提纯有什么不同?分离 把混合物中几种物质分开,每一组分都要保留下来,若原来是固体,最后还是固体提纯 保留混合物中的某一主要组分,把其余杂质通过一定方法都除去不增不减易分不加入新的物质不消耗被提纯的物质
如:不能减少NaCl成分杂质转换为沉淀、气体等易分离除去
如:将NaCl溶液中可能存在的
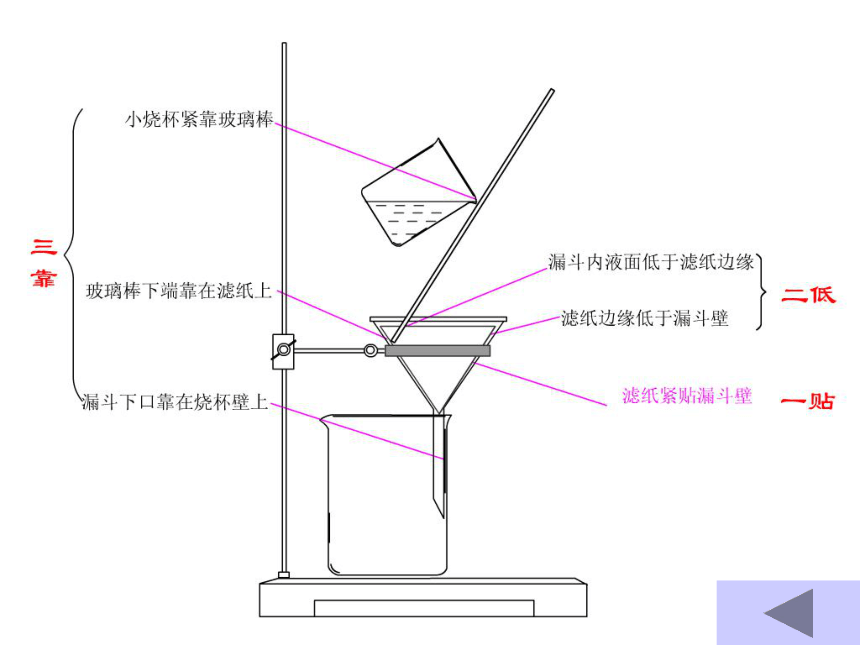
Na2SO4转换为沉淀BaSO4分离提纯思想: 化学方法分离和提纯物质时要 注意八个字“不增、不减、易分、复原” 原理:利用物质的溶解性差异,将液体和不溶于液体的固体分离开来。 1、过滤实验用品:漏斗、滤纸、铁架台(铁圈)、烧杯、玻璃棒。 (图1-13) 注意:一贴、二低、三靠.2、蒸发原理:利用加热的方法,使溶液中溶剂不断挥发的过程。实验用品:
蒸发皿、玻璃棒、酒精灯、铁架台(铁圈) 操作注意事项:1、蒸发皿中的液体不能超过其容积的2/3。3、当出现大量固体时,应停止加热用余热蒸干。 4、不能把热的蒸发皿直接放在实验台上,应垫上石棉网。用于可溶性固体与液体
液——液混合物:3.结晶使溶液过饱和,析出晶体,分离和提纯混合物的一种方法。方法:减少溶剂,降温改变溶解度一种物质的溶解度受温度影响变化较大,而另一种物质溶解度受温度影响变化不大的1、现有KCl和KNO3的固体混合物,请设计实验方案提纯KNO3。
(参考课本图1-11)交流与讨论实验方案:1、溶解:将混合物放入烧杯中,加入100℃的热水,使固体完全溶解。2、降温结晶:将(1)所得溶液放在实验台上自然冷却到不再有固体析出。3、过滤:将(2)所得混合物进行过滤,滤纸上的晶体即为较纯净的KNO3(不用洗涤)4、重结晶:将若需要更纯净的KNO3晶体,可将(3)中所得晶体再结晶「重复(1)-(3)」操作一次。交流与讨论2、已知Mg(OH)2难溶于水,BaSO4既难溶于水又难溶于酸,BaCO3难溶于水,但可溶于盐酸。现有含Na2SO4、MgCl2和泥沙的粗食盐,请设计实验方案,由粗食盐提纯NaCl。溶解过滤(除泥沙等)Na2CO3NaOH(除去过量
的Ba2+)(除去SO42-)(除去Mg2+)BaCl2过滤(除沉淀)稀HCl(除去CO32-和OH-)蒸发2、稍过量BaCl2除去SO42-3、稍过量Na2CO3除去过量的Ba2+4、稍过量的NaOH溶液除去Mg2+5、④所混合物过滤,加入稍过量的稀HCl除去CO32-和 OH-提纯步骤:还可设计为:BaCl2 → NaOH → Na2CO3 → HCl NaOH → BaCl2 → Na2CO3 → HCl关键是Na2CO3在BaCl2之后,而稀HCl必须在最后加。1、过滤除去泥沙等不溶性杂质粗盐提纯的步骤SKCl和KNO3的分离和提纯可以使用结晶的方法由于混合物中KNO3含量较高(90﹪),可首先配制较高温度(100℃)下的KNO3饱和溶液,利用降温结晶的方法,使KNO3晶体在较低温度下析出,此时KCl不析出。练习1、分离下列混合物,按溶解、过滤、蒸发顺序进行的是( )
A、氧化铜、木炭 B、碳酸钙、氯化钠
C、硝酸钾、氯化钠 D、乙醇、水B2、实验室里用氯酸钾和二氧化锰制取氧气,请问
如何把反应后剩下的物质分离开?先溶解,然后过滤,最后蒸发4.萃取——利用溶质在不同溶剂里溶解度的不同,用一种溶剂把溶质从原来溶液中提取出来的方法 溴易溶于CCl4,溴难溶于H2O,所以CCl4可以把溴从
溴和H2O组成的溶液中萃取出来萃取剂选择条件:
1、萃取剂与原溶剂不混溶、不反应
2、溶质在萃取剂中有较大的溶解度
3、溶质不与萃取剂发生任何反应5.分液分液是把两种不相溶的液体(却密度不同)分开的操作;注意点:(1)将要萃取的溶液和萃取溶剂依次从上口倒入分液漏斗,其量不能超过漏斗容积的2/3,塞好塞子进行振荡.
(2)振荡时右手捏住漏斗上口的颈部,并用食指根部压紧塞子,以左手握住旋塞,同时用手指控制活塞,将漏斗倒转过来振荡.
(3)然后将分液漏斗静置,待液体分层后进行分液,分液时下层液体从漏斗口放出,上层液体从上口倒出. ——利用各组分沸点不同,将液态混合物
分离和提纯的方法液t体加热至沸点,汽化,将蒸气冷凝为液体的操作过程6.蒸馏投放沸石或瓷片温度计水银球处于支管口处水,下入上出操作注意:
1、先通水,再加热
2、刚开始收集到的馏分
应弃去
3、全程严格控制好温度酒精和水的混合物能否用蒸馏分离?先蒸馏出来的是什么?用蒸馏原理进行多种混合液体的分离,叫分馏 溶液体积不超过烧瓶体积2/37.层析:据混合物中各物质被吸附性能的不同,把它们溶解在某溶剂中,以层析的方法进行分离 过滤蒸发
结晶 不溶性固体与液体的分离漏斗、滤纸、烧杯、玻璃棒铁架台(铁圈)除去粗食盐中的泥沙等不溶性杂质可溶性固体与液体的分离蒸发皿、玻璃棒、酒精灯蒸发食盐溶液制得固体食盐溶解度随温度变化较大的可溶性固体的分离烧杯、玻璃棒、酒精灯KNO3与KCl的分离降温
结晶萃取分液蒸馏分馏层析互不相溶的两种液体混合物的分离沸点不同的液体混合物的分离溶解在溶剂的混合物分离烧杯、分液漏斗,玻璃棒用CCl4提取溴水中的溴;石油的分馏、酒精与水的分离(加生石灰后蒸馏)分离墨水中的混合物蒸馏烧瓶、酒精灯、温度计、冷凝管、石棉网、接液管、锥形瓶层析液,烧杯,层析纸小结 3. 用于分离或提纯物质的已学方法有:
A.萃取 B.分液 C.过滤
D.加热分解 E.蒸发 F.蒸馏
下列各组混合物的分离或提纯应选用上述哪种方法最合
适?(把选用方法的标号填入括号内)
(1)除去Ca(OH)2溶液中悬浮的Ca(OH)2 颗粒( )
(2)把饱和食盐水中的食盐提取出来( )
(3)除去酒精中溶解的微量食盐( )
(4)把溴水中的溴提取出来 ( )
(5)用自来水制取医用蒸馏水 ( )
(6)除去氧化钙中的碳酸钙 ( )
(7)分离柴油和水的混合物 ( )BDACEFF练习4、现有三组溶液(1)汽油和氯化钠溶液
(2)酒精和水的混合溶液
(3)氯化钠和单质溴的溶液
以上混合溶液分离的正确方法依次是( )
A、分液、萃取、蒸馏 B、萃取、蒸馏、分液
C、分液、蒸馏、萃取 D、蒸馏、萃取、分液C阅读下列材料,按要求回答问题:
酒精、苯、CCl4、煤油都是有机溶剂,有机溶剂之间大
都能互溶;碘(I2)难溶于水,易溶于有机溶剂,其溶液呈
紫色;溴(液溴)的性质与碘相似,其溶液呈橙色。
1、下列能用分离漏斗分离的是( )
A、液溴和CCl4 B、酒精和煤油
C、CaCl2和Na2SO4溶液 D、苯和蒸馏水 D2、在酒精、苯、CCl4、NaCl溶液、蒸馏水五种试剂中,
(1)能把碘单质从碘水中萃取出来的是( ),进行分液之后是否已经得到纯净的碘单质?
苯,CCl4(2)能把溴从溴水中萃取出来,并在分液时溴从分液漏斗上端
倒出的是( );萃取时,上层液体呈( )色,
下层液体呈( )色.苯橙无或颜色变浅练习3、CCl4能把碘酒中的碘萃取出来么?不能,还要进一步分离不能,酒精与CCl4混溶
如:不能减少NaCl成分杂质转换为沉淀、气体等易分离除去
如:将NaCl溶液中可能存在的
Na2SO4转换为沉淀BaSO4分离提纯思想: 化学方法分离和提纯物质时要 注意八个字“不增、不减、易分、复原” 原理:利用物质的溶解性差异,将液体和不溶于液体的固体分离开来。 1、过滤实验用品:漏斗、滤纸、铁架台(铁圈)、烧杯、玻璃棒。 (图1-13) 注意:一贴、二低、三靠.2、蒸发原理:利用加热的方法,使溶液中溶剂不断挥发的过程。实验用品:
蒸发皿、玻璃棒、酒精灯、铁架台(铁圈) 操作注意事项:1、蒸发皿中的液体不能超过其容积的2/3。3、当出现大量固体时,应停止加热用余热蒸干。 4、不能把热的蒸发皿直接放在实验台上,应垫上石棉网。用于可溶性固体与液体
液——液混合物:3.结晶使溶液过饱和,析出晶体,分离和提纯混合物的一种方法。方法:减少溶剂,降温改变溶解度一种物质的溶解度受温度影响变化较大,而另一种物质溶解度受温度影响变化不大的1、现有KCl和KNO3的固体混合物,请设计实验方案提纯KNO3。
(参考课本图1-11)交流与讨论实验方案:1、溶解:将混合物放入烧杯中,加入100℃的热水,使固体完全溶解。2、降温结晶:将(1)所得溶液放在实验台上自然冷却到不再有固体析出。3、过滤:将(2)所得混合物进行过滤,滤纸上的晶体即为较纯净的KNO3(不用洗涤)4、重结晶:将若需要更纯净的KNO3晶体,可将(3)中所得晶体再结晶「重复(1)-(3)」操作一次。交流与讨论2、已知Mg(OH)2难溶于水,BaSO4既难溶于水又难溶于酸,BaCO3难溶于水,但可溶于盐酸。现有含Na2SO4、MgCl2和泥沙的粗食盐,请设计实验方案,由粗食盐提纯NaCl。溶解过滤(除泥沙等)Na2CO3NaOH(除去过量
的Ba2+)(除去SO42-)(除去Mg2+)BaCl2过滤(除沉淀)稀HCl(除去CO32-和OH-)蒸发2、稍过量BaCl2除去SO42-3、稍过量Na2CO3除去过量的Ba2+4、稍过量的NaOH溶液除去Mg2+5、④所混合物过滤,加入稍过量的稀HCl除去CO32-和 OH-提纯步骤:还可设计为:BaCl2 → NaOH → Na2CO3 → HCl NaOH → BaCl2 → Na2CO3 → HCl关键是Na2CO3在BaCl2之后,而稀HCl必须在最后加。1、过滤除去泥沙等不溶性杂质粗盐提纯的步骤SKCl和KNO3的分离和提纯可以使用结晶的方法由于混合物中KNO3含量较高(90﹪),可首先配制较高温度(100℃)下的KNO3饱和溶液,利用降温结晶的方法,使KNO3晶体在较低温度下析出,此时KCl不析出。练习1、分离下列混合物,按溶解、过滤、蒸发顺序进行的是( )
A、氧化铜、木炭 B、碳酸钙、氯化钠
C、硝酸钾、氯化钠 D、乙醇、水B2、实验室里用氯酸钾和二氧化锰制取氧气,请问
如何把反应后剩下的物质分离开?先溶解,然后过滤,最后蒸发4.萃取——利用溶质在不同溶剂里溶解度的不同,用一种溶剂把溶质从原来溶液中提取出来的方法 溴易溶于CCl4,溴难溶于H2O,所以CCl4可以把溴从
溴和H2O组成的溶液中萃取出来萃取剂选择条件:
1、萃取剂与原溶剂不混溶、不反应
2、溶质在萃取剂中有较大的溶解度
3、溶质不与萃取剂发生任何反应5.分液分液是把两种不相溶的液体(却密度不同)分开的操作;注意点:(1)将要萃取的溶液和萃取溶剂依次从上口倒入分液漏斗,其量不能超过漏斗容积的2/3,塞好塞子进行振荡.
(2)振荡时右手捏住漏斗上口的颈部,并用食指根部压紧塞子,以左手握住旋塞,同时用手指控制活塞,将漏斗倒转过来振荡.
(3)然后将分液漏斗静置,待液体分层后进行分液,分液时下层液体从漏斗口放出,上层液体从上口倒出. ——利用各组分沸点不同,将液态混合物
分离和提纯的方法液t体加热至沸点,汽化,将蒸气冷凝为液体的操作过程6.蒸馏投放沸石或瓷片温度计水银球处于支管口处水,下入上出操作注意:
1、先通水,再加热
2、刚开始收集到的馏分
应弃去
3、全程严格控制好温度酒精和水的混合物能否用蒸馏分离?先蒸馏出来的是什么?用蒸馏原理进行多种混合液体的分离,叫分馏 溶液体积不超过烧瓶体积2/37.层析:据混合物中各物质被吸附性能的不同,把它们溶解在某溶剂中,以层析的方法进行分离 过滤蒸发
结晶 不溶性固体与液体的分离漏斗、滤纸、烧杯、玻璃棒铁架台(铁圈)除去粗食盐中的泥沙等不溶性杂质可溶性固体与液体的分离蒸发皿、玻璃棒、酒精灯蒸发食盐溶液制得固体食盐溶解度随温度变化较大的可溶性固体的分离烧杯、玻璃棒、酒精灯KNO3与KCl的分离降温
结晶萃取分液蒸馏分馏层析互不相溶的两种液体混合物的分离沸点不同的液体混合物的分离溶解在溶剂的混合物分离烧杯、分液漏斗,玻璃棒用CCl4提取溴水中的溴;石油的分馏、酒精与水的分离(加生石灰后蒸馏)分离墨水中的混合物蒸馏烧瓶、酒精灯、温度计、冷凝管、石棉网、接液管、锥形瓶层析液,烧杯,层析纸小结 3. 用于分离或提纯物质的已学方法有:
A.萃取 B.分液 C.过滤
D.加热分解 E.蒸发 F.蒸馏
下列各组混合物的分离或提纯应选用上述哪种方法最合
适?(把选用方法的标号填入括号内)
(1)除去Ca(OH)2溶液中悬浮的Ca(OH)2 颗粒( )
(2)把饱和食盐水中的食盐提取出来( )
(3)除去酒精中溶解的微量食盐( )
(4)把溴水中的溴提取出来 ( )
(5)用自来水制取医用蒸馏水 ( )
(6)除去氧化钙中的碳酸钙 ( )
(7)分离柴油和水的混合物 ( )BDACEFF练习4、现有三组溶液(1)汽油和氯化钠溶液
(2)酒精和水的混合溶液
(3)氯化钠和单质溴的溶液
以上混合溶液分离的正确方法依次是( )
A、分液、萃取、蒸馏 B、萃取、蒸馏、分液
C、分液、蒸馏、萃取 D、蒸馏、萃取、分液C阅读下列材料,按要求回答问题:
酒精、苯、CCl4、煤油都是有机溶剂,有机溶剂之间大
都能互溶;碘(I2)难溶于水,易溶于有机溶剂,其溶液呈
紫色;溴(液溴)的性质与碘相似,其溶液呈橙色。
1、下列能用分离漏斗分离的是( )
A、液溴和CCl4 B、酒精和煤油
C、CaCl2和Na2SO4溶液 D、苯和蒸馏水 D2、在酒精、苯、CCl4、NaCl溶液、蒸馏水五种试剂中,
(1)能把碘单质从碘水中萃取出来的是( ),进行分液之后是否已经得到纯净的碘单质?
苯,CCl4(2)能把溴从溴水中萃取出来,并在分液时溴从分液漏斗上端
倒出的是( );萃取时,上层液体呈( )色,
下层液体呈( )色.苯橙无或颜色变浅练习3、CCl4能把碘酒中的碘萃取出来么?不能,还要进一步分离不能,酒精与CCl4混溶
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
