化学:10.1《测定1mol气体的体积》教案(2)(沪科版高二第一学期)
文档属性
| 名称 | 化学:10.1《测定1mol气体的体积》教案(2)(沪科版高二第一学期) |
|
|
| 格式 | rar | ||
| 文件大小 | 29.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-11-19 00:00:00 | ||
图片预览


文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
测定1mol气体的体积
1.实验原理
师:同学们测定1mol气体的体积,我们需要哪些实验数据?
生:气体的体积和气体的物质的量。
师:气体的物质的量能用实验方法直接测定吗?
生:不能。气体的物质的量=质量/摩尔质量
可以测气体的质量。
师: Vm = V / n = V M / m
气体的体积和质量的实验数据较难测定,因此我们将其转化为其他状态的物质进行测定。
以1mol H2体积测定为例,用镁跟足量的稀硫酸反应,并测定其摩尔体积。
Mg + H2SO4 = MgSO4 + H2
Vm = V H2 / n = V H2 M H2 / m H2 = V H2 MMg / mMg
通过数据转化,测定镁带的质量
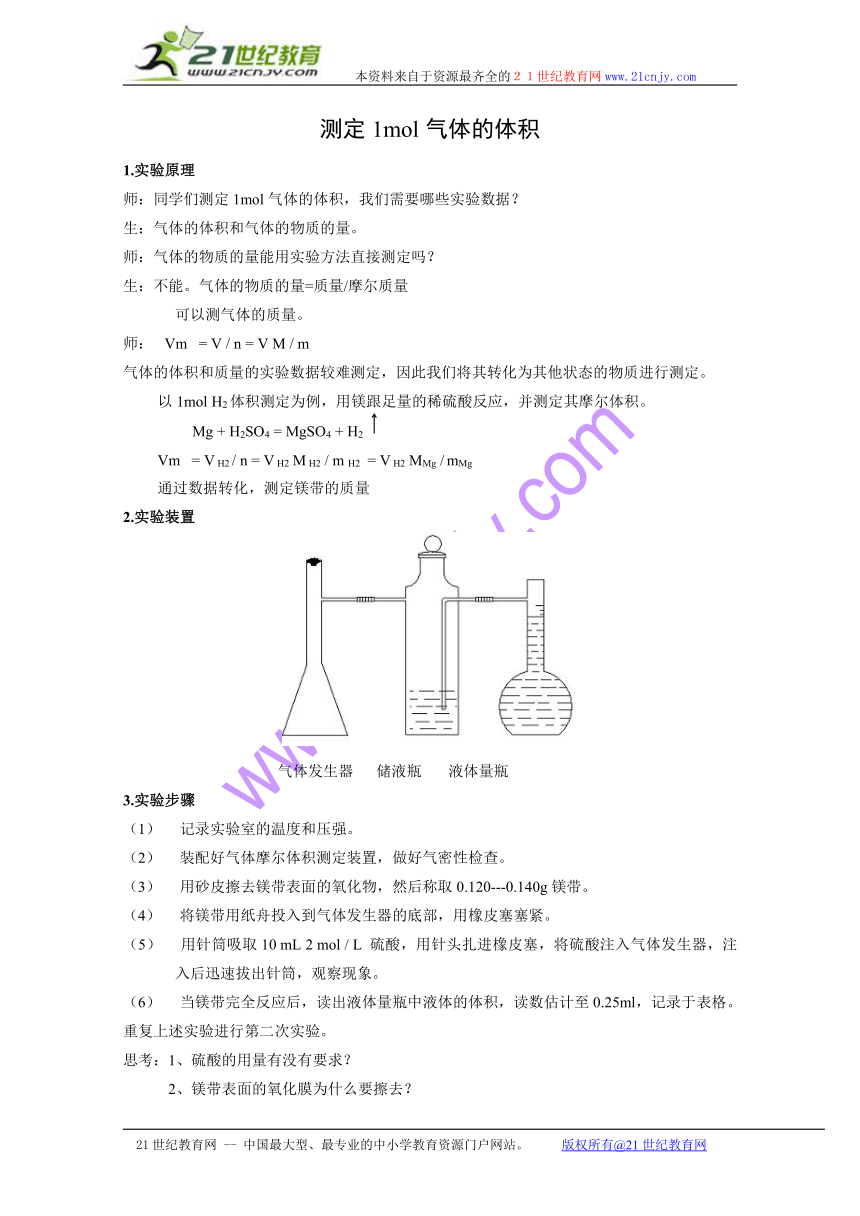
2.实验装置
气体发生器 储液瓶 液体量瓶
3.实验步骤
(1) 记录实验室的温度和压强。
(2) 装配好气体摩尔体积测定装置,做好气密性检查。
(3) 用砂皮擦去镁带表面的氧化物,然后称取0.120---0.140g镁带。
(4) 将镁带用纸舟投入到气体发生器的底部,用橡皮塞塞紧。
(5) 用针筒吸取10 mL 2 mol / L 硫酸,用针头扎进橡皮塞,将硫酸注入气体发生器,注入后迅速拔出针筒,观察现象。
(6) 当镁带完全反应后,读出液体量瓶中液体的体积,读数估计至0.25ml,记录于表格。
重复上述实验进行第二次实验。
思考:1、硫酸的用量有没有要求?
2、镁带表面的氧化膜为什么要擦去?
3、液体量瓶的刻度范围是多少?液体量瓶的刻度范围对镁带的质量有没有要求?大约在什么范围内?
4、液体量瓶的体积读数是否就是H2的体积?如果不是,应如何换算?
5、装置漏气可以吗?怎样检查装置气密性?
生:学生通过对问题的思考与讨论对实验有较深入的思考和理解。
学生反馈:
(1) 老师讲的较清楚,我们对实验有了较全面的认识。
(2) 没意思,老师讲,我们一直在听。
(3) 我们希望实验课能让我们自己动手去尝试。
教师反思:
这节课基本达到了教学目标,学生对实验的原理和实验过程有了较全面的认识。但在教学过程中学生不动脑筋,发言不积极,课堂气氛不活跃。这种传统的实验教学方法在一定程度上抑制了学生的积极性、主动性、创造性,不利于学生的发展。
二、跟进课
师:同学们测定1mol气体的体积,我们需要哪些实验数据?
生:气体的体积和气体的物质的量。
师:气体的物质的量能用实验方法直接测定吗?
生:不能。气体的物质的量=质量/摩尔质量
可以测气体的质量。
师: Vm = V / n = V M / m
气体的体积和质量的实验数据较难测定,我们是否能将其转化为其他状态的物质进行测定?
生:液态或固态的量好测。
课题:以1mol H2体积测定为例,用镁跟足量的稀硫酸反应制得H2,并测定其摩尔体积。
Mg + H2SO4 = MgSO4 + H2
Vm = V H2 / n = V H2 M H2 / m H2 = V H2 MMg / mMg
通过数据转化,测定镁带的质量和氢气的体积。
师:请根据刚才的讨论试设计出实验方案。
生:小组讨论。
讨论结果分析:
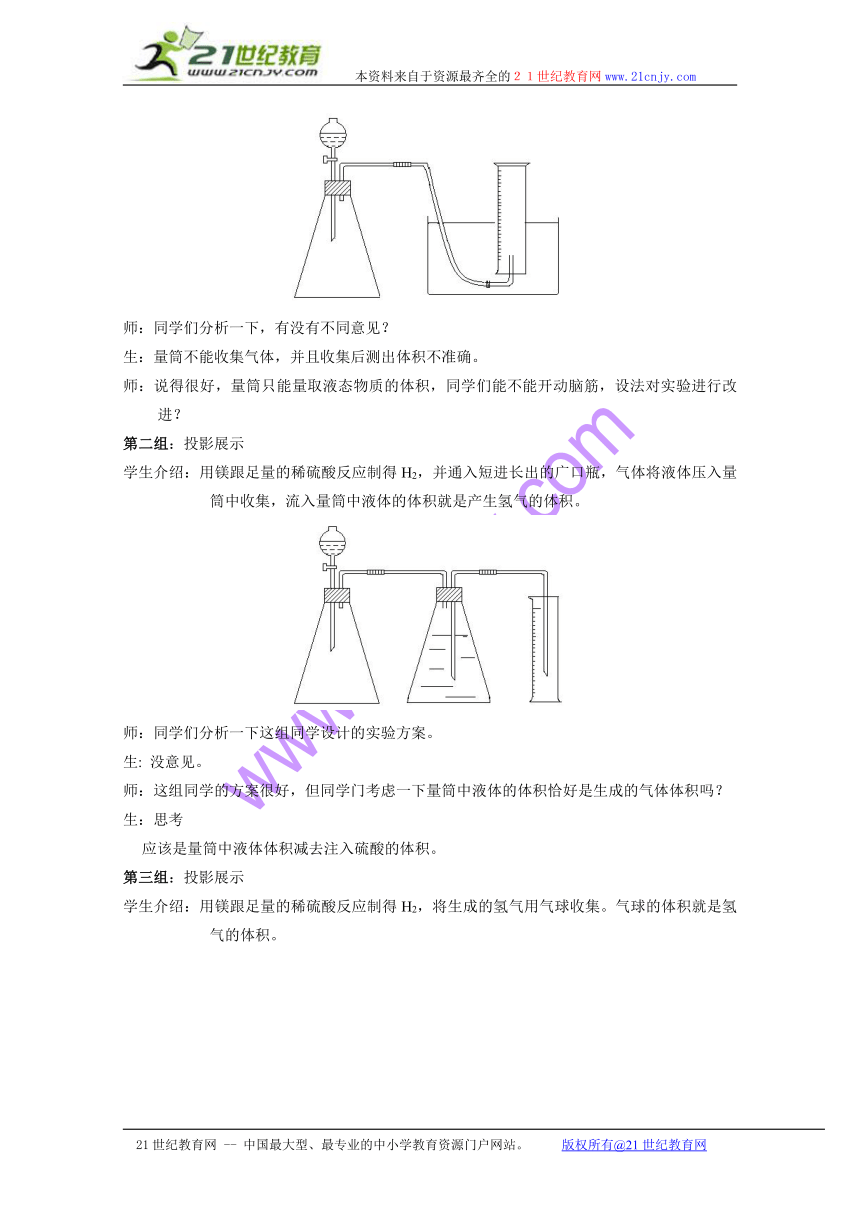
第一组:投影展示
学生介绍:用镁跟足量的稀硫酸反应制得H2,利用排水法用量筒收集,并量取气体体积。
师:同学们分析一下,有没有不同意见?
生:量筒不能收集气体,并且收集后测出体积不准确。
师:说得很好,量筒只能量取液态物质的体积,同学们能不能开动脑筋,设法对实验进行改进?
第二组:投影展示
学生介绍:用镁跟足量的稀硫酸反应制得H2,并通入短进长出的广口瓶,气体将液体压入量筒中收集,流入量筒中液体的体积就是产生氢气的体积。
师:同学们分析一下这组同学设计的实验方案。
生: 没意见。
师:这组同学的方案很好,但同学门考虑一下量筒中液体的体积恰好是生成的气体体积吗?
生:思考
应该是量筒中液体体积减去注入硫酸的体积。
第三组:投影展示
学生介绍:用镁跟足量的稀硫酸反应制得H2,将生成的氢气用气球收集。气球的体积就是氢气的体积。
师:同学们分析一下这组同学设计的实验方案。
生:你怎样知道气球的体积?并且氢气的体积等于气球体积减去注入硫酸的体积。
生:(讨论)将气球压入盛满水的水槽中,溢出水的体积就是气球的体积。
师:大家的想法非常好,这也是个好办法。但由于气球的张力较大,实验误差较大。还有其他方法吗?
第四组:投影展示
学生介绍:用镁跟足量的稀硫酸反应制得H2,将生成的氢气用针筒收集。针筒显示的体积减去注入硫酸的体积就是氢气的体积。
师:同学们分析一下这组同学设计的实验方案。
生:(讨论)(崇拜的目光)这种方法很好,可以直接量出气体体积。
师:这组同学的设计很有新意,非常好。
总结讨论:
师:1、在实验过程中我们称镁带的质量,并用镁带的质量进行计算,对加入的硫酸有什么要求吗?
生: 硫酸应足量,使镁带完全反应。
师:2、刚才我们分析过,气体的体积在测量时应减掉注入稀硫酸的体积,你如何知道稀硫酸的体积呢?
生: 在加入分液漏斗前用量筒量取。
师:3、无论是用量筒还是用针筒测气体体积,它们都有固定的最大体积,所以大家在设计实验时还应考虑什么问题?
生:反应生成气体体积不能超过所测的最大体积。
师:大家说得非常好。我们一起来看一下书中所给装置
气体发生器 储液瓶 液体量瓶
师:大家看这套装置和同学们设计的哪一套装置类似?
生:第二组。
师:用针筒取硫酸,注入到气体发生器中与镁反应,产生的氢气将储液瓶中的品红溶液压入液体量瓶中。根据刚才的讨论,请同学们分析这套装置在使用过程中应注意哪些问题?
生:交流讨论
(1)我们注意到液体量瓶的读数范围是110—130mL,所以对生成的氢气的量有限制,过多或过少都测不出。
(2)硫酸应过量,保证钠全部反应。
(3)装置不能漏气,保证其气密性,应先检漏。
(4)生成氢气的体积应是液体量瓶的读数减去注入硫酸的体积
师:大家分析得很好。
如果取稀硫酸10mL,且过量。假设标准状况下,金属镁的质量应控制在什么范围内?
生:思考讨论
假设液体量瓶最大读数130mL,氢气体积130-10=120mL,消耗镁的质量(120 /22400)×24=0.1286g.
假设液体量瓶最小读数110mL,氢气体积110-10=100mL,消耗镁的质量(100 /22400)×24=0.1071g.
所以镁的质量控制在0.1071—0.1286g之间。
师:大家的分析很好。H2的体积与温度有关,由于现在的温度较高所以镁的质量控制在0.120—0.140g之间。
师:经过同学们的讨论,我们知道了测定一摩尔气体体积的方法。下一节课我们进入实验室,亲手去做这个实验。
学生反馈:
(1)这节课很有意思,我们分成组,在讨论过程中,大家集思广益,互相补充,最后通过互相讨论解决问题。
(2)我们不仅想按照书中的装置做实验,而且也想有机会用自己设计的实验装置做实验。
教师反思:
(1) 这节课课堂气氛非常好,学生们发言非常踊跃
(2) 在学生的分组讨论过程中,学生增强了协作意识,增强了集体荣誉感
(3) 给学生提供了一个展示自我的舞台,开动了学生的脑筋,激发了学生的想象力和创造力。
对照分析:
原型课是传统的实验教学方法,在教学过程中,教师完全主宰着课堂,教师是表演者,而学生是听众,有点“照方抓药”的感觉。虽然在课堂上学生可以对实验有较全面的理解,但在教学过程中,没有体现学生的主体地位,学生过于被动,没有给学生太多的思考空间,不利于学生的能力培养和思维的发展。而跟进课完全打破了传统的化学实验教学模式,给学生提供了更广阔的思维发展空间,课堂成为了学生展示自我的舞台,学生是主角,而教师只是一个服务者。学生在实验方案设计过程中,想出了很多方案,尤其是第四组同学的方案我事先也没有考虑到,说明如果给学生一定的思维空间,学生完全有能力解决问题,并且在解决问题的过程中,逐步建立起正确的分析和解决问题的逻辑思维方法,有利于增强学生的自信心和集体荣誉感,更有利于培养学生的创新能力。
结束语:
辅导学生进行实验设计,让学生体会实验的基本设计方法,可以开发学生的潜能,激发学生学习化学的兴趣。还有助于培养学生的创新思维和变通能力,从而提高化学教学质量,更有利于学生的长远发展。当然,这只是我对二期课改中化学实验教学的一点看法,并在自己的教学过程中作以尝试和实施,其中如有不妥之处敬请各位老师指正。www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
测定1mol气体的体积
1.实验原理
师:同学们测定1mol气体的体积,我们需要哪些实验数据?
生:气体的体积和气体的物质的量。
师:气体的物质的量能用实验方法直接测定吗?
生:不能。气体的物质的量=质量/摩尔质量
可以测气体的质量。
师: Vm = V / n = V M / m
气体的体积和质量的实验数据较难测定,因此我们将其转化为其他状态的物质进行测定。
以1mol H2体积测定为例,用镁跟足量的稀硫酸反应,并测定其摩尔体积。
Mg + H2SO4 = MgSO4 + H2
Vm = V H2 / n = V H2 M H2 / m H2 = V H2 MMg / mMg
通过数据转化,测定镁带的质量
2.实验装置
气体发生器 储液瓶 液体量瓶
3.实验步骤
(1) 记录实验室的温度和压强。
(2) 装配好气体摩尔体积测定装置,做好气密性检查。
(3) 用砂皮擦去镁带表面的氧化物,然后称取0.120---0.140g镁带。
(4) 将镁带用纸舟投入到气体发生器的底部,用橡皮塞塞紧。
(5) 用针筒吸取10 mL 2 mol / L 硫酸,用针头扎进橡皮塞,将硫酸注入气体发生器,注入后迅速拔出针筒,观察现象。
(6) 当镁带完全反应后,读出液体量瓶中液体的体积,读数估计至0.25ml,记录于表格。
重复上述实验进行第二次实验。
思考:1、硫酸的用量有没有要求?
2、镁带表面的氧化膜为什么要擦去?
3、液体量瓶的刻度范围是多少?液体量瓶的刻度范围对镁带的质量有没有要求?大约在什么范围内?
4、液体量瓶的体积读数是否就是H2的体积?如果不是,应如何换算?
5、装置漏气可以吗?怎样检查装置气密性?
生:学生通过对问题的思考与讨论对实验有较深入的思考和理解。
学生反馈:
(1) 老师讲的较清楚,我们对实验有了较全面的认识。
(2) 没意思,老师讲,我们一直在听。
(3) 我们希望实验课能让我们自己动手去尝试。
教师反思:
这节课基本达到了教学目标,学生对实验的原理和实验过程有了较全面的认识。但在教学过程中学生不动脑筋,发言不积极,课堂气氛不活跃。这种传统的实验教学方法在一定程度上抑制了学生的积极性、主动性、创造性,不利于学生的发展。
二、跟进课
师:同学们测定1mol气体的体积,我们需要哪些实验数据?
生:气体的体积和气体的物质的量。
师:气体的物质的量能用实验方法直接测定吗?
生:不能。气体的物质的量=质量/摩尔质量
可以测气体的质量。
师: Vm = V / n = V M / m
气体的体积和质量的实验数据较难测定,我们是否能将其转化为其他状态的物质进行测定?
生:液态或固态的量好测。
课题:以1mol H2体积测定为例,用镁跟足量的稀硫酸反应制得H2,并测定其摩尔体积。
Mg + H2SO4 = MgSO4 + H2
Vm = V H2 / n = V H2 M H2 / m H2 = V H2 MMg / mMg
通过数据转化,测定镁带的质量和氢气的体积。
师:请根据刚才的讨论试设计出实验方案。
生:小组讨论。
讨论结果分析:
第一组:投影展示
学生介绍:用镁跟足量的稀硫酸反应制得H2,利用排水法用量筒收集,并量取气体体积。
师:同学们分析一下,有没有不同意见?
生:量筒不能收集气体,并且收集后测出体积不准确。
师:说得很好,量筒只能量取液态物质的体积,同学们能不能开动脑筋,设法对实验进行改进?
第二组:投影展示
学生介绍:用镁跟足量的稀硫酸反应制得H2,并通入短进长出的广口瓶,气体将液体压入量筒中收集,流入量筒中液体的体积就是产生氢气的体积。
师:同学们分析一下这组同学设计的实验方案。
生: 没意见。
师:这组同学的方案很好,但同学门考虑一下量筒中液体的体积恰好是生成的气体体积吗?
生:思考
应该是量筒中液体体积减去注入硫酸的体积。
第三组:投影展示
学生介绍:用镁跟足量的稀硫酸反应制得H2,将生成的氢气用气球收集。气球的体积就是氢气的体积。
师:同学们分析一下这组同学设计的实验方案。
生:你怎样知道气球的体积?并且氢气的体积等于气球体积减去注入硫酸的体积。
生:(讨论)将气球压入盛满水的水槽中,溢出水的体积就是气球的体积。
师:大家的想法非常好,这也是个好办法。但由于气球的张力较大,实验误差较大。还有其他方法吗?
第四组:投影展示
学生介绍:用镁跟足量的稀硫酸反应制得H2,将生成的氢气用针筒收集。针筒显示的体积减去注入硫酸的体积就是氢气的体积。
师:同学们分析一下这组同学设计的实验方案。
生:(讨论)(崇拜的目光)这种方法很好,可以直接量出气体体积。
师:这组同学的设计很有新意,非常好。
总结讨论:
师:1、在实验过程中我们称镁带的质量,并用镁带的质量进行计算,对加入的硫酸有什么要求吗?
生: 硫酸应足量,使镁带完全反应。
师:2、刚才我们分析过,气体的体积在测量时应减掉注入稀硫酸的体积,你如何知道稀硫酸的体积呢?
生: 在加入分液漏斗前用量筒量取。
师:3、无论是用量筒还是用针筒测气体体积,它们都有固定的最大体积,所以大家在设计实验时还应考虑什么问题?
生:反应生成气体体积不能超过所测的最大体积。
师:大家说得非常好。我们一起来看一下书中所给装置
气体发生器 储液瓶 液体量瓶
师:大家看这套装置和同学们设计的哪一套装置类似?
生:第二组。
师:用针筒取硫酸,注入到气体发生器中与镁反应,产生的氢气将储液瓶中的品红溶液压入液体量瓶中。根据刚才的讨论,请同学们分析这套装置在使用过程中应注意哪些问题?
生:交流讨论
(1)我们注意到液体量瓶的读数范围是110—130mL,所以对生成的氢气的量有限制,过多或过少都测不出。
(2)硫酸应过量,保证钠全部反应。
(3)装置不能漏气,保证其气密性,应先检漏。
(4)生成氢气的体积应是液体量瓶的读数减去注入硫酸的体积
师:大家分析得很好。
如果取稀硫酸10mL,且过量。假设标准状况下,金属镁的质量应控制在什么范围内?
生:思考讨论
假设液体量瓶最大读数130mL,氢气体积130-10=120mL,消耗镁的质量(120 /22400)×24=0.1286g.
假设液体量瓶最小读数110mL,氢气体积110-10=100mL,消耗镁的质量(100 /22400)×24=0.1071g.
所以镁的质量控制在0.1071—0.1286g之间。
师:大家的分析很好。H2的体积与温度有关,由于现在的温度较高所以镁的质量控制在0.120—0.140g之间。
师:经过同学们的讨论,我们知道了测定一摩尔气体体积的方法。下一节课我们进入实验室,亲手去做这个实验。
学生反馈:
(1)这节课很有意思,我们分成组,在讨论过程中,大家集思广益,互相补充,最后通过互相讨论解决问题。
(2)我们不仅想按照书中的装置做实验,而且也想有机会用自己设计的实验装置做实验。
教师反思:
(1) 这节课课堂气氛非常好,学生们发言非常踊跃
(2) 在学生的分组讨论过程中,学生增强了协作意识,增强了集体荣誉感
(3) 给学生提供了一个展示自我的舞台,开动了学生的脑筋,激发了学生的想象力和创造力。
对照分析:
原型课是传统的实验教学方法,在教学过程中,教师完全主宰着课堂,教师是表演者,而学生是听众,有点“照方抓药”的感觉。虽然在课堂上学生可以对实验有较全面的理解,但在教学过程中,没有体现学生的主体地位,学生过于被动,没有给学生太多的思考空间,不利于学生的能力培养和思维的发展。而跟进课完全打破了传统的化学实验教学模式,给学生提供了更广阔的思维发展空间,课堂成为了学生展示自我的舞台,学生是主角,而教师只是一个服务者。学生在实验方案设计过程中,想出了很多方案,尤其是第四组同学的方案我事先也没有考虑到,说明如果给学生一定的思维空间,学生完全有能力解决问题,并且在解决问题的过程中,逐步建立起正确的分析和解决问题的逻辑思维方法,有利于增强学生的自信心和集体荣誉感,更有利于培养学生的创新能力。
结束语:
辅导学生进行实验设计,让学生体会实验的基本设计方法,可以开发学生的潜能,激发学生学习化学的兴趣。还有助于培养学生的创新思维和变通能力,从而提高化学教学质量,更有利于学生的长远发展。当然,这只是我对二期课改中化学实验教学的一点看法,并在自己的教学过程中作以尝试和实施,其中如有不妥之处敬请各位老师指正。www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
