金属的化学性质-Na
图片预览

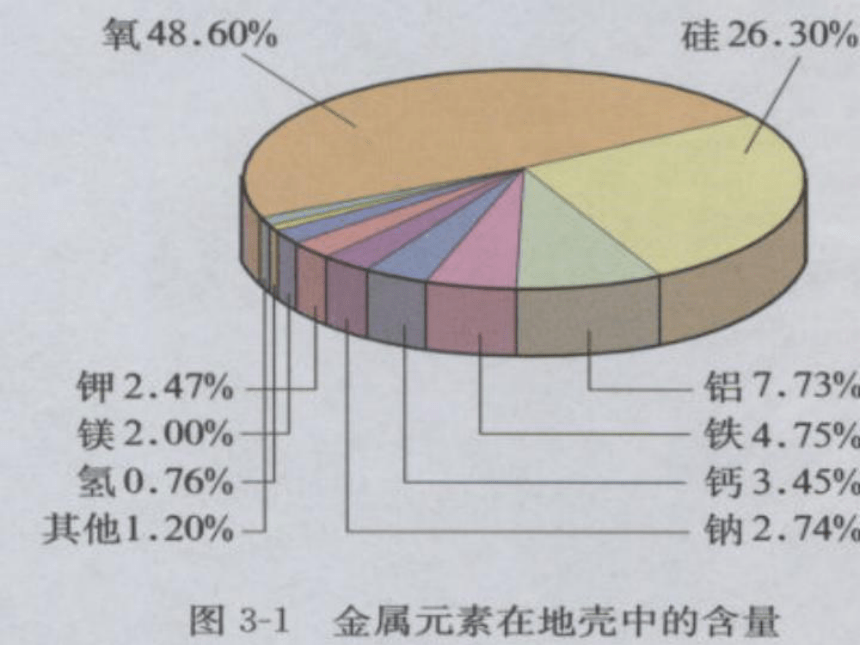







文档简介
课件27张PPT。 第一节 金属的化学性质
(第一课时)
第一节 金属的化学性质有金属光泽 导电 导热性
良好的 延展性和机械加工性.易失电子,具有还原性.金 属 的 通 性物理:化学:一、金属与非金属的反应1.Na原子结构示意图
一 、金属与氧气的反应1.钠的物理性质具有金属光泽的银白色金属;
质软;
密度比水小,比煤油大;
熔点比水的沸点低;
是电和热的良导体.现象: 切开的光亮的金属断面
很快地变暗。反应:4Na + O2 = 2Na2O (常温下) 结论:★常温下易与空气中的氧气反应2.钠与氧气的反应现象: 钠在空气中燃烧,发出黄
色的火焰,生成淡黄色固体。反应:2Na + O2 === Na2O2 思考:Na2O2 稳定Na2O和Na2O2 哪个稳定?过氧化钠 点燃注意:Na与O2反应条件的不同,产物不同。金属与非金属的反应4Al+3O2 =
3Fe+2O2 =
2Mg+O2 =
2Na+S =
2Na+Cl2 =点燃点燃点燃点燃点燃△△点燃△△1.钠为什么会浮在水面上?
2、为什么烧杯上方出现水蒸气?
3.钠为什么会熔化成一个小球?
4.小球为什么会在水面上游动?
5、小球为什么会咝咝发出响声?
6.滴入酚酞后溶液为什么会变色?
浮在水面上——密度小于水;
水蒸气——放热;
熔化成一个小球——溶点低;
在水面上游动——生成气体;
咝咝发出响声——反应剧烈;
变色——生成碱。
化学方程式:
回答:2Na+2H2O=2NaOH+H2↑
化学方程式3Fe+4H2O(g)==== Fe3O4+4H2 ↑
△2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑? Al与强碱溶液反应化学方程式:铝的特殊性:既能跟酸反应产生H2,又能跟强碱溶液反应产生H2。五、铝与氢氧化钠溶液的反应现象:Al片放入盐酸、NaOH溶液中都有气泡产生,点燃气体观察到蓝色火焰。化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑△△点燃△△钠 的 用 途结构性质用途决定反应存在、保存制法1.钠与水反应时产生的各种现象如下:
①钠浮在水面上;②钠沉在水底;③钠熔化成小球;④小球迅速游动逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。其中正确的一组是( )
A.①②③④⑤ B.全部 C.①②③⑤⑥D.①③④⑤⑥
2.取一小块金属钠,放在燃烧匙里加热,下列实验现象正确的描述是( )
①金属先熔化;②在空气中燃烧,放出黄色火花;③燃烧后得白色固体;④燃烧时火焰为黄色;⑤燃烧后生成浅黄色固体物质
A.①② B.①②③ C.①④⑤ D.④⑤
DC 3.相同质量的钠在下列情况下产生氢气最多的( )
A.放在足量水中 B.放在足量盐酸中
C.放在足量CuSO4溶液中
D.用刺有小孔的铝,包好放入足量水底中
4.将一小块金属钠久置于空气中,有下列现象:①生成白色粉末;②变暗;③生成白色固体;④发生潮解变为液体,这些现象的先后顺序是( )
A.①②③④ B.④③②①
C.②③④① D.①③④②DC 向一金属铝的易拉罐内充满CO2,然后向罐内注入足量NaOH溶液,立即用胶布严封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起,解释上述变化的实验现象: (1)罐壁内凹而瘪的原因:?????????????????????? 反应方程式: ?????????????????????????????
(2)罐壁重新鼓起的原因:??????????????????????????? 反应方程式: ?????????????????????????????
解答:??
动动脑? (1)是因为CO2与NaOH反应生成Na2CO3,使得罐内气压小于外界大气压; ?? (2)是因为过量的NaOH与铝罐反应生成H2,使罐内气压等于或大于外界大气压;钠的氧化物供氧剂 、漂白剂 用途2Na2O2+4HCl=4NaCl+2H2O+O2↑Na2O+2HCl=2NaCl+H2O与酸反应2Na2O2+2CO2=Na2CO3+O2↑Na2O+CO2=Na2CO3与CO2反应过氧化物(不属碱性氧化物)碱性氧化物类别过氧化钠氧化钠名称燃烧或加热时与O2反应常温与O2反应生成条件2Na2O2+2H2O=4NaOH+O2↑Na2O+H2O=2NaOH与水反应淡黄色固体白色固体颜色状态Na2O2(O为-1价)Na2O(O为-2价)化学式
(第一课时)
第一节 金属的化学性质有金属光泽 导电 导热性
良好的 延展性和机械加工性.易失电子,具有还原性.金 属 的 通 性物理:化学:一、金属与非金属的反应1.Na原子结构示意图
一 、金属与氧气的反应1.钠的物理性质具有金属光泽的银白色金属;
质软;
密度比水小,比煤油大;
熔点比水的沸点低;
是电和热的良导体.现象: 切开的光亮的金属断面
很快地变暗。反应:4Na + O2 = 2Na2O (常温下) 结论:★常温下易与空气中的氧气反应2.钠与氧气的反应现象: 钠在空气中燃烧,发出黄
色的火焰,生成淡黄色固体。反应:2Na + O2 === Na2O2 思考:Na2O2 稳定Na2O和Na2O2 哪个稳定?过氧化钠 点燃注意:Na与O2反应条件的不同,产物不同。金属与非金属的反应4Al+3O2 =
3Fe+2O2 =
2Mg+O2 =
2Na+S =
2Na+Cl2 =点燃点燃点燃点燃点燃△△点燃△△1.钠为什么会浮在水面上?
2、为什么烧杯上方出现水蒸气?
3.钠为什么会熔化成一个小球?
4.小球为什么会在水面上游动?
5、小球为什么会咝咝发出响声?
6.滴入酚酞后溶液为什么会变色?
浮在水面上——密度小于水;
水蒸气——放热;
熔化成一个小球——溶点低;
在水面上游动——生成气体;
咝咝发出响声——反应剧烈;
变色——生成碱。
化学方程式:
回答:2Na+2H2O=2NaOH+H2↑
化学方程式3Fe+4H2O(g)==== Fe3O4+4H2 ↑
△2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑? Al与强碱溶液反应化学方程式:铝的特殊性:既能跟酸反应产生H2,又能跟强碱溶液反应产生H2。五、铝与氢氧化钠溶液的反应现象:Al片放入盐酸、NaOH溶液中都有气泡产生,点燃气体观察到蓝色火焰。化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑△△点燃△△钠 的 用 途结构性质用途决定反应存在、保存制法1.钠与水反应时产生的各种现象如下:
①钠浮在水面上;②钠沉在水底;③钠熔化成小球;④小球迅速游动逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。其中正确的一组是( )
A.①②③④⑤ B.全部 C.①②③⑤⑥D.①③④⑤⑥
2.取一小块金属钠,放在燃烧匙里加热,下列实验现象正确的描述是( )
①金属先熔化;②在空气中燃烧,放出黄色火花;③燃烧后得白色固体;④燃烧时火焰为黄色;⑤燃烧后生成浅黄色固体物质
A.①② B.①②③ C.①④⑤ D.④⑤
DC 3.相同质量的钠在下列情况下产生氢气最多的( )
A.放在足量水中 B.放在足量盐酸中
C.放在足量CuSO4溶液中
D.用刺有小孔的铝,包好放入足量水底中
4.将一小块金属钠久置于空气中,有下列现象:①生成白色粉末;②变暗;③生成白色固体;④发生潮解变为液体,这些现象的先后顺序是( )
A.①②③④ B.④③②①
C.②③④① D.①③④②DC 向一金属铝的易拉罐内充满CO2,然后向罐内注入足量NaOH溶液,立即用胶布严封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起,解释上述变化的实验现象: (1)罐壁内凹而瘪的原因:?????????????????????? 反应方程式: ?????????????????????????????
(2)罐壁重新鼓起的原因:??????????????????????????? 反应方程式: ?????????????????????????????
解答:??
动动脑? (1)是因为CO2与NaOH反应生成Na2CO3,使得罐内气压小于外界大气压; ?? (2)是因为过量的NaOH与铝罐反应生成H2,使罐内气压等于或大于外界大气压;钠的氧化物供氧剂 、漂白剂 用途2Na2O2+4HCl=4NaCl+2H2O+O2↑Na2O+2HCl=2NaCl+H2O与酸反应2Na2O2+2CO2=Na2CO3+O2↑Na2O+CO2=Na2CO3与CO2反应过氧化物(不属碱性氧化物)碱性氧化物类别过氧化钠氧化钠名称燃烧或加热时与O2反应常温与O2反应生成条件2Na2O2+2H2O=4NaOH+O2↑Na2O+H2O=2NaOH与水反应淡黄色固体白色固体颜色状态Na2O2(O为-1价)Na2O(O为-2价)化学式
