海水“制碱“
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
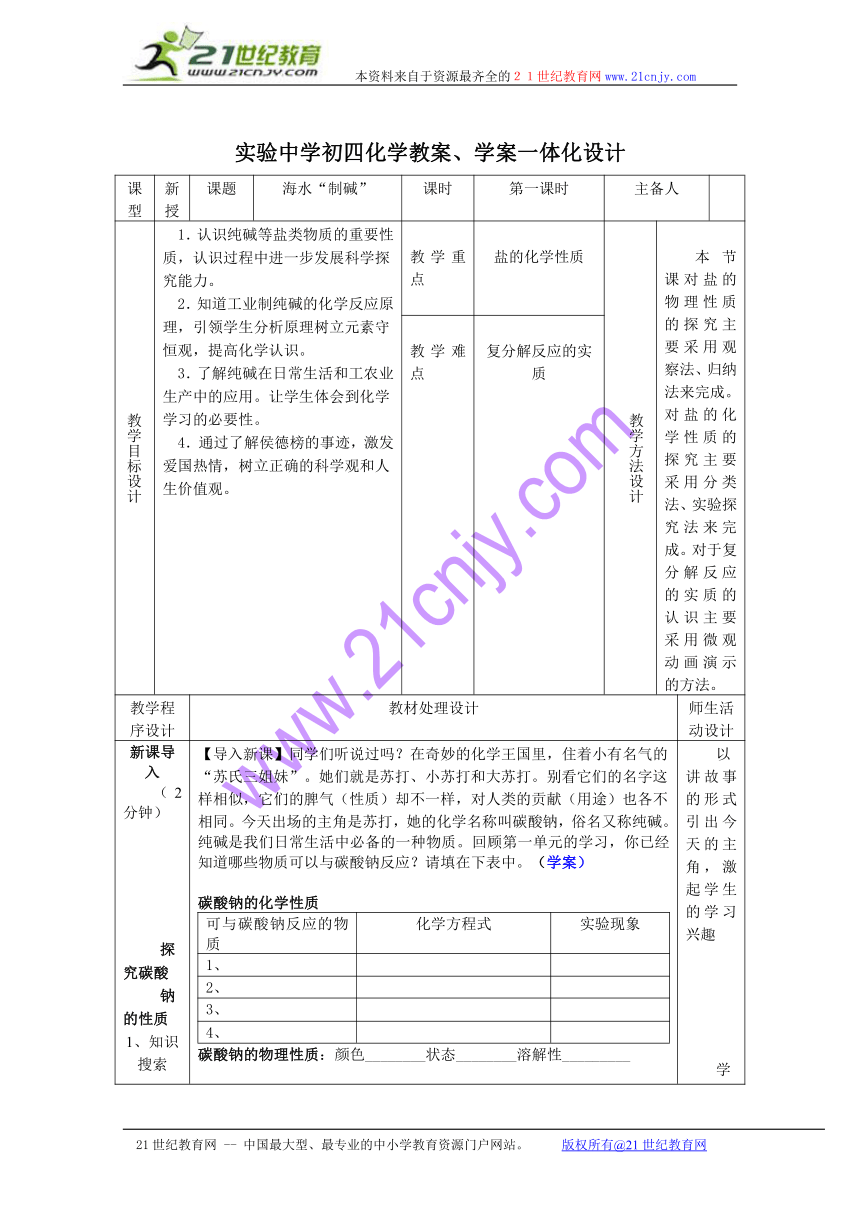
实验中学初四化学教案、学案一体化设计
课型 新授 课题 海水“制碱” 课时 第一课时 主备人
教学目标设计 1.认识纯碱等盐类物质的重要性质,认识过程中进一步发展科学探究能力。2.知道工业制纯碱的化学反应原理,引领学生分析原理树立元素守恒观,提高化学认识。3.了解纯碱在日常生活和工农业生产中的应用。让学生体会到化学学习的必要性。4.通过了解侯德榜的事迹,激发爱国热情,树立正确的科学观和人生价值观。 教学重点 盐的化学性质 教学方法设计 本节课对盐的物理性质的探究主要采用观察法、归纳法来完成。对盐的化学性质的探究主要采用分类法、实验探究法来完成。对于复分解反应的实质的认识主要采用微观动画演示的方法。
教学难点 复分解反应的实质
教学程序设计 教材处理设计 师生活动设计
供选择的仪器、药品:
试管、滴管、药匙、 碳酸钠固体、氯化钡溶液、酚酞试液、蒸馏水
1、与指示剂的作用
取少量碳酸钠固体于试管中,加蒸馏水振荡,观察溶解情况。再滴入2~3滴酚酞试液,观察现象
2、与氯化钡溶液反应
小明家厨房里有两种白色固体,标签已经被腐蚀了,奶奶分不清到底哪瓶是纯碱,哪瓶是食盐了?快来帮帮她!
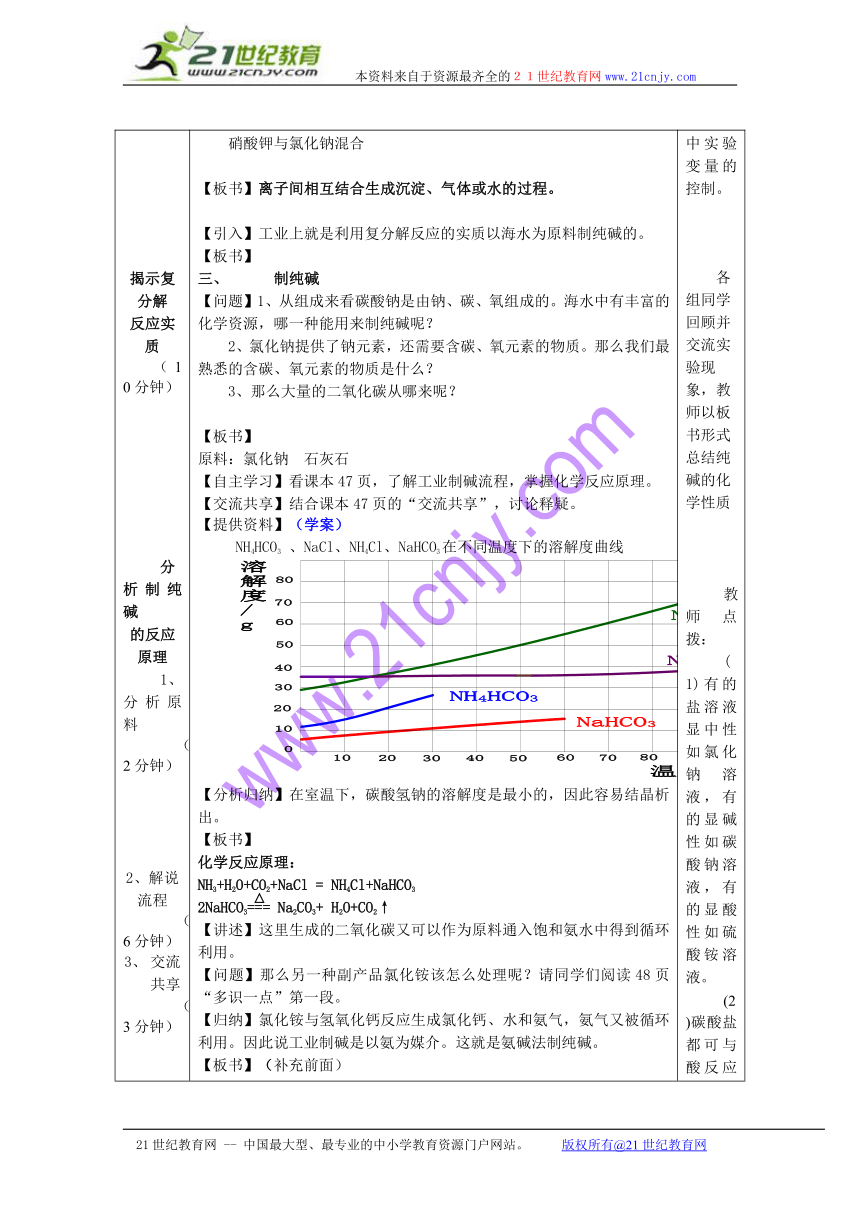
2、纯碱用于洗涤油污,利用的是它哪一点性质?3、妈妈蒸馒头时发酵的面团有酸味,往往要加一点纯碱,这是为什么呢?【设问过渡】是不是所有的酸、碱、盐之间都能发生复分解反应,比如氯化钠与硝酸钾?回顾前面学过的中和反应,它的微观本质是氢离子与氢氧根离子结合生成水。那么这两个反应的实质是什么呢?【板书】二、复分解反应的实质【动画演示】(屏幕展示)碳酸钠与盐酸混合碳酸钠与氢氧化钙混合硝酸钾与氯化钠混合【板书】离子间相互结合生成沉淀、气体或水的过程。【引入】工业上就是利用复分解反应的实质以海水为原料制纯碱的。【板书】三、 制纯碱【问题】1、从组成来看碳酸钠是由钠、碳、氧组成的。海水中有丰富的化学资源,哪一种能用来制纯碱呢?2、氯化钠提供了钠元素,还需要含碳、氧元素的物质。那么我们最熟悉的含碳、氧元素的物质是什么?3、那么大量的二氧化碳从哪来呢?【板书】原料:氯化钠 石灰石【自主学习】看课本47页,了解工业制碱流程,掌握化学反应原理。【交流共享】结合课本47页的“交流共享”,讨论释疑。【提供资料】(学案)NH4HCO3 、NaCl、NH4Cl、NaHCO3在不同温度下的溶解度曲线【分析归纳】在室温下,碳酸氢钠的溶解度是最小的,因此容易结晶析出。【板书】化学反应原理:NH3+H2O+CO2+NaCl = NH4Cl+NaHCO32NaHCO3=== Na2CO3+ H2O+CO2↑【讲述】这里生成的二氧化碳又可以作为原料通入饱和氨水中得到循环利用。【问题】那么另一种副产品氯化铵该怎么处理呢?请同学们阅读48页“多识一点”第一段。【归纳】氯化铵与氢氧化钙反应生成氯化钙、水和氨气,氨气又被循环利用。因此说工业制碱是以氨为媒介。这就是氨碱法制纯碱。【板书】(补充前面)三、氨碱法制纯碱【引入】但是随着制碱工业的发展,人们发现生成的氯化钙越来越多,无法处理,造成了严重的环境污染。我国著名制碱专家侯德榜对此做了大胆探索,成功的解决了这一难题。【自主学习】(学案)请同学们自学课本48页,并完成下列问题:氨碱法制纯碱的优点是:原料经济易得,________可循环利用,能连续生产。回收氨的反应方程式_____________________________________。侯氏制碱法的优点是向滤出碳酸氢钠晶体后的氯化铵溶液中加入_______,使其中的氯化铵单独结晶析出,用作氮肥,_________则可循环使用。碳酸氢钠俗称__________,又称____________,通常是______晶体,_______于水。它有很多用途,在医疗上是治疗胃酸过多的一种药剂,其反应原理是__________________。它受热易分解生成碳酸钠、水和二氧化碳,因此在食品工业上是发酵粉的一种主要成分,其反应原理是__________________________。【挑战自我】课本P51 以讲故事的形式引出今天的主角,激起学生的学习兴趣学生据已有知识及生活经验对纯碱的性质进行初步的判断,既贴合实际,又激起了学生好奇心与求知欲。学生交流、归纳,教师协助整理。明确探究要求,鼓励学生仔细观察现象,认真填表,填写实验记录。强调实验过程中实验变量的控制。各组同学回顾并交流实验现象,教师以板书形式总结纯碱的化学性质教师点拨:(1)有的盐溶液显中性如氯化钠溶液,有的显碱性如碳酸钠溶液,有的显酸性如硫酸铵溶液。(2)碳酸盐都可与酸反应产生二氧化碳气体。但检验碳酸根离子时光看到有气泡产生还不能证明,必须检验该气体是不是二氧化碳。因此所需试剂是酸和石灰水。引导学生仔细观察,找出异同,进而认识复分解反应的微观本质。学生思考回答通过推理,形成元素守恒观。通过分析,从复分解反应实质的角度认识工业制纯碱的化学反应原理。进而体验到化学就在我们身边。教师点拔:氨水显碱性,二氧化碳溶于水生成碳酸,二者发生中和反应。会使溶液吸收二氧化碳的能力增强,有利于生成更多的NaHCO3。教师点拨:碳酸氢钠、碳酸钠的热稳定性不同。碳酸氢钠受热易分解。了解我国制碱历史,激发学生的爱国热情。
板书设计 海水“制碱”一、化学性质1、Na2CO3+2HCl=2NaCl+H2O+CO2↑2、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH3、显碱性4、与盐反应Na2CO3+ Ba Cl2=BaCO3↓+2NaCl二、复分解反应的实质离子间相互结合生成沉淀、气体或水的过程。三、氨碱法制纯碱原料:氯化钠 石灰石化学反应原理:NH3+H2O+CO2+NaCl = NH4Cl+NaHCO32NaHCO3=== Na2CO3+ H2O+CO2↑ 课后反思
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
实验中学初四化学教案、学案一体化设计
课型 新授 课题 海水“制碱” 课时 第一课时 主备人
教学目标设计 1.认识纯碱等盐类物质的重要性质,认识过程中进一步发展科学探究能力。2.知道工业制纯碱的化学反应原理,引领学生分析原理树立元素守恒观,提高化学认识。3.了解纯碱在日常生活和工农业生产中的应用。让学生体会到化学学习的必要性。4.通过了解侯德榜的事迹,激发爱国热情,树立正确的科学观和人生价值观。 教学重点 盐的化学性质 教学方法设计 本节课对盐的物理性质的探究主要采用观察法、归纳法来完成。对盐的化学性质的探究主要采用分类法、实验探究法来完成。对于复分解反应的实质的认识主要采用微观动画演示的方法。
教学难点 复分解反应的实质
教学程序设计 教材处理设计 师生活动设计
供选择的仪器、药品:
试管、滴管、药匙、 碳酸钠固体、氯化钡溶液、酚酞试液、蒸馏水
1、与指示剂的作用
取少量碳酸钠固体于试管中,加蒸馏水振荡,观察溶解情况。再滴入2~3滴酚酞试液,观察现象
2、与氯化钡溶液反应
小明家厨房里有两种白色固体,标签已经被腐蚀了,奶奶分不清到底哪瓶是纯碱,哪瓶是食盐了?快来帮帮她!
2、纯碱用于洗涤油污,利用的是它哪一点性质?3、妈妈蒸馒头时发酵的面团有酸味,往往要加一点纯碱,这是为什么呢?【设问过渡】是不是所有的酸、碱、盐之间都能发生复分解反应,比如氯化钠与硝酸钾?回顾前面学过的中和反应,它的微观本质是氢离子与氢氧根离子结合生成水。那么这两个反应的实质是什么呢?【板书】二、复分解反应的实质【动画演示】(屏幕展示)碳酸钠与盐酸混合碳酸钠与氢氧化钙混合硝酸钾与氯化钠混合【板书】离子间相互结合生成沉淀、气体或水的过程。【引入】工业上就是利用复分解反应的实质以海水为原料制纯碱的。【板书】三、 制纯碱【问题】1、从组成来看碳酸钠是由钠、碳、氧组成的。海水中有丰富的化学资源,哪一种能用来制纯碱呢?2、氯化钠提供了钠元素,还需要含碳、氧元素的物质。那么我们最熟悉的含碳、氧元素的物质是什么?3、那么大量的二氧化碳从哪来呢?【板书】原料:氯化钠 石灰石【自主学习】看课本47页,了解工业制碱流程,掌握化学反应原理。【交流共享】结合课本47页的“交流共享”,讨论释疑。【提供资料】(学案)NH4HCO3 、NaCl、NH4Cl、NaHCO3在不同温度下的溶解度曲线【分析归纳】在室温下,碳酸氢钠的溶解度是最小的,因此容易结晶析出。【板书】化学反应原理:NH3+H2O+CO2+NaCl = NH4Cl+NaHCO32NaHCO3=== Na2CO3+ H2O+CO2↑【讲述】这里生成的二氧化碳又可以作为原料通入饱和氨水中得到循环利用。【问题】那么另一种副产品氯化铵该怎么处理呢?请同学们阅读48页“多识一点”第一段。【归纳】氯化铵与氢氧化钙反应生成氯化钙、水和氨气,氨气又被循环利用。因此说工业制碱是以氨为媒介。这就是氨碱法制纯碱。【板书】(补充前面)三、氨碱法制纯碱【引入】但是随着制碱工业的发展,人们发现生成的氯化钙越来越多,无法处理,造成了严重的环境污染。我国著名制碱专家侯德榜对此做了大胆探索,成功的解决了这一难题。【自主学习】(学案)请同学们自学课本48页,并完成下列问题:氨碱法制纯碱的优点是:原料经济易得,________可循环利用,能连续生产。回收氨的反应方程式_____________________________________。侯氏制碱法的优点是向滤出碳酸氢钠晶体后的氯化铵溶液中加入_______,使其中的氯化铵单独结晶析出,用作氮肥,_________则可循环使用。碳酸氢钠俗称__________,又称____________,通常是______晶体,_______于水。它有很多用途,在医疗上是治疗胃酸过多的一种药剂,其反应原理是__________________。它受热易分解生成碳酸钠、水和二氧化碳,因此在食品工业上是发酵粉的一种主要成分,其反应原理是__________________________。【挑战自我】课本P51 以讲故事的形式引出今天的主角,激起学生的学习兴趣学生据已有知识及生活经验对纯碱的性质进行初步的判断,既贴合实际,又激起了学生好奇心与求知欲。学生交流、归纳,教师协助整理。明确探究要求,鼓励学生仔细观察现象,认真填表,填写实验记录。强调实验过程中实验变量的控制。各组同学回顾并交流实验现象,教师以板书形式总结纯碱的化学性质教师点拨:(1)有的盐溶液显中性如氯化钠溶液,有的显碱性如碳酸钠溶液,有的显酸性如硫酸铵溶液。(2)碳酸盐都可与酸反应产生二氧化碳气体。但检验碳酸根离子时光看到有气泡产生还不能证明,必须检验该气体是不是二氧化碳。因此所需试剂是酸和石灰水。引导学生仔细观察,找出异同,进而认识复分解反应的微观本质。学生思考回答通过推理,形成元素守恒观。通过分析,从复分解反应实质的角度认识工业制纯碱的化学反应原理。进而体验到化学就在我们身边。教师点拔:氨水显碱性,二氧化碳溶于水生成碳酸,二者发生中和反应。会使溶液吸收二氧化碳的能力增强,有利于生成更多的NaHCO3。教师点拨:碳酸氢钠、碳酸钠的热稳定性不同。碳酸氢钠受热易分解。了解我国制碱历史,激发学生的爱国热情。
板书设计 海水“制碱”一、化学性质1、Na2CO3+2HCl=2NaCl+H2O+CO2↑2、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH3、显碱性4、与盐反应Na2CO3+ Ba Cl2=BaCO3↓+2NaCl二、复分解反应的实质离子间相互结合生成沉淀、气体或水的过程。三、氨碱法制纯碱原料:氯化钠 石灰石化学反应原理:NH3+H2O+CO2+NaCl = NH4Cl+NaHCO32NaHCO3=== Na2CO3+ H2O+CO2↑ 课后反思
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
