选修5专题4第二单元醇 酚
图片预览









文档简介
课件40张PPT。专题4 烃的衍生物南靖一中沈建忠第二单元 醇 酚醇(第一课时)QQ:593405459E-mail:sjz608@126.com
工业酒精约含乙醇96%(体积分数),
无水酒精含乙醇99.5%以上
啤酒含酒精3%—5%
葡萄酒含酒精10%—20%,
黄酒含酒精8%—15%,
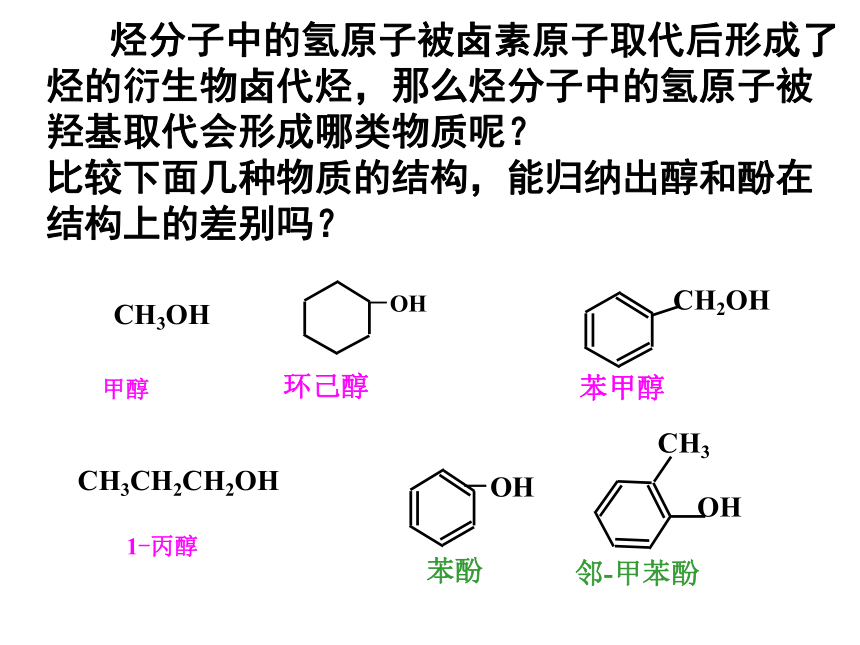
白酒含酒精50%—70% 各 类 酒 精 烃分子中的氢原子被卤素原子取代后形成了烃的衍生物卤代烃,那么烃分子中的氢原子被
羟基取代会形成哪类物质呢?
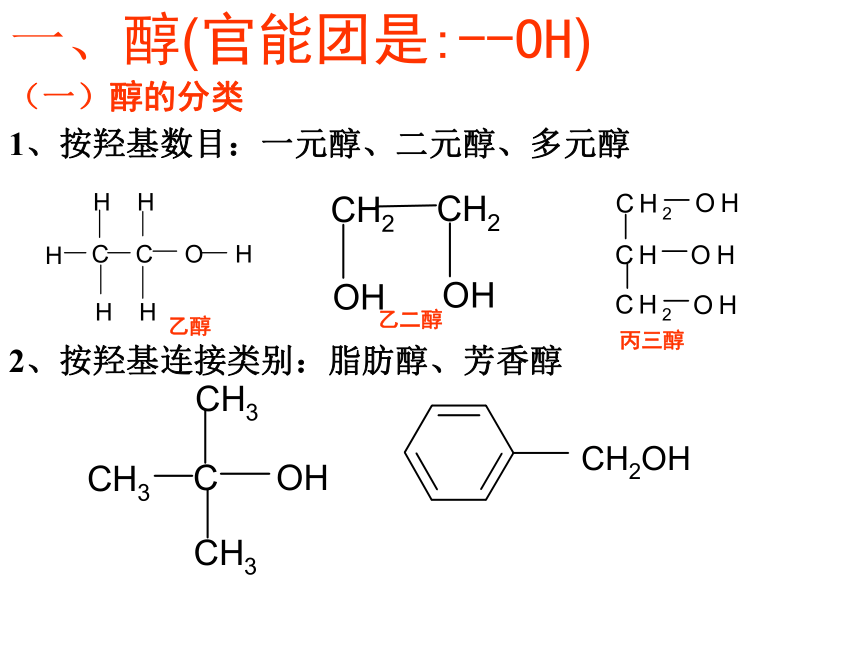
比较下面几种物质的结构,能归纳出醇和酚在 结构上的差别吗?链烃基羟基下列物质中属于醇的是( )√√√醇:烃分子中饱和碳原子上的H原子被羟基取代形成的化合物。苯环羟基酚:分子中羟基与苯环(其它芳环)碳原子直接相连形成的化合物(一)醇的分类1、按羟基数目:一元醇、二元醇、多元醇2、按羟基连接类别:脂肪醇、芳香醇一、醇(官能团是:--OH)乙醇乙二醇丙三醇3、根据OH所连碳原子分:一级醇(伯醇):如R—CH2--OH二级醇(仲醇):如R1—CH—OH—R2三级醇(叔醇):如R2—C—OH——R1R34、按连接链烃基类别:饱和醇、不饱和醇CH2 = CHCH2CH2OH CnH2n+1OH或CnH2n+2O饱和一元醇的通式:(二)、醇的命名①选主链:含有尽可能多羟基的最长的碳链为主链
②编位号:从靠近羟基的这一端开始编号
③其它同烯烃(当羟基与碳碳双键或碳碳叁键相连时易发生异构化)乙醇俗称酒精
跟我们日常生活密切联系最常见的醇是乙醇作燃料 —— 飞机、汽车、火锅、酒精灯等作消毒剂 —— 医用酒精等二、乙醇的用途医疗上常用75%(体积分数)的酒精作消毒剂制酒精型饮料 —— 啤酒、红酒等工业制取乙酸重要的有机化工原料三、乙醇的物理性质和分子结构a.乙醇的物理性质 乙醇(酒精)是无色透明、具有特殊香味的液体,密度比水小,沸点比水低,易挥发,任意比溶于水,能溶解多种无机物和有机物。 b.乙醇的分子结构
??化学式:C2H6O结构简式:CH3CH2OH
或C2H5OH 结构式: 官能团:羟基—OH学生表演烧杯1: 乙醇
烧杯2: 水
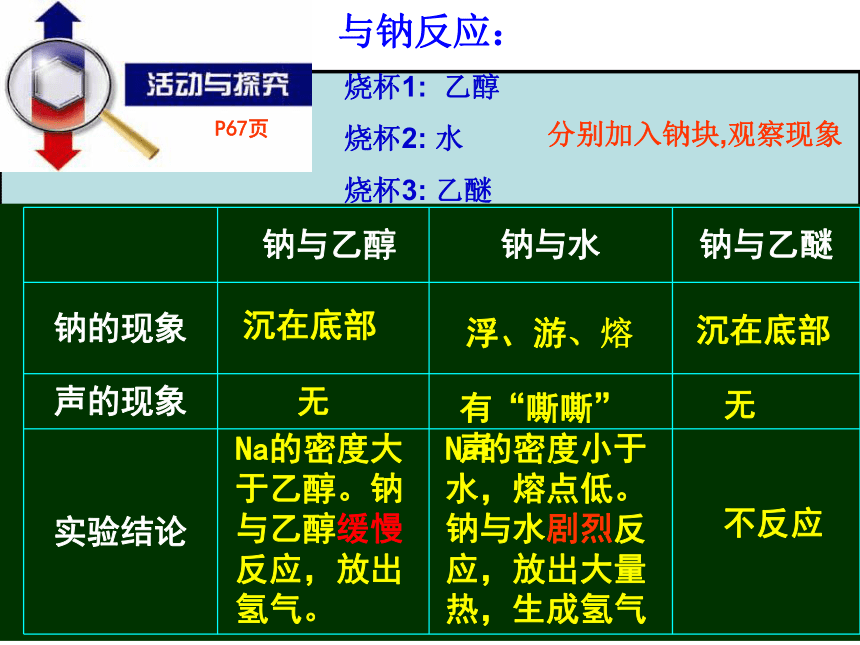
烧杯3: 乙醚分别加入钠块,观察现象与钠反应:浮、游、熔有“嘶嘶”声Na的密度小于水,熔点低。钠与水剧烈反应,放出大量热,生成氢气沉在底部无Na的密度大于乙醇。钠与乙醇缓慢反应,放出氢气。沉在底部无不反应P67页 四、乙醇的化学性质2CH3CH2-OH +2Na →2CH3CH2ONa +H2↑ 1、?乙醇与钠反应现象:缓慢产生气泡,金属钠沉于底部或上下浮动。产物乙醇钠在水中强烈水解CH3CH2-ONa +H2O→CH3CH2OH +NaOH 练习:写出乙醇与K、Ca分别反应的化学方程式 乙醇钠溶液呈碱性,滴入酚酞呈红色结论:H原子的活泼性:水>乙醇>乙醚能否通过此反应测定有机物的羟基数目?能学生表演乙醇与氢卤酸的反应下面的实验可以帮助我们认识乙醇与氢卤酸的反应。
1.组装如图所示装置。在试管I中依次加入2 mL蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3 g 溴化钠粉末,在试管II中注入蒸馏水,烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却,观察并描述实验现象。你怎样证明试管II中收集到是卤代烃?P68页NaOH、HNO3、AgNO3
学生表演【实验原理】2、乙醇与氢卤酸的反应(取代反应)NaBr + H2SO4 = NaHSO4 + HBr R—OH + HXR—X + H2O醇与其它氢卤酸的反应:学生表演下列活动能帮助我们认识乙醇的脱水反应。
完成如图所示实验,在试管中加入2gP2O5并注入4 mL 95%乙醇,给试管加热,将生成的气体经过水洗后,用排水集气法收集。1.研究证实,P2O5在该反应中作催化剂。请根据上述实验和信息,参考前面的探究案例,提出一个合适的探究课题,展开对该反应的研究。请设计探究方案,将你的方案与同学们交流。2.经过探究,你能判断出乙醇所发生的反应是什么类型吗?认识乙醇的脱水反应KOH
溶液酸性高锰酸钾溶液P69页乙醇P2O5吸收H3PO4检验乙烯乙醇等3、消去反应分子间脱水(浓硫酸170 ℃或Al2O3400 ℃或P2O5分子内脱水(浓硫酸常用作脱水剂和
催化剂且常放几片碎石片
以防暴沸)结论: 条件不同,产物不同。总结:
乙醇可以在浓硫酸、Al2O3(400 ℃左右)或P2O5或石棉绒等催化剂的作用
下发生脱水反应即发生消去反应.醇的消去反应和卤代烃的消去是一样的.而有些醇遇到稀硫酸便可脱水,如叔丁醇在20%的硫酸中
只需加热到80 ℃便能生成异丁烯.实验注意事项:
(1)反应温度:170℃; (2)加碎瓷片;
(3)V乙醇∶V浓硫酸 = 1∶3 (4)检查气密性;思考:
1、放入几片碎瓷片作用是什么?
2、浓硫酸的作用是什么?
3、酒精与浓硫酸体积比为何要为1∶3?
4、温度计的位置?
5、为何使液体温度迅速升到170℃?防止暴沸催化剂和脱水剂 因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水乙醇,酒精与浓硫酸体积比以1∶3为宜。 温度计水银球要置于反应物的中央位置,因为需要测量的是反应物的温度。 因为无水乙醇和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。6、混合液颜色如何变化?为什么?
7、有何杂质气体?如何除去?
8、为何教材中使用NaOH溶液进行洗气?要除去什么杂质气体? 烧瓶中的液体逐渐变黑。因为浓硫酸有多种特性。在加热的条件下,无水乙醇和浓硫酸混合物的反应除可生成乙烯等物质以外,浓硫酸还能将无水乙醇氧化生成碳的单质等多种物质,碳的单质使烧瓶内的液体带上了黑色。 由于无水乙醇和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。可将气体通过碱石灰。 因CH3CH2OH、SO2气体能使酸性KMnO4溶液褪色影响乙烯的检验,故必须用NaOH溶液先将其除去。4、氧化反应(1)可燃性现象:发出淡蓝色的火焰,同时放出大量热(内燃机的燃料)(2)催化氧化催化机理思考:铜丝在此实验中起什么作用?红色→黑色黑色→红色总反应方程式:?刺激性气味液体条件:与—OH相连的碳原子上要有H原子的醇才能发生催化氧化 A: 连有羟基的碳原子上有两个氢原子的醇,被氧化后生成醛B: 连有羟基的碳原子上仅有一个氢原子的醇,被氧化后生成酮催化氧化反应(饱和一元醇)+O2(3)被其它氧化剂氧化K2Cr2O7 、 KMnO4 的酸性溶液均可将乙醇氧化 ,利用K2Cr2O7的酸性溶液将乙醇氧化的原理来检验酒后驾车CH3CH2OHCH3CHOCH3COOH学生表演【知识应用】判断是否酒后驾车的方法三氧化铬硫酸铬3CH3CH2OH+2K2Cr2O7+8H2SO4→
3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O
(橙红色)(绿色)催化氧化反应:
a. 酒精中毒机理:
乙醇经过催化酶作用下转化成剧毒物乙醛。
b.乙醇能被酸性KMnO4缓慢氧化成乙醛,进而氧化成乙酸———使KMnO4褪色。应用:工业上将乙醇蒸汽和空气的混合物通过灼热的铜网或银网制乙醛有机物的氧化还原反应
氧化反应:失氢得氧
还原反应:失氧得氢有机物的催化氧化归纳:有机物去氢或加氧是氧化反应有机物加氢或去氧是还原反应即:5.酯化反应:与有机酸或无机含氧酸写出乙醇与硝酸生成硝酸乙酯的方程式。怎样制备无水乙醇CH3CH2-OHCH3CHOCH3COOH[O][O]CH3CH2-ONa乙醇的氧化反应 CH3CH2-BrCH2=CH2CH3CH2-O-CH2CH3乙醇的化学性质小结NaH2OHBrNaOH水溶液浓H2SO4
170℃浓H2SO4
140℃6、乙醇的工业制法?7、醇的化学性质——与乙醇相似学生表演①与活泼金属反应
②催化氧化
③酯化反应
④与氢卤酸反应
⑤分子内脱水(消去)
⑥分子间脱水(取代) 乙 醇官能团 -OH结构:化学性质:反应中乙醇断键位置?乙醇乙醚乙烯淀粉乙酸乙酯乙醛溴乙烷乙醇钠关系网课堂练习:.下列物质中:
(A) (B)
(C) (D)
1)能与氢氧化钠溶液发生反应的是( )
2)能与溴水发生取代反应的是( )
3)能与金属钠发生反应的是( )—OH—CH2OHB、DB、DB、C、D思考 ⑴如何区分乙醇溶液和无水乙醇?取少量酒精,加入无水硫酸铜,
若出现蓝色,则证明是工业酒精.⑵如何实现由乙醇溶液向无水乙醇转化? 乙醇溶液 无水乙醇
(96%) (99.5%) 加CaO生成Ca(OH)2
蒸馏(三)几种重要的醇甲醇(俗称:木醇或木精)
①可燃性无色液体,有类似酒精的气味,沸点:65℃;跟水按任意比例混合。
②有毒,饮用10mL可失明,使用再多可使人中毒死亡。
③优良有机溶剂,也可掺入汽油或柴油中作内燃机燃料
④又名木醇(源于木材干馏可制得) 甲醇的应用 直接甲醇燃料电池
直接甲醇燃料电池是由甲醇负极、氧正极和质子交换膜构成。在催化剂作用下甲醇被氧化为H2O和CO2。甲醇用完后,只要补充甲醇水溶液就可以继续使用了。正极和负极的电极反应分别为:
负极:2CH3OH + 2H2O-12 e-
2CO2+ 12H+
正极:3 O2+12H++12e-6 6H2O
DMFC可以用于笔记本电脑、汽车等。它可以实现污染物的“零排放”。甲醇汽油的应用P 70乙二醇球棍模型物理性质:无色、粘稠、有甜味的液体。沸点:198℃,
熔点:-11.5 ℃。密度:1.109g/cm3。易溶于水和乙醇。
化学性质:与乙醇相似。
用途:常作内燃机的冷冻剂。乙二醇可用于汽车作防冻剂丙三醇球棍模型物理性质:无色、粘稠、有甜味的液体。密度:1.2619g/cm3。
沸点:290 ℃。吸湿性强。能跟水和乙醇任意比混合。
化学性质:与乙醇相似。
用途:制印泥、化妆品,防冻剂,制炸药(消化甘油)。 俗名:甘油丙三醇可用于配制化妆品总结醇:1、醇的分类:醇一元醇多元醇饱和一元醇:不饱和一元醇CnH2n+1OH:如乙二醇、丙三醇等2、同系物的物理性质比较:P.49思考交流表3-2图●●●●●●●●●●●醇烷乙?醇丙?醇醇的沸点远高于烷烃。醇羟基越多沸点越高。氢键氢键数目增多练习1、将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻铜片质量增加的是( )A、硝酸 B、无水乙醇
B、石灰水 D、盐酸解析:
铜片在空气中加热后,会与O2反应生成CuO,从而使铜片质量增加。C练习2:现有下列一元醇可发生消去反应的是( ),其对应的产物是( )
可发生催化氧化的是( ),其对应的产物是( )ABCDEF
工业酒精约含乙醇96%(体积分数),
无水酒精含乙醇99.5%以上
啤酒含酒精3%—5%
葡萄酒含酒精10%—20%,
黄酒含酒精8%—15%,
白酒含酒精50%—70% 各 类 酒 精 烃分子中的氢原子被卤素原子取代后形成了烃的衍生物卤代烃,那么烃分子中的氢原子被
羟基取代会形成哪类物质呢?
比较下面几种物质的结构,能归纳出醇和酚在 结构上的差别吗?链烃基羟基下列物质中属于醇的是( )√√√醇:烃分子中饱和碳原子上的H原子被羟基取代形成的化合物。苯环羟基酚:分子中羟基与苯环(其它芳环)碳原子直接相连形成的化合物(一)醇的分类1、按羟基数目:一元醇、二元醇、多元醇2、按羟基连接类别:脂肪醇、芳香醇一、醇(官能团是:--OH)乙醇乙二醇丙三醇3、根据OH所连碳原子分:一级醇(伯醇):如R—CH2--OH二级醇(仲醇):如R1—CH—OH—R2三级醇(叔醇):如R2—C—OH——R1R34、按连接链烃基类别:饱和醇、不饱和醇CH2 = CHCH2CH2OH CnH2n+1OH或CnH2n+2O饱和一元醇的通式:(二)、醇的命名①选主链:含有尽可能多羟基的最长的碳链为主链
②编位号:从靠近羟基的这一端开始编号
③其它同烯烃(当羟基与碳碳双键或碳碳叁键相连时易发生异构化)乙醇俗称酒精
跟我们日常生活密切联系最常见的醇是乙醇作燃料 —— 飞机、汽车、火锅、酒精灯等作消毒剂 —— 医用酒精等二、乙醇的用途医疗上常用75%(体积分数)的酒精作消毒剂制酒精型饮料 —— 啤酒、红酒等工业制取乙酸重要的有机化工原料三、乙醇的物理性质和分子结构a.乙醇的物理性质 乙醇(酒精)是无色透明、具有特殊香味的液体,密度比水小,沸点比水低,易挥发,任意比溶于水,能溶解多种无机物和有机物。 b.乙醇的分子结构
??化学式:C2H6O结构简式:CH3CH2OH
或C2H5OH 结构式: 官能团:羟基—OH学生表演烧杯1: 乙醇
烧杯2: 水
烧杯3: 乙醚分别加入钠块,观察现象与钠反应:浮、游、熔有“嘶嘶”声Na的密度小于水,熔点低。钠与水剧烈反应,放出大量热,生成氢气沉在底部无Na的密度大于乙醇。钠与乙醇缓慢反应,放出氢气。沉在底部无不反应P67页 四、乙醇的化学性质2CH3CH2-OH +2Na →2CH3CH2ONa +H2↑ 1、?乙醇与钠反应现象:缓慢产生气泡,金属钠沉于底部或上下浮动。产物乙醇钠在水中强烈水解CH3CH2-ONa +H2O→CH3CH2OH +NaOH 练习:写出乙醇与K、Ca分别反应的化学方程式 乙醇钠溶液呈碱性,滴入酚酞呈红色结论:H原子的活泼性:水>乙醇>乙醚能否通过此反应测定有机物的羟基数目?能学生表演乙醇与氢卤酸的反应下面的实验可以帮助我们认识乙醇与氢卤酸的反应。
1.组装如图所示装置。在试管I中依次加入2 mL蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3 g 溴化钠粉末,在试管II中注入蒸馏水,烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却,观察并描述实验现象。你怎样证明试管II中收集到是卤代烃?P68页NaOH、HNO3、AgNO3
学生表演【实验原理】2、乙醇与氢卤酸的反应(取代反应)NaBr + H2SO4 = NaHSO4 + HBr R—OH + HXR—X + H2O醇与其它氢卤酸的反应:学生表演下列活动能帮助我们认识乙醇的脱水反应。
完成如图所示实验,在试管中加入2gP2O5并注入4 mL 95%乙醇,给试管加热,将生成的气体经过水洗后,用排水集气法收集。1.研究证实,P2O5在该反应中作催化剂。请根据上述实验和信息,参考前面的探究案例,提出一个合适的探究课题,展开对该反应的研究。请设计探究方案,将你的方案与同学们交流。2.经过探究,你能判断出乙醇所发生的反应是什么类型吗?认识乙醇的脱水反应KOH
溶液酸性高锰酸钾溶液P69页乙醇P2O5吸收H3PO4检验乙烯乙醇等3、消去反应分子间脱水(浓硫酸170 ℃或Al2O3400 ℃或P2O5分子内脱水(浓硫酸常用作脱水剂和
催化剂且常放几片碎石片
以防暴沸)结论: 条件不同,产物不同。总结:
乙醇可以在浓硫酸、Al2O3(400 ℃左右)或P2O5或石棉绒等催化剂的作用
下发生脱水反应即发生消去反应.醇的消去反应和卤代烃的消去是一样的.而有些醇遇到稀硫酸便可脱水,如叔丁醇在20%的硫酸中
只需加热到80 ℃便能生成异丁烯.实验注意事项:
(1)反应温度:170℃; (2)加碎瓷片;
(3)V乙醇∶V浓硫酸 = 1∶3 (4)检查气密性;思考:
1、放入几片碎瓷片作用是什么?
2、浓硫酸的作用是什么?
3、酒精与浓硫酸体积比为何要为1∶3?
4、温度计的位置?
5、为何使液体温度迅速升到170℃?防止暴沸催化剂和脱水剂 因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水乙醇,酒精与浓硫酸体积比以1∶3为宜。 温度计水银球要置于反应物的中央位置,因为需要测量的是反应物的温度。 因为无水乙醇和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。6、混合液颜色如何变化?为什么?
7、有何杂质气体?如何除去?
8、为何教材中使用NaOH溶液进行洗气?要除去什么杂质气体? 烧瓶中的液体逐渐变黑。因为浓硫酸有多种特性。在加热的条件下,无水乙醇和浓硫酸混合物的反应除可生成乙烯等物质以外,浓硫酸还能将无水乙醇氧化生成碳的单质等多种物质,碳的单质使烧瓶内的液体带上了黑色。 由于无水乙醇和浓硫酸发生的氧化还原反应,反应制得的乙烯中往往混有H2O、CO2、SO2等气体。可将气体通过碱石灰。 因CH3CH2OH、SO2气体能使酸性KMnO4溶液褪色影响乙烯的检验,故必须用NaOH溶液先将其除去。4、氧化反应(1)可燃性现象:发出淡蓝色的火焰,同时放出大量热(内燃机的燃料)(2)催化氧化催化机理思考:铜丝在此实验中起什么作用?红色→黑色黑色→红色总反应方程式:?刺激性气味液体条件:与—OH相连的碳原子上要有H原子的醇才能发生催化氧化 A: 连有羟基的碳原子上有两个氢原子的醇,被氧化后生成醛B: 连有羟基的碳原子上仅有一个氢原子的醇,被氧化后生成酮催化氧化反应(饱和一元醇)+O2(3)被其它氧化剂氧化K2Cr2O7 、 KMnO4 的酸性溶液均可将乙醇氧化 ,利用K2Cr2O7的酸性溶液将乙醇氧化的原理来检验酒后驾车CH3CH2OHCH3CHOCH3COOH学生表演【知识应用】判断是否酒后驾车的方法三氧化铬硫酸铬3CH3CH2OH+2K2Cr2O7+8H2SO4→
3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O
(橙红色)(绿色)催化氧化反应:
a. 酒精中毒机理:
乙醇经过催化酶作用下转化成剧毒物乙醛。
b.乙醇能被酸性KMnO4缓慢氧化成乙醛,进而氧化成乙酸———使KMnO4褪色。应用:工业上将乙醇蒸汽和空气的混合物通过灼热的铜网或银网制乙醛有机物的氧化还原反应
氧化反应:失氢得氧
还原反应:失氧得氢有机物的催化氧化归纳:有机物去氢或加氧是氧化反应有机物加氢或去氧是还原反应即:5.酯化反应:与有机酸或无机含氧酸写出乙醇与硝酸生成硝酸乙酯的方程式。怎样制备无水乙醇CH3CH2-OHCH3CHOCH3COOH[O][O]CH3CH2-ONa乙醇的氧化反应 CH3CH2-BrCH2=CH2CH3CH2-O-CH2CH3乙醇的化学性质小结NaH2OHBrNaOH水溶液浓H2SO4
170℃浓H2SO4
140℃6、乙醇的工业制法?7、醇的化学性质——与乙醇相似学生表演①与活泼金属反应
②催化氧化
③酯化反应
④与氢卤酸反应
⑤分子内脱水(消去)
⑥分子间脱水(取代) 乙 醇官能团 -OH结构:化学性质:反应中乙醇断键位置?乙醇乙醚乙烯淀粉乙酸乙酯乙醛溴乙烷乙醇钠关系网课堂练习:.下列物质中:
(A) (B)
(C) (D)
1)能与氢氧化钠溶液发生反应的是( )
2)能与溴水发生取代反应的是( )
3)能与金属钠发生反应的是( )—OH—CH2OHB、DB、DB、C、D思考 ⑴如何区分乙醇溶液和无水乙醇?取少量酒精,加入无水硫酸铜,
若出现蓝色,则证明是工业酒精.⑵如何实现由乙醇溶液向无水乙醇转化? 乙醇溶液 无水乙醇
(96%) (99.5%) 加CaO生成Ca(OH)2
蒸馏(三)几种重要的醇甲醇(俗称:木醇或木精)
①可燃性无色液体,有类似酒精的气味,沸点:65℃;跟水按任意比例混合。
②有毒,饮用10mL可失明,使用再多可使人中毒死亡。
③优良有机溶剂,也可掺入汽油或柴油中作内燃机燃料
④又名木醇(源于木材干馏可制得) 甲醇的应用 直接甲醇燃料电池
直接甲醇燃料电池是由甲醇负极、氧正极和质子交换膜构成。在催化剂作用下甲醇被氧化为H2O和CO2。甲醇用完后,只要补充甲醇水溶液就可以继续使用了。正极和负极的电极反应分别为:
负极:2CH3OH + 2H2O-12 e-
2CO2+ 12H+
正极:3 O2+12H++12e-6 6H2O
DMFC可以用于笔记本电脑、汽车等。它可以实现污染物的“零排放”。甲醇汽油的应用P 70乙二醇球棍模型物理性质:无色、粘稠、有甜味的液体。沸点:198℃,
熔点:-11.5 ℃。密度:1.109g/cm3。易溶于水和乙醇。
化学性质:与乙醇相似。
用途:常作内燃机的冷冻剂。乙二醇可用于汽车作防冻剂丙三醇球棍模型物理性质:无色、粘稠、有甜味的液体。密度:1.2619g/cm3。
沸点:290 ℃。吸湿性强。能跟水和乙醇任意比混合。
化学性质:与乙醇相似。
用途:制印泥、化妆品,防冻剂,制炸药(消化甘油)。 俗名:甘油丙三醇可用于配制化妆品总结醇:1、醇的分类:醇一元醇多元醇饱和一元醇:不饱和一元醇CnH2n+1OH:如乙二醇、丙三醇等2、同系物的物理性质比较:P.49思考交流表3-2图●●●●●●●●●●●醇烷乙?醇丙?醇醇的沸点远高于烷烃。醇羟基越多沸点越高。氢键氢键数目增多练习1、将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻铜片质量增加的是( )A、硝酸 B、无水乙醇
B、石灰水 D、盐酸解析:
铜片在空气中加热后,会与O2反应生成CuO,从而使铜片质量增加。C练习2:现有下列一元醇可发生消去反应的是( ),其对应的产物是( )
可发生催化氧化的是( ),其对应的产物是( )ABCDEF
