化学:3.3《沉淀溶解平衡》课件(鲁科版选修4)
文档属性
| 名称 | 化学:3.3《沉淀溶解平衡》课件(鲁科版选修4) |

|
|
| 格式 | rar | ||
| 文件大小 | 618.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-11-26 00:00:00 | ||
图片预览







文档简介
课件20张PPT。
当我们外出旅游,沉醉于秀美的湖光山色时,一定会惊叹大自然的鬼斧神工。
你知道它们是如何形成的吗?第3节 沉淀溶解平衡第3章 物质在水溶液中的行为一、了解难溶电
解质在水中的溶
解情况。你这节课的目标:溶解和生成的问
题。 二、能运用平衡
移动原理分析、解决沉淀的三、正确理解和掌握溶度积KSP
的概念和性质。 探究一:讨论1、 在NaCl的水溶液中,再加入固体溶质,固体有没有溶解过程?讨论2、NaCl能不能和盐酸反应?
实验:在饱和NaCl溶液中加入浓盐酸现象:大量白色沉淀产生 现象?NaCl(S) Na+ + Cl-加入
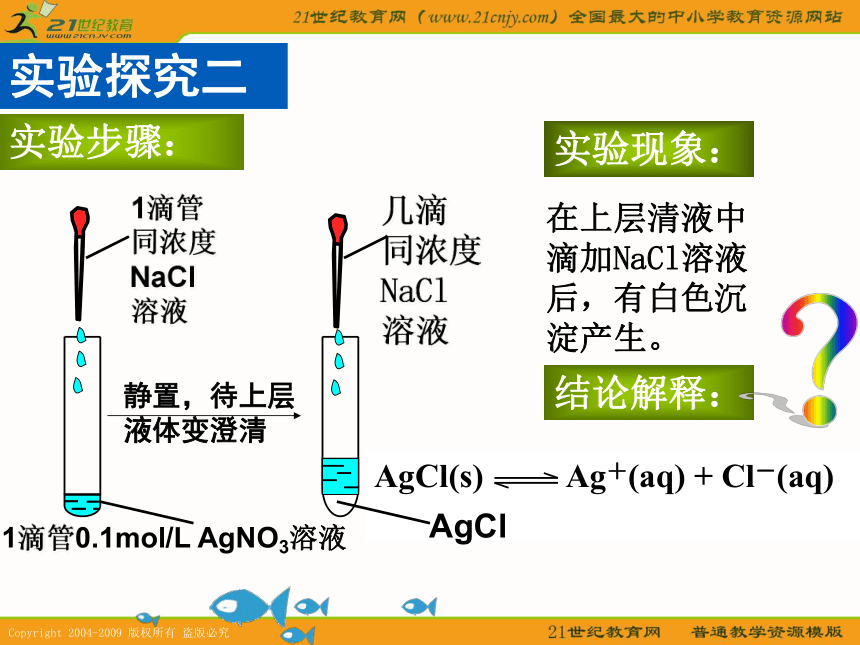
浓盐酸4、你认为白色沉淀是什么物质呢?产生白色沉淀的原因是什么?溶液中存在:Na+ Cl- H+ OH- 可溶的电解质溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?实验探究二实验步骤:在上层清液中滴加NaCl溶液后,有白色沉淀产生。实验现象:结论解释:1滴管0.1mol/L AgNO3溶液1滴管同浓度NaCl
溶液几滴
同浓度
NaCl
溶液AgCl 溶解
AgCl(s) Ag+(aq) + Cl-(aq)
沉淀
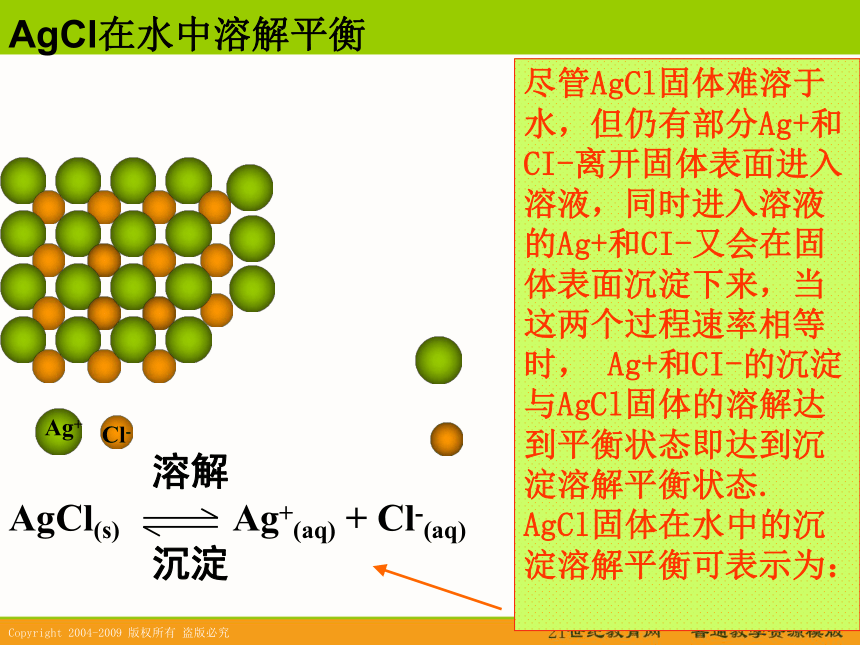
AgCl在水中溶解平衡尽管AgCl固体难溶于水,但仍有部分Ag+和CI-离开固体表面进入溶液,同时进入溶液的Ag+和CI-又会在固体表面沉淀下来,当这两个过程速率相等时, Ag+和CI-的沉淀与AgCl固体的溶解达到平衡状态即达到沉淀溶解平衡状态. AgCl固体在水中的沉淀溶解平衡可表示为:
1、沉淀溶解平衡3)特征:逆、动、等、定、变练:书写碳酸钙溶解平衡的表达式 一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡 。 2)表达式:1)概念:Mg(OH)2 (s) Mg2+ (aq) +2OH- (aq) 沉淀溶解平衡和化学平衡、电离平衡一样,符合平衡的基本特征、满足平衡的变化基本规律。 练一练1、下列对沉淀溶解平衡的描述正确的是( )
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率与溶解的速率相等
C.沉淀溶解达到平衡时,溶液中离子的浓度相等且保持不变
D.沉淀溶解达到平衡时,如果再加入该沉淀物,将促进溶解 B2.难溶等于不溶吗? 习惯上,将溶解度小于0.01克的电解质称为难溶电解质。难溶电解质的溶解度尽管很小,但不会等于0 ,没有绝对不溶的物质。4)影响溶解平衡的因素:①内因:电解质本身的性质 a、绝对不溶的电解质是没有的。
b、同是难溶电解质,溶解度差别也很大。
c、易溶电解质做溶质时只要是饱和溶液也可存在溶解平衡。②外因: a)浓度:b)温度:通常我们讲的外因包括浓度、温度、压强等。对于溶解平衡来说,在溶液中进行,可忽略压强的影响。 平衡右移平衡左移 多数平衡向溶解方向移动升温①加水
②增大相同离子浓度 交流·研讨 珊瑚虫是海洋中的一种腔肠动物,它们可以从周围海水中获取Ca2+和HCO3-,经反应形成石灰石外壳:
Ca2+ +2HCO3- CaCO3↓ +CO2↑+H2O
珊瑚周围的藻类植物的生长会促进碳酸钙的产生,对珊瑚的形成贡献很大。人口增长、人类大规模砍伐森林、燃烧煤和其他的化石燃料等因素,都会干扰珊瑚的生长,甚至造成珊瑚虫死亡。分析这些因素影响珊瑚生长的原因。
2、牙齿表面由一层硬的、组成为Ca5(PO4)3OH
的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH(s) 5Ca2++3PO43-+OH- 进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。生成的有机酸能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿 1、石灰乳中存在下列平衡:
Ca(OH)2(s) Ca2+(aq)+2 OH― (aq),
加入下列溶液,可使Ca(OH)2减少的是( )
A.Na2CO3溶液 B.AlCl3溶液
C.NaOH溶液 D.CaCl2溶液 练一练A B 难溶固体在溶液中达到沉淀溶解平衡状态时,离子浓度保持不变(或一定)。其离子浓度的次方的乘积为一个常数这个常数称之为溶度积常数简称为溶度积,用Ksp表示。2、溶度积常数或溶度积(Ksp ):表达式概念: ①溶度积(Ksp )的大小与难溶电解质性质和温度有关,与沉淀的量无关.离子浓度的改变可使平衡发生移动,而不能改变溶度积.溶度积(Ksp )的性质25℃时, Ksp=[Mg2+ ][OH-]2 = 5.6×10-12mol3?L-3练:请写出 BaSO4 、 Al(OH)3 的沉淀溶解平衡与溶度积KSP表达式。 BaSO4 (s) Ba2+ + SO42- KSP=[Ba2+][SO42-]
Al(OH)3 (s) Al3+ + 3OH- KSP=[Al3 + ][OH-]3
相同类型(如AB型)的难溶电解质的Ksp越小,溶解度越小,越难溶。
如: Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI)
溶解度:AgCl > AgBr > AgI ② Ksp反映了难溶电解质在水中的溶解度练一练1、下列叙述正确的是( )
A.由于AgCl水溶液导电性很弱,所以它是弱电解质
B.难溶电解质离子浓度的乘积就是该物质的溶度积常数
C.溶度积常数大者,溶解度也大
D.用水稀释含有AgCl固体的溶液时, AgCl的溶度积常数不变。D作业:《成材之路》P119 2. 3. 10这节课你学到了什么饱和NaCl溶液 一昼夜后观察发现:固体变为规则的立方体;质量并未发生改变思考:
得到什么启示? 一昼夜后……探究:NaCl(S) Na+ + Cl-
当我们外出旅游,沉醉于秀美的湖光山色时,一定会惊叹大自然的鬼斧神工。
你知道它们是如何形成的吗?第3节 沉淀溶解平衡第3章 物质在水溶液中的行为一、了解难溶电
解质在水中的溶
解情况。你这节课的目标:溶解和生成的问
题。 二、能运用平衡
移动原理分析、解决沉淀的三、正确理解和掌握溶度积KSP
的概念和性质。 探究一:讨论1、 在NaCl的水溶液中,再加入固体溶质,固体有没有溶解过程?讨论2、NaCl能不能和盐酸反应?
实验:在饱和NaCl溶液中加入浓盐酸现象:大量白色沉淀产生 现象?NaCl(S) Na+ + Cl-加入
浓盐酸4、你认为白色沉淀是什么物质呢?产生白色沉淀的原因是什么?溶液中存在:Na+ Cl- H+ OH- 可溶的电解质溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?实验探究二实验步骤:在上层清液中滴加NaCl溶液后,有白色沉淀产生。实验现象:结论解释:1滴管0.1mol/L AgNO3溶液1滴管同浓度NaCl
溶液几滴
同浓度
NaCl
溶液AgCl 溶解
AgCl(s) Ag+(aq) + Cl-(aq)
沉淀
AgCl在水中溶解平衡尽管AgCl固体难溶于水,但仍有部分Ag+和CI-离开固体表面进入溶液,同时进入溶液的Ag+和CI-又会在固体表面沉淀下来,当这两个过程速率相等时, Ag+和CI-的沉淀与AgCl固体的溶解达到平衡状态即达到沉淀溶解平衡状态. AgCl固体在水中的沉淀溶解平衡可表示为:
1、沉淀溶解平衡3)特征:逆、动、等、定、变练:书写碳酸钙溶解平衡的表达式 一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成电解质的饱和溶液,达到平衡状态,我们把这种平衡称为沉淀溶解平衡 。 2)表达式:1)概念:Mg(OH)2 (s) Mg2+ (aq) +2OH- (aq) 沉淀溶解平衡和化学平衡、电离平衡一样,符合平衡的基本特征、满足平衡的变化基本规律。 练一练1、下列对沉淀溶解平衡的描述正确的是( )
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率与溶解的速率相等
C.沉淀溶解达到平衡时,溶液中离子的浓度相等且保持不变
D.沉淀溶解达到平衡时,如果再加入该沉淀物,将促进溶解 B2.难溶等于不溶吗? 习惯上,将溶解度小于0.01克的电解质称为难溶电解质。难溶电解质的溶解度尽管很小,但不会等于0 ,没有绝对不溶的物质。4)影响溶解平衡的因素:①内因:电解质本身的性质 a、绝对不溶的电解质是没有的。
b、同是难溶电解质,溶解度差别也很大。
c、易溶电解质做溶质时只要是饱和溶液也可存在溶解平衡。②外因: a)浓度:b)温度:通常我们讲的外因包括浓度、温度、压强等。对于溶解平衡来说,在溶液中进行,可忽略压强的影响。 平衡右移平衡左移 多数平衡向溶解方向移动升温①加水
②增大相同离子浓度 交流·研讨 珊瑚虫是海洋中的一种腔肠动物,它们可以从周围海水中获取Ca2+和HCO3-,经反应形成石灰石外壳:
Ca2+ +2HCO3- CaCO3↓ +CO2↑+H2O
珊瑚周围的藻类植物的生长会促进碳酸钙的产生,对珊瑚的形成贡献很大。人口增长、人类大规模砍伐森林、燃烧煤和其他的化石燃料等因素,都会干扰珊瑚的生长,甚至造成珊瑚虫死亡。分析这些因素影响珊瑚生长的原因。
2、牙齿表面由一层硬的、组成为Ca5(PO4)3OH
的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH(s) 5Ca2++3PO43-+OH- 进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。生成的有机酸能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿 1、石灰乳中存在下列平衡:
Ca(OH)2(s) Ca2+(aq)+2 OH― (aq),
加入下列溶液,可使Ca(OH)2减少的是( )
A.Na2CO3溶液 B.AlCl3溶液
C.NaOH溶液 D.CaCl2溶液 练一练A B 难溶固体在溶液中达到沉淀溶解平衡状态时,离子浓度保持不变(或一定)。其离子浓度的次方的乘积为一个常数这个常数称之为溶度积常数简称为溶度积,用Ksp表示。2、溶度积常数或溶度积(Ksp ):表达式概念: ①溶度积(Ksp )的大小与难溶电解质性质和温度有关,与沉淀的量无关.离子浓度的改变可使平衡发生移动,而不能改变溶度积.溶度积(Ksp )的性质25℃时, Ksp=[Mg2+ ][OH-]2 = 5.6×10-12mol3?L-3练:请写出 BaSO4 、 Al(OH)3 的沉淀溶解平衡与溶度积KSP表达式。 BaSO4 (s) Ba2+ + SO42- KSP=[Ba2+][SO42-]
Al(OH)3 (s) Al3+ + 3OH- KSP=[Al3 + ][OH-]3
相同类型(如AB型)的难溶电解质的Ksp越小,溶解度越小,越难溶。
如: Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI)
溶解度:AgCl > AgBr > AgI ② Ksp反映了难溶电解质在水中的溶解度练一练1、下列叙述正确的是( )
A.由于AgCl水溶液导电性很弱,所以它是弱电解质
B.难溶电解质离子浓度的乘积就是该物质的溶度积常数
C.溶度积常数大者,溶解度也大
D.用水稀释含有AgCl固体的溶液时, AgCl的溶度积常数不变。D作业:《成材之路》P119 2. 3. 10这节课你学到了什么饱和NaCl溶液 一昼夜后观察发现:固体变为规则的立方体;质量并未发生改变思考:
得到什么启示? 一昼夜后……探究:NaCl(S) Na+ + Cl-
