化学:4.2《化学电源》课件(新人教版选修4)
文档属性
| 名称 | 化学:4.2《化学电源》课件(新人教版选修4) |
|
|
| 格式 | rar | ||
| 文件大小 | 258.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-11-26 00:00:00 | ||
图片预览





文档简介
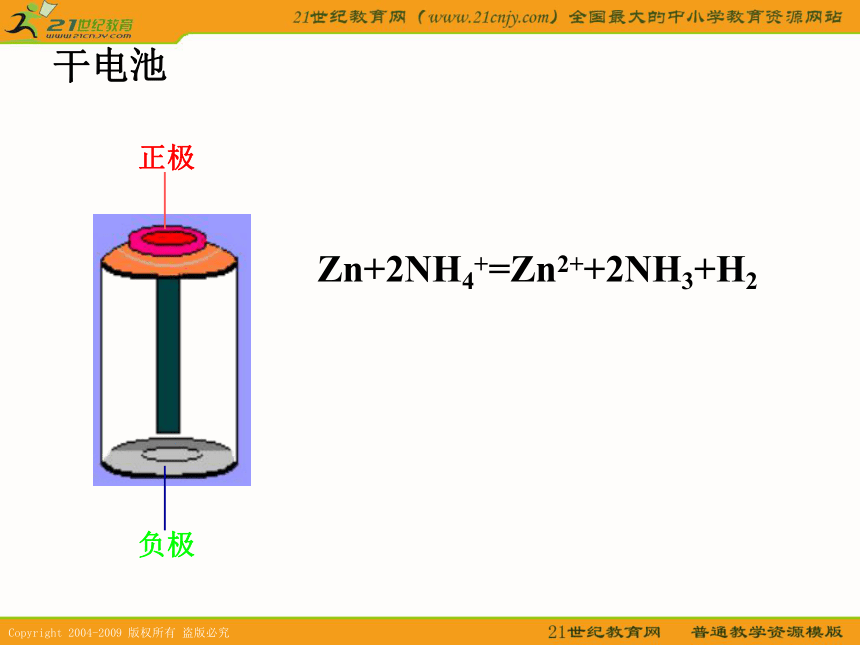
课件15张PPT。化学电源干电池Zn+2NH4+=Zn2++2NH3+H2锌锰碱性电池负极:Zn + 2OH-- 2e- = Zn(OH)2
正极:2MnO2 + 2H2O+ 2 e- = 2MnOOH + 2OH-
总:Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnOOH蓄电池负极: Pb + SO42- - 2e- = PbSO4正极: PbO2 +4H++SO42- +2e-
=PbSO4 + 2H2O总反应:PbO2 + Pb +2H2SO4 = 2PbSO4 + 2H2O
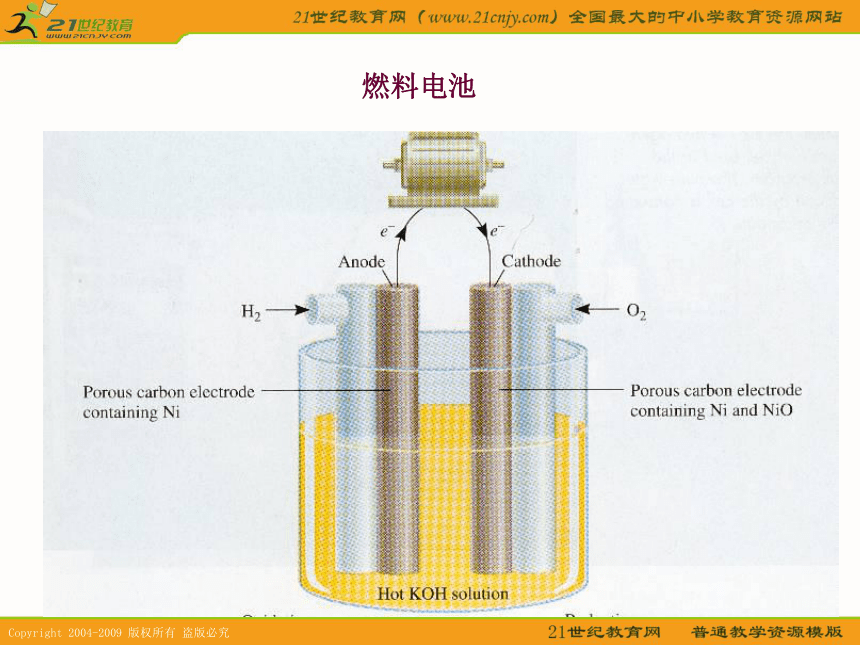
镍氢(MH-Ni) 电池电池反应:H2 + 2NiOOH =2Ni(OH)2 负极: H2 + 2OH- - 2e- = 2H2O 正极: 2NiOOH + 2H2O + 2e-= 2Ni(OH)2 +2 OH-燃料电池燃料电池1下列叙述中,可以说明金属甲比乙活泼性强的是C.将甲乙作电极组成原电池时甲是负极;A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲
上有H2气放出;B.在氧化–还原反应中,甲比乙失去的电子多;D.同价态的阳离子,甲比乙的氧化性强;(C)2
下列制氢气的反应速率最快的是粗锌和 1mol/L 盐酸;B.A.纯锌和1mol/L 硫酸;纯锌和18 mol/L 硫酸;C.粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液。D.( D )3下列各情况,在其中Fe片腐蚀由快到慢的顺序是(5)(2)(1)(3)(4)例4:下列装置中四块相同的Zn片,放置一段时间后腐蚀速
率由慢到快的顺序是(4)(2)(1)(3)5在Cu-Zn原电池中,200mLH2SO4 溶液的浓度为0.125mol/L , 若工作一段时间后,从装置中共收集到 0.168L升气体,则流过导线的电子为_______ mol,溶液的pH值变_________?(溶液体积变化忽略不计)大 0.0156:市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。 “热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。
“热敷袋”是利用 放出热量。
2)炭粉的主要作用是 。
3)加入氯化钠的主要作用是 。
4)木屑的作用是 。铁被氧化与铁屑、氯化钠溶液构成原电池,加速铁屑的氧化氯化钠溶于水、形成电解质溶液使用“热敷袋”时受热均匀 拓展练习
(1)若烧杯中溶液为稀硫酸,则观察到的
现象。
两极反应式为:正极 ;
负极 。
该装置将 能转化为 能。
(2)若烧杯中溶液为氢氧化钠溶液,
则负极为 ,
总反应方程为 。
镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;2H++2e—=H2↑Mg-2e—=Mg2+ 化学能电能Al2Al+2NaOH+2H2O=2NaAlO2+3H2↑小 结1定义:(1)由两个半电池组成的锌铜原电池的工作原理 原电池把化学能转化成电能的装置。2、原电池的工作原理
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。 (2)形成原电池的条件(3)原电池的正负极的判断方法(4)电极材料的选择(电池的电极必须导电)
正极:2MnO2 + 2H2O+ 2 e- = 2MnOOH + 2OH-
总:Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnOOH蓄电池负极: Pb + SO42- - 2e- = PbSO4正极: PbO2 +4H++SO42- +2e-
=PbSO4 + 2H2O总反应:PbO2 + Pb +2H2SO4 = 2PbSO4 + 2H2O
镍氢(MH-Ni) 电池电池反应:H2 + 2NiOOH =2Ni(OH)2 负极: H2 + 2OH- - 2e- = 2H2O 正极: 2NiOOH + 2H2O + 2e-= 2Ni(OH)2 +2 OH-燃料电池燃料电池1下列叙述中,可以说明金属甲比乙活泼性强的是C.将甲乙作电极组成原电池时甲是负极;A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲
上有H2气放出;B.在氧化–还原反应中,甲比乙失去的电子多;D.同价态的阳离子,甲比乙的氧化性强;(C)2
下列制氢气的反应速率最快的是粗锌和 1mol/L 盐酸;B.A.纯锌和1mol/L 硫酸;纯锌和18 mol/L 硫酸;C.粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液。D.( D )3下列各情况,在其中Fe片腐蚀由快到慢的顺序是(5)(2)(1)(3)(4)例4:下列装置中四块相同的Zn片,放置一段时间后腐蚀速
率由慢到快的顺序是(4)(2)(1)(3)5在Cu-Zn原电池中,200mLH2SO4 溶液的浓度为0.125mol/L , 若工作一段时间后,从装置中共收集到 0.168L升气体,则流过导线的电子为_______ mol,溶液的pH值变_________?(溶液体积变化忽略不计)大 0.0156:市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。 “热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。
“热敷袋”是利用 放出热量。
2)炭粉的主要作用是 。
3)加入氯化钠的主要作用是 。
4)木屑的作用是 。铁被氧化与铁屑、氯化钠溶液构成原电池,加速铁屑的氧化氯化钠溶于水、形成电解质溶液使用“热敷袋”时受热均匀 拓展练习
(1)若烧杯中溶液为稀硫酸,则观察到的
现象。
两极反应式为:正极 ;
负极 。
该装置将 能转化为 能。
(2)若烧杯中溶液为氢氧化钠溶液,
则负极为 ,
总反应方程为 。
镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;2H++2e—=H2↑Mg-2e—=Mg2+ 化学能电能Al2Al+2NaOH+2H2O=2NaAlO2+3H2↑小 结1定义:(1)由两个半电池组成的锌铜原电池的工作原理 原电池把化学能转化成电能的装置。2、原电池的工作原理
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。 (2)形成原电池的条件(3)原电池的正负极的判断方法(4)电极材料的选择(电池的电极必须导电)
