化学:3.3《盐类的水解》课件(苏教版选修4)
文档属性
| 名称 | 化学:3.3《盐类的水解》课件(苏教版选修4) |  | |
| 格式 | rar | ||
| 文件大小 | 102.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-11-26 16:03:00 | ||
图片预览





文档简介
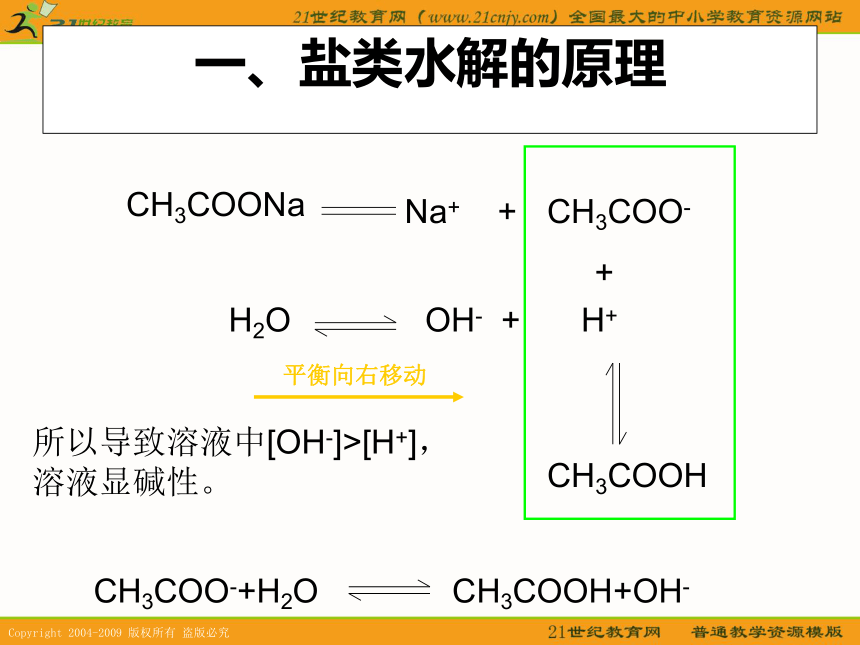
课件16张PPT。盐类的水解Na2CO3的俗名是什么?它属于哪一类物质?试推测它呈什么性?如何用实验验证?俗名------纯碱 盐----------碱性1、用酚酞试液检验Na2CO3溶液的酸碱性。2、用pH试纸检验Na2CO3溶液的酸碱性。 溶液呈红色---碱性PH>7 ---碱性活动·探究 请测定下列溶液的酸碱性:CH3COONa、 NaCl 、Na2CO3、NH4Cl、 KNO3、 Al2(SO4)3,并完成课本活动·探究的表格。。一、盐类水解的原理CH3COONaCH3COO-H2OH+ +CH3COOHNa+ +OH- +所以导致溶液中[OH-]>[H+],溶液显碱性。CH3COO-+H2OCH3COOH+OH-定义溶液中盐电离出的离子跟水电离出的H+或OH-结合生成弱电解质的反应,叫做盐类的水解的反应,简称盐类的水解。为什么NH4Cl溶液显酸性?
为什么NaCl溶液显中性?盐类水解的实质:
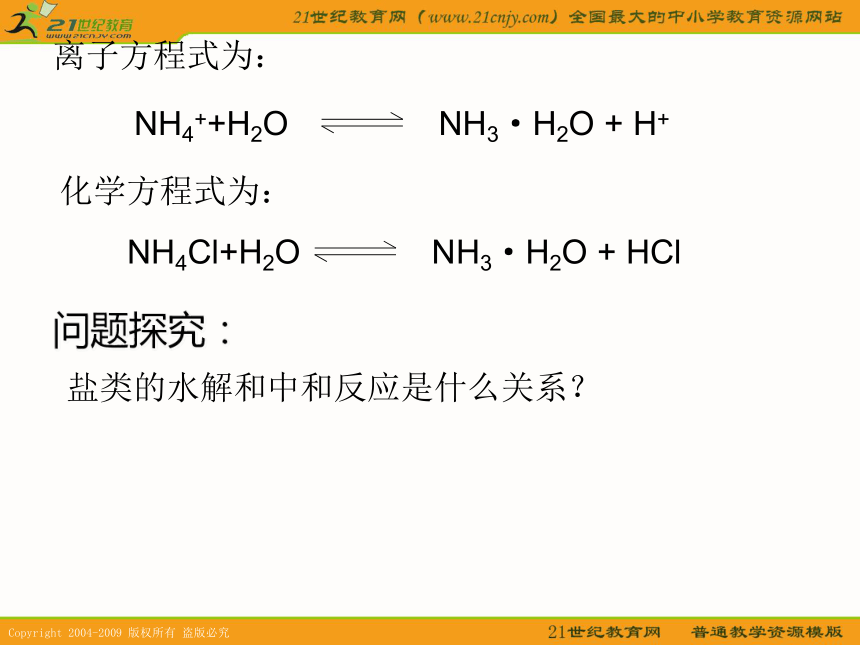
破坏水的电离平衡,使水的电离平衡正向移动。思考:NH4++H2ONH3·H2O + H+离子方程式为:化学方程式为:NH4Cl+H2ONH3·H2O + HCl问题探究:盐类的水解和中和反应是什么关系?盐类水解的特征盐类水解是酸碱中和反应的逆反应。
盐类水解是吸热过程。
盐类水解的程度一般很小。练习讨论:盐类能否水解与水解后溶液显什么性,水解程度一样吗,同学们能找出有什么规律吗?
水解规律:有弱才水解,无弱不水解;越弱越水解,谁强显谁性。练习1下列各组的离子,都能发生水解的一组是( )
A、Na+ Cu2+ Cl- ClO-
B、Ca2+ Zn2+ SO42- S2-
C、Fe2+ Sn2+ F- CH3COO-
D、K+ Ba2+ SO32- I-C练习2已知物质的量浓度相同的盐溶液:NaX、NaY、NaZ,它们的pH依次为:8、9、10,则这三种盐相对应的酸的酸性递减的顺序正确的是( )
A.HX>HY>HZ B.HZ>HY>HX
C.HY>HX>HZ D.HY>HZ>HXB练习3在溶液中,不能发生水解的离子是( )
A、ClO - B、CO32-
C、Fe3+ D、ClO4 -D练习4下列物质的溶液中,由于水解而使pH值小于7的是( )
A、NaHCO3 B、NH4Cl
C、CH3COOH D、NaCl
B练习525℃时,0.1mol/L某溶液pH=5,则这溶液可能是( )
A、氨水 B、NaCl
C、NH4Cl D、HClC练习6下列物质加入水中,能使水的电离度增大,溶液的pH值减小的是( )
A、HCl B、Al2(SO4)3
C、Na2S D、NH3 ·H2OC课下探究工业上:生产中除铁锈为什么用NH4Cl而不用稀盐酸?
农业上:长期使用(NH4)2SO4这一种化肥会导致土壤酸化,为什么?
实验室:Na2CO3溶液能否保存在玻璃塞的试剂瓶中,为什么?例:判断下列盐类是否能够水解,若能水解,则水解后的酸碱性是怎样的?NaNO3 K2SO4
Na2S NaHCO3
CuSO4 强酸强碱盐不水解,显中性强碱弱酸盐水解显碱性强酸弱碱盐水解显酸性返回
为什么NaCl溶液显中性?盐类水解的实质:
破坏水的电离平衡,使水的电离平衡正向移动。思考:NH4++H2ONH3·H2O + H+离子方程式为:化学方程式为:NH4Cl+H2ONH3·H2O + HCl问题探究:盐类的水解和中和反应是什么关系?盐类水解的特征盐类水解是酸碱中和反应的逆反应。
盐类水解是吸热过程。
盐类水解的程度一般很小。练习讨论:盐类能否水解与水解后溶液显什么性,水解程度一样吗,同学们能找出有什么规律吗?
水解规律:有弱才水解,无弱不水解;越弱越水解,谁强显谁性。练习1下列各组的离子,都能发生水解的一组是( )
A、Na+ Cu2+ Cl- ClO-
B、Ca2+ Zn2+ SO42- S2-
C、Fe2+ Sn2+ F- CH3COO-
D、K+ Ba2+ SO32- I-C练习2已知物质的量浓度相同的盐溶液:NaX、NaY、NaZ,它们的pH依次为:8、9、10,则这三种盐相对应的酸的酸性递减的顺序正确的是( )
A.HX>HY>HZ B.HZ>HY>HX
C.HY>HX>HZ D.HY>HZ>HXB练习3在溶液中,不能发生水解的离子是( )
A、ClO - B、CO32-
C、Fe3+ D、ClO4 -D练习4下列物质的溶液中,由于水解而使pH值小于7的是( )
A、NaHCO3 B、NH4Cl
C、CH3COOH D、NaCl
B练习525℃时,0.1mol/L某溶液pH=5,则这溶液可能是( )
A、氨水 B、NaCl
C、NH4Cl D、HClC练习6下列物质加入水中,能使水的电离度增大,溶液的pH值减小的是( )
A、HCl B、Al2(SO4)3
C、Na2S D、NH3 ·H2OC课下探究工业上:生产中除铁锈为什么用NH4Cl而不用稀盐酸?
农业上:长期使用(NH4)2SO4这一种化肥会导致土壤酸化,为什么?
实验室:Na2CO3溶液能否保存在玻璃塞的试剂瓶中,为什么?例:判断下列盐类是否能够水解,若能水解,则水解后的酸碱性是怎样的?NaNO3 K2SO4
Na2S NaHCO3
CuSO4 强酸强碱盐不水解,显中性强碱弱酸盐水解显碱性强酸弱碱盐水解显酸性返回
