化学:2.3.2《氧化剂和还原剂》课件(鲁科版必修1)
文档属性
| 名称 | 化学:2.3.2《氧化剂和还原剂》课件(鲁科版必修1) |  | |
| 格式 | rar | ||
| 文件大小 | 138.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-11-26 20:59:00 | ||
图片预览




文档简介
课件11张PPT。第二课时氧化剂和还原剂复习旧知:1、氧化还原反应
1、定义:
2、特征:
3、本质: 凡有电子转移(得失或偏移)的反应叫氧化还原反应。 反应中有元素化合价的升降 反应中有电子的得失或电子对的偏移2.在下列各式中,当左边的物质能生成右边的物质时,试指出下列带短线的元素是被氧化还是被还原?
(1)KClO3→KCl (2)HClO→O2
(3)KI→I2 (4)NO2→HNO3
氧 化 剂:
还 原 剂:
氧化产物:
还原产物:所含元素化合价降低的反应物所含元素化合价升高的反应物还原剂失去电子被氧化后的产物氧化剂得到电子被还原后的产物1、氧化剂还原剂相关概念CuO +H2 = Cu + H2O判断下列哪些反应是氧化还原反应?是的话判断反应中的氧化剂、还原剂、氧化产物、还原产物。
1.? Na2O + H2O = 2NaOH
2.? 2Fe + Al2O3 = 2Al + Fe2O3
3.? Br 2+ H2O = HBr + HBrO
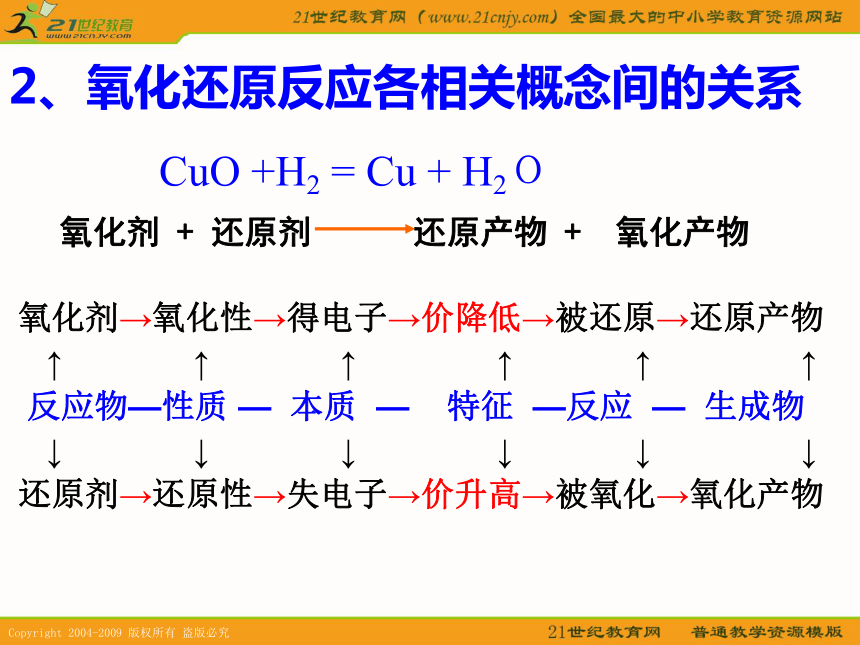
△练习1氧化剂还原剂氧化产物还原产物氧化剂还原剂氧化产物还原产物2、氧化还原反应各相关概念间的关系 氧化剂→氧化性→得电子→价降低→被还原→还原产物
↑ ↑ ↑ ↑ ↑ ↑
反应物—性质 — 本质 — 特征 —反应 — 生成物
↓ ↓ ↓ ↓ ↓ ↓
还原剂→还原性→失电子→价升高→被氧化→氧化产物CuO +H2 = Cu + H2O3、文字表达式: 相互关系:
氧化剂 + 还原剂 还原产物 + 氧化产物
得ne-,化合价降低,被还原,发生还原反应失ne-,化合价升高,被氧化,发生氧化反应4、双线桥法表示氧化还原反应中电子转移的情况:例1:CuO +H2 = Cu + H2O得2e-,化合价降低,被还原失2e-,化合价升高,被氧化例2:MnO2△失6×2e-,化合价升高,被氧化得2×6e-,化合价降低,被还原2KClO3 == 2KCl + 3 O2+200+1+5-1-20讨论: 双线桥法表示电子转移情况的特点:
1、箭头从反应物指向生成物,起止为同一元素
2、箭头不代表电子转移方向 3、要标明“得”“失”电子,且得失电子总数应相等双线桥法表示电子转移情况应注意什么? 注意:小结1:判断微粒(分子、原子、
离子)是否有氧化性或还原性。
(1)元素处于最高价态---只能得电子----只有氧化性
(2)元素处于最低价态---只能失电子----只有还原性
(3)元素处于中间价态---
即能得电子 ---既有氧化性
又能失电子 ---又有还原性小结2:常见的氧化剂、还原剂(1)常见的氧化剂:活泼的非金属如:卤素单质、氧气;含有高价态元素的化合物如:HNO3、 KMnO4 、KClO3、浓H2SO4等。
(2)常见的还原剂:活泼的金属如:Na、K、Zn、Al、Fe;某些非金属如:H2、C; 含有低价态元素的化合物如:H2S、CO、HI等。下列微粒中只有氧化性的是 ;只有还原性的是---------------
既有氧化性又有还原性的是 。
Cl2 (2)Cl- (3)Fe (4)Fe2+
(5)Fe3+ (6) O2 (7) S2- (8) S
(9) SO2 (10) HCl5、62、3、71、4、8、9、10
1、定义:
2、特征:
3、本质: 凡有电子转移(得失或偏移)的反应叫氧化还原反应。 反应中有元素化合价的升降 反应中有电子的得失或电子对的偏移2.在下列各式中,当左边的物质能生成右边的物质时,试指出下列带短线的元素是被氧化还是被还原?
(1)KClO3→KCl (2)HClO→O2
(3)KI→I2 (4)NO2→HNO3
氧 化 剂:
还 原 剂:
氧化产物:
还原产物:所含元素化合价降低的反应物所含元素化合价升高的反应物还原剂失去电子被氧化后的产物氧化剂得到电子被还原后的产物1、氧化剂还原剂相关概念CuO +H2 = Cu + H2O判断下列哪些反应是氧化还原反应?是的话判断反应中的氧化剂、还原剂、氧化产物、还原产物。
1.? Na2O + H2O = 2NaOH
2.? 2Fe + Al2O3 = 2Al + Fe2O3
3.? Br 2+ H2O = HBr + HBrO
△练习1氧化剂还原剂氧化产物还原产物氧化剂还原剂氧化产物还原产物2、氧化还原反应各相关概念间的关系 氧化剂→氧化性→得电子→价降低→被还原→还原产物
↑ ↑ ↑ ↑ ↑ ↑
反应物—性质 — 本质 — 特征 —反应 — 生成物
↓ ↓ ↓ ↓ ↓ ↓
还原剂→还原性→失电子→价升高→被氧化→氧化产物CuO +H2 = Cu + H2O3、文字表达式: 相互关系:
氧化剂 + 还原剂 还原产物 + 氧化产物
得ne-,化合价降低,被还原,发生还原反应失ne-,化合价升高,被氧化,发生氧化反应4、双线桥法表示氧化还原反应中电子转移的情况:例1:CuO +H2 = Cu + H2O得2e-,化合价降低,被还原失2e-,化合价升高,被氧化例2:MnO2△失6×2e-,化合价升高,被氧化得2×6e-,化合价降低,被还原2KClO3 == 2KCl + 3 O2+200+1+5-1-20讨论: 双线桥法表示电子转移情况的特点:
1、箭头从反应物指向生成物,起止为同一元素
2、箭头不代表电子转移方向 3、要标明“得”“失”电子,且得失电子总数应相等双线桥法表示电子转移情况应注意什么? 注意:小结1:判断微粒(分子、原子、
离子)是否有氧化性或还原性。
(1)元素处于最高价态---只能得电子----只有氧化性
(2)元素处于最低价态---只能失电子----只有还原性
(3)元素处于中间价态---
即能得电子 ---既有氧化性
又能失电子 ---又有还原性小结2:常见的氧化剂、还原剂(1)常见的氧化剂:活泼的非金属如:卤素单质、氧气;含有高价态元素的化合物如:HNO3、 KMnO4 、KClO3、浓H2SO4等。
(2)常见的还原剂:活泼的金属如:Na、K、Zn、Al、Fe;某些非金属如:H2、C; 含有低价态元素的化合物如:H2S、CO、HI等。下列微粒中只有氧化性的是 ;只有还原性的是---------------
既有氧化性又有还原性的是 。
Cl2 (2)Cl- (3)Fe (4)Fe2+
(5)Fe3+ (6) O2 (7) S2- (8) S
(9) SO2 (10) HCl5、62、3、71、4、8、9、10
