化学:2.1《氯、溴、碘及其化合物》课件(苏教版必修1)
文档属性
| 名称 | 化学:2.1《氯、溴、碘及其化合物》课件(苏教版必修1) |  | |
| 格式 | rar | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-11-26 20:59:00 | ||
图片预览










文档简介
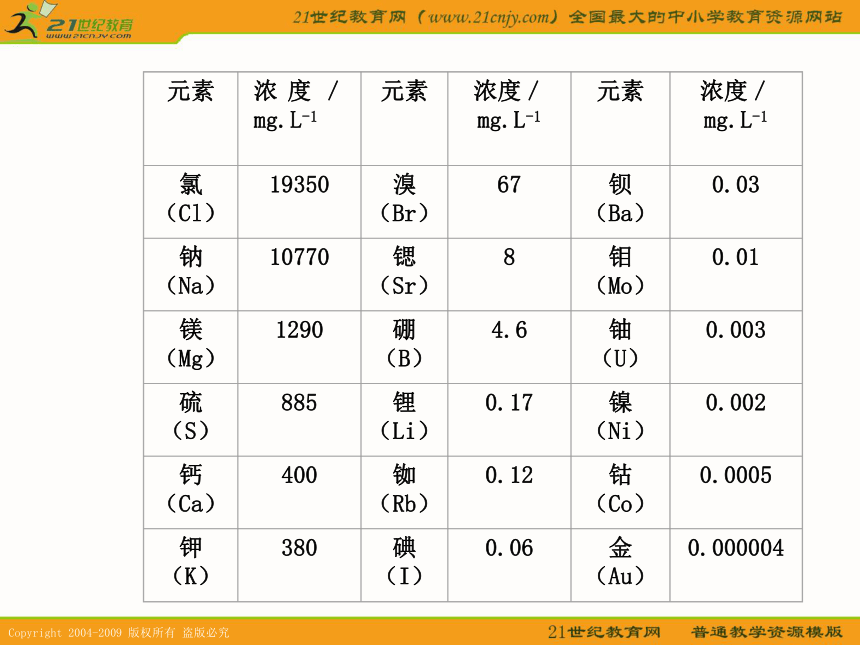
课件59张PPT。专题二 从海水中获得的化学物质①你知道浩瀚的大海中究竟蕴藏着哪些物质吗?请查阅有关资料了解海水中主要含有的物质和各元素的含量。调 查 研 究②查阅有关资料了解人们是如何从海水中获得氯化钠并生产氯气。调 查 研 究海水晒盐第一单元
氯、溴、碘及其化合物 实验原理:
本实验的总反应是:氯化钠跟水发生
电解反应,生成的氢氧化钠和氢气在阴极,
生成的氯气在阳极。 1、氯气的工业制法一、氯气的生产原理氯气的工业制法观察与思考电解饱和食盐水1、将实验中观察到的现象和所得结论填入下表
结论(1)(2) (3)(4)铁棒和碳棒上通电后有气泡产生通电后有新的气体物质生成铁棒周围的颜色变红有碱性物质生成将铁棒上方收集到的气体靠近火焰,有爆鸣声有氢气生成淀粉碘化钾溶液变蓝,黄绿色气体,闻到有刺激性气味有氯气生成实验现象
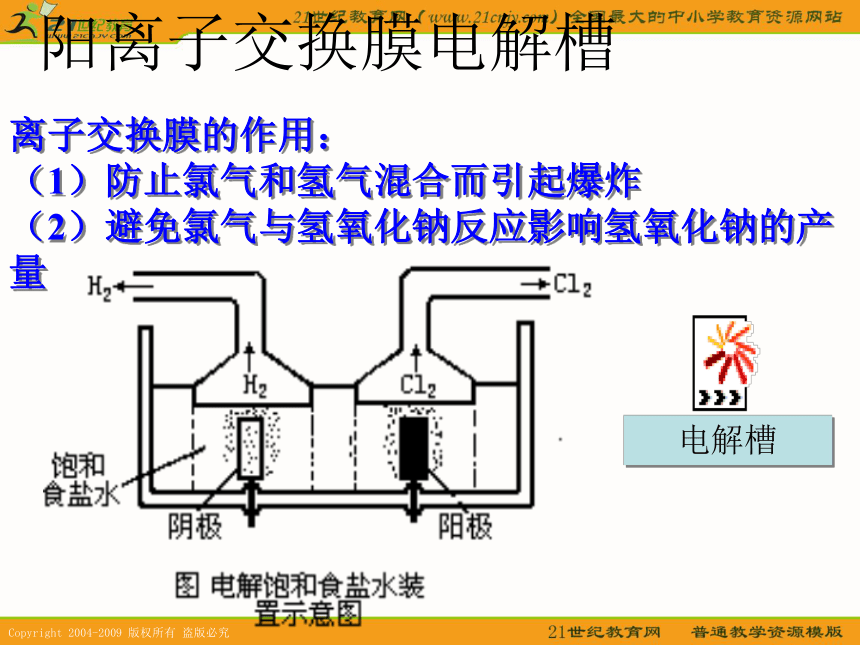
2、根据上述实验现象和分析结果,写出电解氯化钠溶液的化学方程式:
2NaCl+2H2O===2NaOH+ H2↑+ Cl2↑通电阳离子交换膜电解槽电解槽离子交换膜的作用: (1)防止氯气和氢气混合而引起爆炸 (2)避免氯气与氢氧化钠反应影响氢氧化钠的产量 根据氯碱厂原料和产品的性质,你认为在生产过程中和贮运时应注意哪些问题?氯碱厂的厂址应如何选择? 调查研究 厂址的选择:现代化工生产要求有较大的生产规模;厂址选择涉及原料、水源、能源、土地供应、市场需求、交通运输、环境保护等因素,应对这些因素综合考虑,作出合理的抉择。由于氯气有毒,不便贮存和运输,因此要求厂址应避开人口稠密的居民区和环境保护要求高的地区,厂区必须与居民区有一定距离的安全隔离带。 化学式:Cl2观察与思考舍勒 (1742~1786)瑞典化学家。
1774年舍勒 发现氯气
他将这种元素命名为Chlorine,这个名称
来自希腊文,有“绿色”的意思。我国早
年译文将其译成“绿气”,后改为氯气。氯 气2、氯气的实验室制法(1)实验原理:MnO2 + 4HCl(浓) = MnCl2 + Cl2 ↑ + 2H2O
(2)发生装置:
粉末状固体或液体+液体 气体(3)除杂装置:饱和食盐水(4)干燥装置:浓硫酸(5)收集装置:向上排空气法或排饱和食 盐水法(6)尾气处理:用氢氧化钠溶液吸收反馈平台1、如图,A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,接通电路后,发现B上的c点显红色,请填空:
(1)电源的A的a为 极;
(2)滤纸B上发生的总反应方程式为:
正 电解
2NaCl + 2H2O = 2NaOH + H2↑+ Cl2↑
KABabcd2 某学生设计如下实验装置用于制备纯净的氯气。 ②在更正后的装置图中:
(1)饱和食盐水的作用????????????????????????????????????? ;
(2)浓硫酸的作用????????????????????????????????????? ;
(3)氢氧化钠的作用????????????????????????????????????? 。铁架台上未加点燃的酒精灯铁圈上未放置石棉网 不应用稀盐酸 盛浓硫酸和盛饱和食盐水的两只洗气瓶位置错误 盛浓硫酸 的洗气瓶中的进气导管和出气导管连接错误洗去氯气中所含的少量氯化氢气体 可以除去氯气 中水蒸气 吸收多余氯气防止污染空气不应使用长颈漏斗氯 气?
重
庆
天
原
化
工
总
厂 氯气重庆氯气泄漏抢险纪实:
命悬一线 15万人大转移
新华网重庆4月17日(记者黄豁 张琴)16日凌晨,当繁华的山城已沉入梦乡的时候,一场意想不到的危险却悄然降临了。“嘭!”重庆天原化工总厂在寂静的黑夜中发出一声闷响,厂里2号氯冷凝器发生爆炸,黄绿色的氯气如同从瓶中释放的魔鬼弥漫开来。下午17时57分,正在抢险的化工厂再次发生爆炸,当即造成死亡和失踪9人……
不同浓度的氯气对人体的危害 大气中氯气的浓度不得超过0.1mg/m3,生产车间不超过1mg/m3 居民区不超过0.03mg/m3。
如果中毒,保持安静,注意保温,吸入少量乙醇和乙醚蒸汽或氨气。氯 气一、物理性质二、化学性质三 、氯气的用途一、物理性质颜色:
状态:
气味:
密度:
溶解性:
(水中)黄绿色刺激气味气体比空气大能溶于水(1:2) 易液化 : 黄色油状液体 ( 液氯)
(闻?)二、化学性质结构分析:活泼的非金属单质ClCl_+ e-(1)铜与氯气的反应 现象:剧烈燃烧,生成棕黄色的烟。 反应方程式 : 加水后,溶液 呈蓝绿色(浓)或蓝色(稀)(棕黄色)(2)铁与氯气的反应 现象:剧烈燃烧,生成褐色的烟。 加水后,溶液呈
反应方程式 : 黄色。练一练写出氯气与下列金属反应的化学方程式Mg + Cl2
Al + Cl2
(1)氯气与氢气的反应 现象:安静的燃烧,火焰呈苍白色,
瓶口有白雾产生2、与非金属单质反应① 氢气在氯气中燃烧 反应方程式 : 工业制盐酸② 氢气与氯气的混合气体在强光下 现象:释放大量的热,发生爆炸。讨论1、工业制盐酸条件?2、左图是工业制盐酸使
用的燃烧管:A处通何种气体?
B处通何种气体?
先通谁? 如何防止Cl2溢出?工业用氯气和氢气化合制盐酸概念拓展:——任何发光发热的剧烈的化学反应燃烧常见助燃剂:O2 、 Cl2小结:Cl2是很活泼的非金属单质:
能与多种金属单质、非金属单质化合
表现强氧化性 氯气的水溶液叫氯水。请仔细观察,并根据已学的知识推测氯水中可能含有的分子和离子?氯 水3.与水反应:氯 水 水分子、含有的分子:
含有的离子: 氯气分子H+ Cl-、 如何检验可能含有的Cl-和H+呢?请设计最合理的实验方案。请思考:推测:氯 水检验Cl-离子的实验设计: 往氯水中滴加AgNO3溶液和稀HNO3溶液,如果有白色浑浊或沉淀出现,则说明氯水中含有Cl-离子。实验现象:有白色的浑浊出现实验结论:氯水中含有Cl-离子氯 水 将氯水加入紫色石蕊试液中,如紫色石蕊试液变红,则说明氯水中含有H+离子。检验H+离子的实验设计:实验现象:实验结论:紫色石蕊试液先变红,后马上褪色。先变红说明氯水中含有H+,后褪色说明在氯水中存在着具有漂白性的物质。氯 水说明在氯水中存在着具有漂白性的物质石蕊试液为什么会褪色呢?氯 水 思考:该漂白性物质是Cl2本身,还是Cl2与H2O反应的生成的新物质?请设计合理的实验方案检验之。氯 水漂白性实验设计:1.在干燥的氯气瓶中放入一干燥的有色纸条。2.在干燥的氯气瓶中放入一湿润的有色纸条。实验现象:干燥的有色纸条未褪色,而湿润的有色纸条褪色。实验结论:具有漂白性的物质不是Cl2本身,而是Cl2与H2O反应的生成物HClO。次氯酸 1、 次氯酸是一元弱酸,属于电解质,酸性弱于碳酸。 2、次氯酸不稳定,容易分解放出氧气。当氯水受到日光照射时,次氯酸的分解速率加快。 3、次氯酸具有强氧化性,因此可用来杀菌消毒和漂白有色物质。2.新制氯水中含有的粒子:3.久置氯水中含有的粒子:H2O 、H+、Cl-分子:Cl2、H2O、HClO
离子:Cl-、 H+、 ClO- 、OH -1.氯气与水的反应的方程式及离子方程式:小结:完成下列表格:气态液态液态Cl2分子 纯净物纯净物混合物Cl2分子 无无有H2O、 Cl2、HClOCl-、 H+、 ClO- 、OH -练习:混合物液态H2O、 Cl-、 H+无思考: 氯气和水反应生成HCl和HClO,试分析氯气和碱溶液会不会反应?如果能反应,则反应的生成物将会是什么? 4.与碱反应: 氯气与碱溶液反应生成
次氯酸盐,金属氯化物和水1.请写出Cl2和NaOH溶液反应的化学方程式:2.请写出Cl2和石灰乳反应的化学方程式:Cl2+2NaOH====NaCl+NaClO+H2O练习:【其有效成分是Ca(ClO)2 】 4.与碱反应: :
(1)用于自来水的杀菌消毒,1升水里约通人0.002克氯气;
(2)用于工业上制盐酸和漂白粉;
(3)用于制造多种农药,制造氯仿等有机溶剂
所以,氯气是一种重要的化工原料。
氯气的用途总结一、物理性质
氯气是一种黄绿色有刺激性气味的气体,有毒,密度比空气大,能溶于水,易液化。
二、化学性质1、与金属单质反应Cu + Cl2 = CuCl2点燃2、与非金属单质反应3.与水反应:4.与碱反应巩固练习:1.下列物质不具有漂白作用的是( )
A. 氯水 B. Ca(ClO)2
C. NaClO溶液 D. 过氧化钠
E. 活性炭 F. 液氯BF巩固练习:2.氯水可用来消毒、杀菌,又可作为漂白剂,其中起主要作用的是( )
A.Cl2 B.HClO C.HCl D.H2OB3.下列关于氯水的说法正确的是( )
A.新制的氯水只含有氯气分子和水分子
B.新制氯水可使紫色石蕊试液先变红后褪色
C.光照氯水有气泡逸出,该气体主要是氯气
D.新制氯水久置后酸性增强,几乎无漂白性 BD4.下列物质中含有Cl-的是( )
A.液氯 B.氯水
C.KClO溶液 D.CuCl2溶液
E.KClO3溶液 BD巩固练习:5.用自来水养鱼时,将氯水注入鱼缸前需在阳光 下曝晒一段时间,主要目的是( )
A.起杀菌作用 B.使水中的HClO分解
C.提高水温 D.增加水中O2的含量B巩固练习:6.漂白粉制取原理的反应方程式是 ;
漂白粉的成分是 ;有效成分是 ;漂白粉放置在空气中失效的方程是 。Ca(ClO)2+CO2+H2O====CaCO3↓+2HClO2Cl2+2Ca(OH)2=====CaCl2+Ca(ClO)2+2H2OCaCl2和Ca(ClO)2Ca(ClO)2久置氯水还有漂白性吗?思考: Cl-离子和Ag+离子反应生成难溶于酸白色AgCl沉淀,根据这一特性来检验Cl-离子。 与碱反应;与碱性氧化物反应;与活泼的金属反应;与碳酸盐或碳酸氢盐反应;用酸碱指示剂。Cl-离子的特性:H+离子的性质:再见!
氯、溴、碘及其化合物 实验原理:
本实验的总反应是:氯化钠跟水发生
电解反应,生成的氢氧化钠和氢气在阴极,
生成的氯气在阳极。 1、氯气的工业制法一、氯气的生产原理氯气的工业制法观察与思考电解饱和食盐水1、将实验中观察到的现象和所得结论填入下表
结论(1)(2) (3)(4)铁棒和碳棒上通电后有气泡产生通电后有新的气体物质生成铁棒周围的颜色变红有碱性物质生成将铁棒上方收集到的气体靠近火焰,有爆鸣声有氢气生成淀粉碘化钾溶液变蓝,黄绿色气体,闻到有刺激性气味有氯气生成实验现象
2、根据上述实验现象和分析结果,写出电解氯化钠溶液的化学方程式:
2NaCl+2H2O===2NaOH+ H2↑+ Cl2↑通电阳离子交换膜电解槽电解槽离子交换膜的作用: (1)防止氯气和氢气混合而引起爆炸 (2)避免氯气与氢氧化钠反应影响氢氧化钠的产量 根据氯碱厂原料和产品的性质,你认为在生产过程中和贮运时应注意哪些问题?氯碱厂的厂址应如何选择? 调查研究 厂址的选择:现代化工生产要求有较大的生产规模;厂址选择涉及原料、水源、能源、土地供应、市场需求、交通运输、环境保护等因素,应对这些因素综合考虑,作出合理的抉择。由于氯气有毒,不便贮存和运输,因此要求厂址应避开人口稠密的居民区和环境保护要求高的地区,厂区必须与居民区有一定距离的安全隔离带。 化学式:Cl2观察与思考舍勒 (1742~1786)瑞典化学家。
1774年舍勒 发现氯气
他将这种元素命名为Chlorine,这个名称
来自希腊文,有“绿色”的意思。我国早
年译文将其译成“绿气”,后改为氯气。氯 气2、氯气的实验室制法(1)实验原理:MnO2 + 4HCl(浓) = MnCl2 + Cl2 ↑ + 2H2O
(2)发生装置:
粉末状固体或液体+液体 气体(3)除杂装置:饱和食盐水(4)干燥装置:浓硫酸(5)收集装置:向上排空气法或排饱和食 盐水法(6)尾气处理:用氢氧化钠溶液吸收反馈平台1、如图,A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,接通电路后,发现B上的c点显红色,请填空:
(1)电源的A的a为 极;
(2)滤纸B上发生的总反应方程式为:
正 电解
2NaCl + 2H2O = 2NaOH + H2↑+ Cl2↑
KABabcd2 某学生设计如下实验装置用于制备纯净的氯气。 ②在更正后的装置图中:
(1)饱和食盐水的作用????????????????????????????????????? ;
(2)浓硫酸的作用????????????????????????????????????? ;
(3)氢氧化钠的作用????????????????????????????????????? 。铁架台上未加点燃的酒精灯铁圈上未放置石棉网 不应用稀盐酸 盛浓硫酸和盛饱和食盐水的两只洗气瓶位置错误 盛浓硫酸 的洗气瓶中的进气导管和出气导管连接错误洗去氯气中所含的少量氯化氢气体 可以除去氯气 中水蒸气 吸收多余氯气防止污染空气不应使用长颈漏斗氯 气?
重
庆
天
原
化
工
总
厂 氯气重庆氯气泄漏抢险纪实:
命悬一线 15万人大转移
新华网重庆4月17日(记者黄豁 张琴)16日凌晨,当繁华的山城已沉入梦乡的时候,一场意想不到的危险却悄然降临了。“嘭!”重庆天原化工总厂在寂静的黑夜中发出一声闷响,厂里2号氯冷凝器发生爆炸,黄绿色的氯气如同从瓶中释放的魔鬼弥漫开来。下午17时57分,正在抢险的化工厂再次发生爆炸,当即造成死亡和失踪9人……
不同浓度的氯气对人体的危害 大气中氯气的浓度不得超过0.1mg/m3,生产车间不超过1mg/m3 居民区不超过0.03mg/m3。
如果中毒,保持安静,注意保温,吸入少量乙醇和乙醚蒸汽或氨气。氯 气一、物理性质二、化学性质三 、氯气的用途一、物理性质颜色:
状态:
气味:
密度:
溶解性:
(水中)黄绿色刺激气味气体比空气大能溶于水(1:2) 易液化 : 黄色油状液体 ( 液氯)
(闻?)二、化学性质结构分析:活泼的非金属单质ClCl_+ e-(1)铜与氯气的反应 现象:剧烈燃烧,生成棕黄色的烟。 反应方程式 : 加水后,溶液 呈蓝绿色(浓)或蓝色(稀)(棕黄色)(2)铁与氯气的反应 现象:剧烈燃烧,生成褐色的烟。 加水后,溶液呈
反应方程式 : 黄色。练一练写出氯气与下列金属反应的化学方程式Mg + Cl2
Al + Cl2
(1)氯气与氢气的反应 现象:安静的燃烧,火焰呈苍白色,
瓶口有白雾产生2、与非金属单质反应① 氢气在氯气中燃烧 反应方程式 : 工业制盐酸② 氢气与氯气的混合气体在强光下 现象:释放大量的热,发生爆炸。讨论1、工业制盐酸条件?2、左图是工业制盐酸使
用的燃烧管:A处通何种气体?
B处通何种气体?
先通谁? 如何防止Cl2溢出?工业用氯气和氢气化合制盐酸概念拓展:——任何发光发热的剧烈的化学反应燃烧常见助燃剂:O2 、 Cl2小结:Cl2是很活泼的非金属单质:
能与多种金属单质、非金属单质化合
表现强氧化性 氯气的水溶液叫氯水。请仔细观察,并根据已学的知识推测氯水中可能含有的分子和离子?氯 水3.与水反应:氯 水 水分子、含有的分子:
含有的离子: 氯气分子H+ Cl-、 如何检验可能含有的Cl-和H+呢?请设计最合理的实验方案。请思考:推测:氯 水检验Cl-离子的实验设计: 往氯水中滴加AgNO3溶液和稀HNO3溶液,如果有白色浑浊或沉淀出现,则说明氯水中含有Cl-离子。实验现象:有白色的浑浊出现实验结论:氯水中含有Cl-离子氯 水 将氯水加入紫色石蕊试液中,如紫色石蕊试液变红,则说明氯水中含有H+离子。检验H+离子的实验设计:实验现象:实验结论:紫色石蕊试液先变红,后马上褪色。先变红说明氯水中含有H+,后褪色说明在氯水中存在着具有漂白性的物质。氯 水说明在氯水中存在着具有漂白性的物质石蕊试液为什么会褪色呢?氯 水 思考:该漂白性物质是Cl2本身,还是Cl2与H2O反应的生成的新物质?请设计合理的实验方案检验之。氯 水漂白性实验设计:1.在干燥的氯气瓶中放入一干燥的有色纸条。2.在干燥的氯气瓶中放入一湿润的有色纸条。实验现象:干燥的有色纸条未褪色,而湿润的有色纸条褪色。实验结论:具有漂白性的物质不是Cl2本身,而是Cl2与H2O反应的生成物HClO。次氯酸 1、 次氯酸是一元弱酸,属于电解质,酸性弱于碳酸。 2、次氯酸不稳定,容易分解放出氧气。当氯水受到日光照射时,次氯酸的分解速率加快。 3、次氯酸具有强氧化性,因此可用来杀菌消毒和漂白有色物质。2.新制氯水中含有的粒子:3.久置氯水中含有的粒子:H2O 、H+、Cl-分子:Cl2、H2O、HClO
离子:Cl-、 H+、 ClO- 、OH -1.氯气与水的反应的方程式及离子方程式:小结:完成下列表格:气态液态液态Cl2分子 纯净物纯净物混合物Cl2分子 无无有H2O、 Cl2、HClOCl-、 H+、 ClO- 、OH -练习:混合物液态H2O、 Cl-、 H+无思考: 氯气和水反应生成HCl和HClO,试分析氯气和碱溶液会不会反应?如果能反应,则反应的生成物将会是什么? 4.与碱反应: 氯气与碱溶液反应生成
次氯酸盐,金属氯化物和水1.请写出Cl2和NaOH溶液反应的化学方程式:2.请写出Cl2和石灰乳反应的化学方程式:Cl2+2NaOH====NaCl+NaClO+H2O练习:【其有效成分是Ca(ClO)2 】 4.与碱反应: :
(1)用于自来水的杀菌消毒,1升水里约通人0.002克氯气;
(2)用于工业上制盐酸和漂白粉;
(3)用于制造多种农药,制造氯仿等有机溶剂
所以,氯气是一种重要的化工原料。
氯气的用途总结一、物理性质
氯气是一种黄绿色有刺激性气味的气体,有毒,密度比空气大,能溶于水,易液化。
二、化学性质1、与金属单质反应Cu + Cl2 = CuCl2点燃2、与非金属单质反应3.与水反应:4.与碱反应巩固练习:1.下列物质不具有漂白作用的是( )
A. 氯水 B. Ca(ClO)2
C. NaClO溶液 D. 过氧化钠
E. 活性炭 F. 液氯BF巩固练习:2.氯水可用来消毒、杀菌,又可作为漂白剂,其中起主要作用的是( )
A.Cl2 B.HClO C.HCl D.H2OB3.下列关于氯水的说法正确的是( )
A.新制的氯水只含有氯气分子和水分子
B.新制氯水可使紫色石蕊试液先变红后褪色
C.光照氯水有气泡逸出,该气体主要是氯气
D.新制氯水久置后酸性增强,几乎无漂白性 BD4.下列物质中含有Cl-的是( )
A.液氯 B.氯水
C.KClO溶液 D.CuCl2溶液
E.KClO3溶液 BD巩固练习:5.用自来水养鱼时,将氯水注入鱼缸前需在阳光 下曝晒一段时间,主要目的是( )
A.起杀菌作用 B.使水中的HClO分解
C.提高水温 D.增加水中O2的含量B巩固练习:6.漂白粉制取原理的反应方程式是 ;
漂白粉的成分是 ;有效成分是 ;漂白粉放置在空气中失效的方程是 。Ca(ClO)2+CO2+H2O====CaCO3↓+2HClO2Cl2+2Ca(OH)2=====CaCl2+Ca(ClO)2+2H2OCaCl2和Ca(ClO)2Ca(ClO)2久置氯水还有漂白性吗?思考: Cl-离子和Ag+离子反应生成难溶于酸白色AgCl沉淀,根据这一特性来检验Cl-离子。 与碱反应;与碱性氧化物反应;与活泼的金属反应;与碳酸盐或碳酸氢盐反应;用酸碱指示剂。Cl-离子的特性:H+离子的性质:再见!
