第二单元 含硫化合物的性质和应用 复习
图片预览










文档简介
课件45张PPT。专题三 非金属元素及化合物性质和应用第二单元 含硫化合物的性质和应用2009.8.14S S S S-2 0 +4 +6 FeS
H2SSO2
H2SO3
Na2SO3SO3
H2SO4
Na2SO4
BaSO4S 最高价(+6)只有氧化性,最低价(-2)只具有还原性; 中间价(0、+4)既具有氧化性,又具有还原性。你知道哪些含硫化合物,按化合价对它们进行分类 如果从化合价的角度来考虑,物质什么时候具有氧化性或者还原性?黄色固体,很脆,易研成粉末,
不溶于水,微溶于酒精,易溶于CS2硫单质的化性1、跟金属反应:能跟大多数金属反应2Na+S=Na2S (加热或研磨爆炸)Hg+S=HgS (红色)(常温下反应 ,除汞)变价金属为低价2Ag+S=Ag2S(黑色、银器变黑)2、跟非金属反应3、跟其他物质反应①S跟碱反应可用于清除硫②S跟强氧化剂反应硫是一种比较活泼的非金属单质
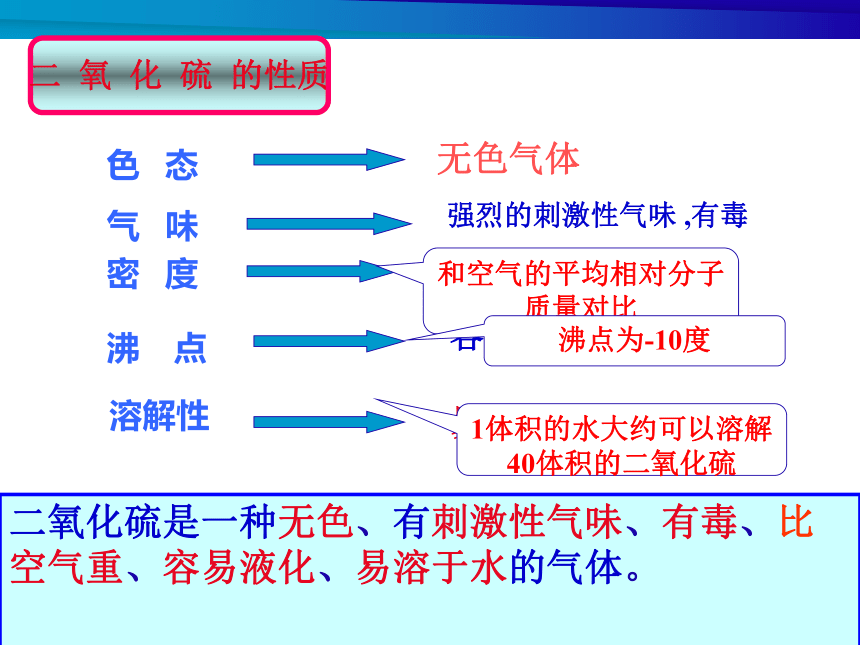
既可表现氧化性,又可表现还原性气 味密 度溶解性沸 点和空气的平均相对分子质量对比沸点为-10度1体积的水大约可以溶解40体积的二氧化硫二氧化硫是一种无色、有刺激性气味、有毒、比 空气重、容易液化、易溶于水的气体。
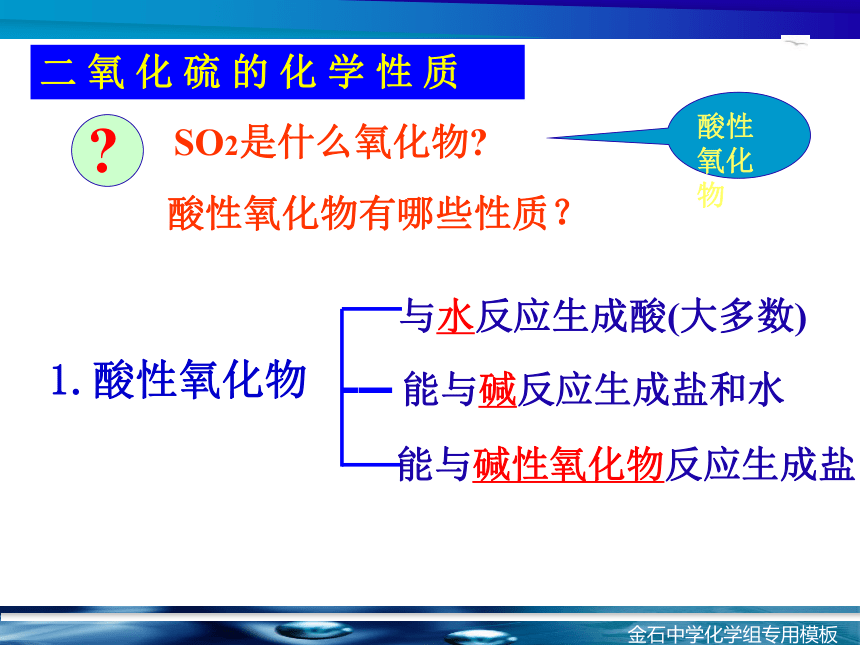
色 态二 氧 化 硫 的性质二 氧 化 硫 的 化 学 性 质1.酸性氧化物SO2是什么氧化物?酸性氧化物有哪些性质?酸性氧化物
?能与碱性氧化物反应生成盐能与碱反应生成盐和水与水反应生成酸(大多数) 写出SO2和NaOH反应的化学方程式。写出SO2和Na2O和CaO反应的化学方程式。SO2 + Na2O = Na2SO3SO2 十 CaO= CaSO3SO2 (少量) +2NaOH=Na2SO3+H2OSO2 (过量) +NaOH=NaHSO3+4根据SO2中S的化合价推断它具有怎样的性质?既有氧化性,又有还原性-20+6结论思考H2S S SO2 SO3现象:结论:反应:滴加BaCl2没有明显现象
滴加H2O2有白色沉淀生成
加盐酸后白色沉淀不消失 H2SO3容易被H2O2氧化生成硫酸2. SO2的还原性SO2+ H2O2 = H2SO4
H2SO4 + BaCl2 =BaSO4↓ +2HClSO2 +Cl2 +2H2O = H2SO4+2HCl (氯水褪色)写出SO2 与O2 Cl2 的反应SO2 + X 2+ 2H2O == H2SO4 + 2HX ( X = Cl、Br、I )3. SO2的氧化性SO2+2H2S = 3S + 2H2O4. SO2的漂白性 实 验
向试管中加入5ml SO2水溶液,滴加品红溶液,振荡,然后加热试管,比较前后溶液颜色的变化。
现象:品红溶液褪色,
加热后溶液变回红色漂白机理:SO2 与某些有色物质化合生成无色 物质,但是这些无色物质不稳定,容易分解而恢复原来的颜色 。HClO ,Na2O2 ,O3,H2O2
活性炭
SO2———氧化漂白
——— 吸附漂白
———化合漂白酸雨的形成与防治1、酸雨的形成原因及过程:2、酸雨的防治:燃煤烟气的脱硫方法:(1)石灰-石膏法(2)氨水法1、SO42-的检验:
2、SO32-的检验:SO42-、SO32-的检验 三位学生设计了三个方案,并都认为,如果观察到的现象
和自己设计的方案一致,即可确证试液中有SO42-
方案甲:试液 白色 沉淀不溶解
方案乙:试液 无沉淀 白色沉淀
方案丙:试液 无沉淀 白色沉淀
试评述上述三种方案是否严谨,并说明理由。BaCl2溶液足量稀盐酸Ba(NO3)2溶液足量稀硝酸如有Ag+ ,会有AgCl白色沉淀生成,它不溶于水,不溶于酸。 先加盐酸无沉淀,排除Ag+的存在,再加BaCl2溶液,在酸性溶液中生成白色沉淀,证明有SO42-。 如有SO32- , 会被硝酸氧化成SO42- ,加Ba(NO3)2溶液生成白色沉淀。最佳方案练习 1下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
都是酸性氧化物,都可以使石蕊变红SO2有刺激性气味,而CO2没有都可以使澄清石灰水变浑浊SO2可使品红褪色,而CO2不能 B D硫酸工业生产的原理第一步:第二步:第三步:硫酸的性质硫酸工业生产流程动画 硫酸的工业生产沸 腾 炉接 触 室吸 收 塔净化冷 却知识回顾稀硫酸具有哪些酸的通性与酸碱指示剂反应 与活泼金属反应与碱性氧化物反应与碱反应与盐反应Zn+ H2SO4(稀) = ZnSO4 + H2↑CuO + H2SO4 (稀) = CuSO4+H2O2NaOH + H2SO4 (稀) = Na2SO4+2H2OBaCl2 + H2SO4 (稀) = BaSO4 ↓+2HClH2SO4====2H++SO42- 石蕊、酚酞 浓 硫 酸 的 性 质一、浓硫酸的物理性质 颜 色 : 状 态 :沸 点 :挥发性:溶解度:密 度 :无 色油状液体高沸点(338?C)比水大难挥发易溶于水,能与水以任意比混合,溶解时放出大量的热。常用的浓硫酸质量分数为98.3%,其密度为1.84g/cm3,其物质的量浓度约为18.4mol/L。 稀释浓硫酸时应该如何操作?正确操作:将浓硫酸沿器壁慢慢注入水中,并用玻棒不断搅拌,使产生的热量迅速扩散。“酸入水,沿器壁,慢慢倒,及时搅”切不可将水倒入浓硫酸里!原 因ρ水<ρ浓硫酸,若水注入酸中,水会浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅,会造成不良事故。不慎将浓硫酸沾到皮肤上,我们该怎么办?立即用大量水冲洗,以冲稀浓硫酸的浓度,然后涂上3%—5%的碳酸氢钠溶液。处理方法气体干燥剂浓硫酸气体 →
1、浓硫酸的吸水性浓硫酸的特性 [探索] 浓硫酸具有难挥发性,若将装有浓硫酸的试剂瓶瓶塞打开,放置一段时间后,其浓度和质量是否不变呢? 质量会 ,浓度会 。 保存方法: 增加降低密封保存作干燥剂(实验室中常用来干燥不与它起反应的气体) 应 用如:O2、H2、Cl2、 N2 、HCl、SO2、O2 、CH4等不能用浓硫酸干燥的气体: 碱性气体:如 NH3还原性气体:如 H2S、HBr、HI 在胆矾(CuSO4 · 5H2 O)中滴入浓硫酸,胆矾有何变化? 蓝色 白色
现象:蔗糖变黑;体积急剧膨胀;形成疏松多孔的海绵状的炭;放出大量热;产生有刺激性气味的气体。 2、浓硫酸的脱水性比较 浓硫酸的吸水性和脱水性有什么区别?如:空气中的水分、物质中的湿存水、结晶水合物中的结晶水等,形成硫酸的水合物。 H2SO4 + nH2O = H2SO4?nH2O原来就有水原来没有水 是指浓硫酸吸收现成游离的水分子。 是指浓硫酸将有机物中的H、O按原子个数比2:1(即水的组成比例)脱去。脱水性吸水性[过渡]浓硫酸使蔗糖脱水后,反应放出的热量,使生成的碳继续被浓硫酸氧化。 2e-3、浓硫酸的强氧化性a、与金属反应现象: 加热能反应,铜片表面有气体产生,产生的气体能使品红溶液褪色,溶液稀释后呈蓝色。请标出该反应的氧化还原情况Cu + 2H2SO4(浓)==CuSO4 + SO2 ↑ + 2H2O?0+6+2+4+6升价,失2e—,被氧化 降价,得2e—,被还原还原剂氧化剂注 意(1)参加反应的浓硫酸只有1/2被还原;(2)在与铜的反应中,浓硫酸既表现出强氧化性,又表现出酸性;(4)该化学方程式不能改写成离子方程式。(3)随着反应的进行,浓硫酸变稀而不反应; 常温下,浓硫酸能使某些金属(如铁、铝等)表面生成一层致密的氧化物保护膜,从而阻止内部的金属继续跟硫酸起反应,此现象称为“钝化”。工业上可以用铝槽车盛放、运输浓硫酸! a、与金属反应①在加热条件下,可与绝大多数金属反应(Au、Pt除外),产生的气体是SO2气体,不是H2 ;③常温下,浓硫酸可使铁、Al钝化。②与金属反应时浓硫酸表现酸性和氧化性;想一想:
为什么蔗糖脱水后变得疏松多孔?b、与某些非金属单质反应试分析下列反应的氧化还原情况C + 2H2SO4(浓)== CO2↑ + 2SO2↑ +2H2O 0+6+4+4升价,失4e—,被氧化降价,得4e—,被还原还原剂 氧化剂注
意(1)参加反应的浓硫酸全部被还原;(2)与单质C的反应中,浓硫酸只表现出氧化性。想一想:C+2H2SO4 (浓)===CO2↑+2SO2 ↑+2H2O 0氧化性+4 课后思考:如何设计实验验证
上述反应产物 ?+6+4启发思维:1.考虑每个装置在检验过程中所起的作用?2.考虑这些产物时应有怎样的先后顺序?3.检验CO2时怎样排除SO2的干扰?C+2H2SO4(浓)===CO2↑+2SO2 ↑+H2OC与浓硫酸反应产物的鉴别C+2H2SO4(浓)===CO2↑+2SO2 ↑+H2O思考:氧化产物与还原产物的物质的量之比2HBr + H2SO4(浓)= Br2+ SO2↑+ 2H2O c、与某些化合物反应2NH3 + H2SO4 (浓)= (NH4)2 SO4 2HI + H2SO4(浓)= I2+ SO2↑+ 2H2O 填表比较:浓硫酸和稀硫酸和组成和性质大,98.3%小H2SO4分子H+、SO42-加热反应不反应常温钝化,加热反应反应生成H2加热反应不反应S+6H+1SO2H2强弱吸水性脱水性强氧化性酸的通性几种重要的硫酸盐CaSO4·2H2O 生石膏
2CaSO4·H2O 熟石膏
BaSO4 重晶石
CuSO4·5H2O 胆矾
FeSO4 绿矾
KAl(SO4)2·12H2O 明矾
NaSO4·10H2O 芒硝
H2SSO2
H2SO3
Na2SO3SO3
H2SO4
Na2SO4
BaSO4S 最高价(+6)只有氧化性,最低价(-2)只具有还原性; 中间价(0、+4)既具有氧化性,又具有还原性。你知道哪些含硫化合物,按化合价对它们进行分类 如果从化合价的角度来考虑,物质什么时候具有氧化性或者还原性?黄色固体,很脆,易研成粉末,
不溶于水,微溶于酒精,易溶于CS2硫单质的化性1、跟金属反应:能跟大多数金属反应2Na+S=Na2S (加热或研磨爆炸)Hg+S=HgS (红色)(常温下反应 ,除汞)变价金属为低价2Ag+S=Ag2S(黑色、银器变黑)2、跟非金属反应3、跟其他物质反应①S跟碱反应可用于清除硫②S跟强氧化剂反应硫是一种比较活泼的非金属单质
既可表现氧化性,又可表现还原性气 味密 度溶解性沸 点和空气的平均相对分子质量对比沸点为-10度1体积的水大约可以溶解40体积的二氧化硫二氧化硫是一种无色、有刺激性气味、有毒、比 空气重、容易液化、易溶于水的气体。
色 态二 氧 化 硫 的性质二 氧 化 硫 的 化 学 性 质1.酸性氧化物SO2是什么氧化物?酸性氧化物有哪些性质?酸性氧化物
?能与碱性氧化物反应生成盐能与碱反应生成盐和水与水反应生成酸(大多数) 写出SO2和NaOH反应的化学方程式。写出SO2和Na2O和CaO反应的化学方程式。SO2 + Na2O = Na2SO3SO2 十 CaO= CaSO3SO2 (少量) +2NaOH=Na2SO3+H2OSO2 (过量) +NaOH=NaHSO3+4根据SO2中S的化合价推断它具有怎样的性质?既有氧化性,又有还原性-20+6结论思考H2S S SO2 SO3现象:结论:反应:滴加BaCl2没有明显现象
滴加H2O2有白色沉淀生成
加盐酸后白色沉淀不消失 H2SO3容易被H2O2氧化生成硫酸2. SO2的还原性SO2+ H2O2 = H2SO4
H2SO4 + BaCl2 =BaSO4↓ +2HClSO2 +Cl2 +2H2O = H2SO4+2HCl (氯水褪色)写出SO2 与O2 Cl2 的反应SO2 + X 2+ 2H2O == H2SO4 + 2HX ( X = Cl、Br、I )3. SO2的氧化性SO2+2H2S = 3S + 2H2O4. SO2的漂白性 实 验
向试管中加入5ml SO2水溶液,滴加品红溶液,振荡,然后加热试管,比较前后溶液颜色的变化。
现象:品红溶液褪色,
加热后溶液变回红色漂白机理:SO2 与某些有色物质化合生成无色 物质,但是这些无色物质不稳定,容易分解而恢复原来的颜色 。HClO ,Na2O2 ,O3,H2O2
活性炭
SO2———氧化漂白
——— 吸附漂白
———化合漂白酸雨的形成与防治1、酸雨的形成原因及过程:2、酸雨的防治:燃煤烟气的脱硫方法:(1)石灰-石膏法(2)氨水法1、SO42-的检验:
2、SO32-的检验:SO42-、SO32-的检验 三位学生设计了三个方案,并都认为,如果观察到的现象
和自己设计的方案一致,即可确证试液中有SO42-
方案甲:试液 白色 沉淀不溶解
方案乙:试液 无沉淀 白色沉淀
方案丙:试液 无沉淀 白色沉淀
试评述上述三种方案是否严谨,并说明理由。BaCl2溶液足量稀盐酸Ba(NO3)2溶液足量稀硝酸如有Ag+ ,会有AgCl白色沉淀生成,它不溶于水,不溶于酸。 先加盐酸无沉淀,排除Ag+的存在,再加BaCl2溶液,在酸性溶液中生成白色沉淀,证明有SO42-。 如有SO32- , 会被硝酸氧化成SO42- ,加Ba(NO3)2溶液生成白色沉淀。最佳方案练习 1下列可以用来鉴别SO2 和CO2 的方法是[ ]
A、通入紫色石蕊试液 B、闻气味
C、通入澄清石灰水 D、通入品红溶液中
都是酸性氧化物,都可以使石蕊变红SO2有刺激性气味,而CO2没有都可以使澄清石灰水变浑浊SO2可使品红褪色,而CO2不能 B D硫酸工业生产的原理第一步:第二步:第三步:硫酸的性质硫酸工业生产流程动画 硫酸的工业生产沸 腾 炉接 触 室吸 收 塔净化冷 却知识回顾稀硫酸具有哪些酸的通性与酸碱指示剂反应 与活泼金属反应与碱性氧化物反应与碱反应与盐反应Zn+ H2SO4(稀) = ZnSO4 + H2↑CuO + H2SO4 (稀) = CuSO4+H2O2NaOH + H2SO4 (稀) = Na2SO4+2H2OBaCl2 + H2SO4 (稀) = BaSO4 ↓+2HClH2SO4====2H++SO42- 石蕊、酚酞 浓 硫 酸 的 性 质一、浓硫酸的物理性质 颜 色 : 状 态 :沸 点 :挥发性:溶解度:密 度 :无 色油状液体高沸点(338?C)比水大难挥发易溶于水,能与水以任意比混合,溶解时放出大量的热。常用的浓硫酸质量分数为98.3%,其密度为1.84g/cm3,其物质的量浓度约为18.4mol/L。 稀释浓硫酸时应该如何操作?正确操作:将浓硫酸沿器壁慢慢注入水中,并用玻棒不断搅拌,使产生的热量迅速扩散。“酸入水,沿器壁,慢慢倒,及时搅”切不可将水倒入浓硫酸里!原 因ρ水<ρ浓硫酸,若水注入酸中,水会浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅,会造成不良事故。不慎将浓硫酸沾到皮肤上,我们该怎么办?立即用大量水冲洗,以冲稀浓硫酸的浓度,然后涂上3%—5%的碳酸氢钠溶液。处理方法气体干燥剂浓硫酸气体 →
1、浓硫酸的吸水性浓硫酸的特性 [探索] 浓硫酸具有难挥发性,若将装有浓硫酸的试剂瓶瓶塞打开,放置一段时间后,其浓度和质量是否不变呢? 质量会 ,浓度会 。 保存方法: 增加降低密封保存作干燥剂(实验室中常用来干燥不与它起反应的气体) 应 用如:O2、H2、Cl2、 N2 、HCl、SO2、O2 、CH4等不能用浓硫酸干燥的气体: 碱性气体:如 NH3还原性气体:如 H2S、HBr、HI 在胆矾(CuSO4 · 5H2 O)中滴入浓硫酸,胆矾有何变化? 蓝色 白色
现象:蔗糖变黑;体积急剧膨胀;形成疏松多孔的海绵状的炭;放出大量热;产生有刺激性气味的气体。 2、浓硫酸的脱水性比较 浓硫酸的吸水性和脱水性有什么区别?如:空气中的水分、物质中的湿存水、结晶水合物中的结晶水等,形成硫酸的水合物。 H2SO4 + nH2O = H2SO4?nH2O原来就有水原来没有水 是指浓硫酸吸收现成游离的水分子。 是指浓硫酸将有机物中的H、O按原子个数比2:1(即水的组成比例)脱去。脱水性吸水性[过渡]浓硫酸使蔗糖脱水后,反应放出的热量,使生成的碳继续被浓硫酸氧化。 2e-3、浓硫酸的强氧化性a、与金属反应现象: 加热能反应,铜片表面有气体产生,产生的气体能使品红溶液褪色,溶液稀释后呈蓝色。请标出该反应的氧化还原情况Cu + 2H2SO4(浓)==CuSO4 + SO2 ↑ + 2H2O?0+6+2+4+6升价,失2e—,被氧化 降价,得2e—,被还原还原剂氧化剂注 意(1)参加反应的浓硫酸只有1/2被还原;(2)在与铜的反应中,浓硫酸既表现出强氧化性,又表现出酸性;(4)该化学方程式不能改写成离子方程式。(3)随着反应的进行,浓硫酸变稀而不反应; 常温下,浓硫酸能使某些金属(如铁、铝等)表面生成一层致密的氧化物保护膜,从而阻止内部的金属继续跟硫酸起反应,此现象称为“钝化”。工业上可以用铝槽车盛放、运输浓硫酸! a、与金属反应①在加热条件下,可与绝大多数金属反应(Au、Pt除外),产生的气体是SO2气体,不是H2 ;③常温下,浓硫酸可使铁、Al钝化。②与金属反应时浓硫酸表现酸性和氧化性;想一想:
为什么蔗糖脱水后变得疏松多孔?b、与某些非金属单质反应试分析下列反应的氧化还原情况C + 2H2SO4(浓)== CO2↑ + 2SO2↑ +2H2O 0+6+4+4升价,失4e—,被氧化降价,得4e—,被还原还原剂 氧化剂注
意(1)参加反应的浓硫酸全部被还原;(2)与单质C的反应中,浓硫酸只表现出氧化性。想一想:C+2H2SO4 (浓)===CO2↑+2SO2 ↑+2H2O 0氧化性+4 课后思考:如何设计实验验证
上述反应产物 ?+6+4启发思维:1.考虑每个装置在检验过程中所起的作用?2.考虑这些产物时应有怎样的先后顺序?3.检验CO2时怎样排除SO2的干扰?C+2H2SO4(浓)===CO2↑+2SO2 ↑+H2OC与浓硫酸反应产物的鉴别C+2H2SO4(浓)===CO2↑+2SO2 ↑+H2O思考:氧化产物与还原产物的物质的量之比2HBr + H2SO4(浓)= Br2+ SO2↑+ 2H2O c、与某些化合物反应2NH3 + H2SO4 (浓)= (NH4)2 SO4 2HI + H2SO4(浓)= I2+ SO2↑+ 2H2O 填表比较:浓硫酸和稀硫酸和组成和性质大,98.3%小H2SO4分子H+、SO42-加热反应不反应常温钝化,加热反应反应生成H2加热反应不反应S+6H+1SO2H2强弱吸水性脱水性强氧化性酸的通性几种重要的硫酸盐CaSO4·2H2O 生石膏
2CaSO4·H2O 熟石膏
BaSO4 重晶石
CuSO4·5H2O 胆矾
FeSO4 绿矾
KAl(SO4)2·12H2O 明矾
NaSO4·10H2O 芒硝
