化学平衡移动原理及应用
图片预览







文档简介
课件28张PPT。2010年高考第一轮复习浙江省乐清中学 盛定华化学平衡移动原理及应用(一)考试大纲要求: 1、掌握浓度、温度、压强等条件对化
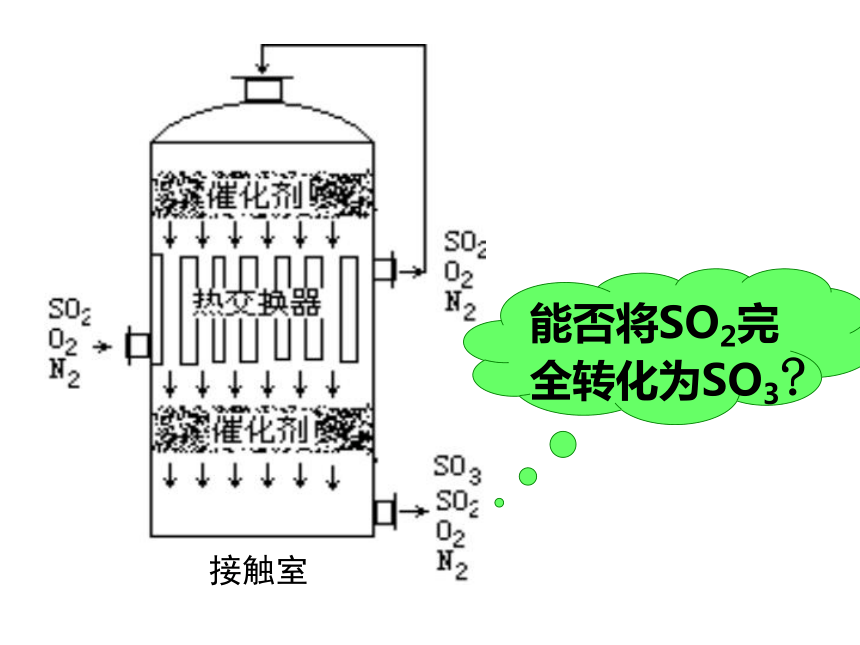
学平衡移动的影响2、理解勒夏特列原理的涵义能否将SO2完全转化为SO3?
接触室硫酸工业中的接触氧化反应原理:
O2(g) + 2SO2(g) 2SO3(g) ;△H < 0 讨论:
(1)往体积固定的密闭容器中加入O2,平衡将向____方向移动,SO2的转化率将________;
(2)往体积固定的密闭容器中加入SO2,平衡将向____方向移动,SO2的转化率将______; 知识重现正增大正减小讨论:
(3)升高温度,平衡将向____方向移动,
(4)增大压强,平衡将向____方向移动, 知识重现逆正硫酸工业中的接触氧化反应原理:
O2(g) + 2SO2(g) 2SO3(g) ;△H < 0 (5)恒温恒容下,充入“惰性”气体,平衡将________ 移动,SO2的转化率将_______;
(6)恒温恒压下,充入“惰性”气体,平衡将______________移动,SO2的转化率将 ______;知识重现不向逆方向不变减小讨论:硫酸工业中的接触氧化反应原理:
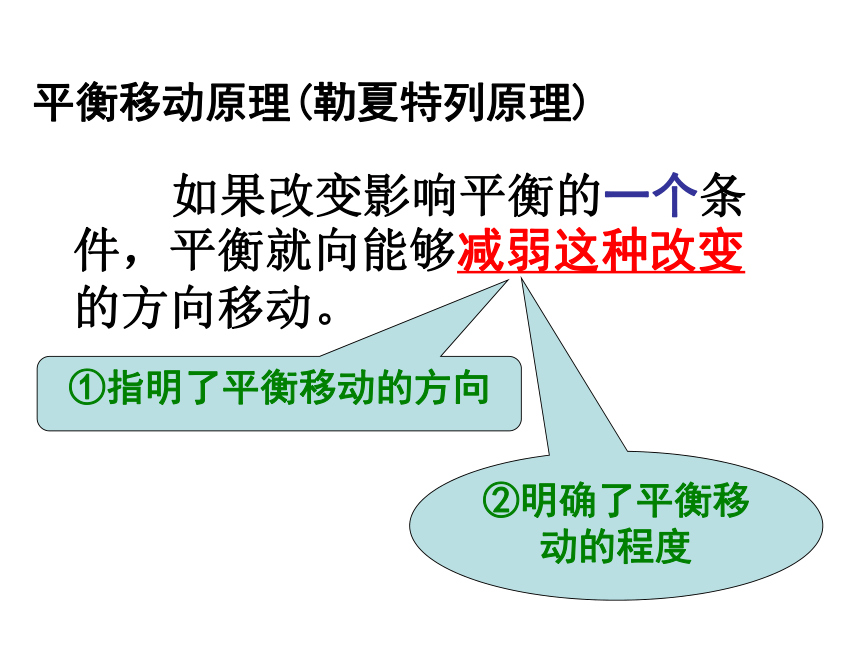
O2(g) + 2SO2(g) 2SO3(g) ;△H < 0 知 识 梳 理已知可逆反应N2+3H2 2NH3;△H < 0达到平衡,按要求填表: v’正>v’逆v’正 v(Ⅱ)v(Ⅰ) < v(Ⅱ)平衡移动原理(勒夏特列原理) 如果改变影响平衡的一个条件,平衡就向能够减弱这种改变的方向移动。①指明了平衡移动的方向②明确了平衡移动的程度[同类变式] 在一定条件下,
可逆反应 xA + yB zC 达到平衡。(1)若A、B、C均为气体,减压后平衡不移动,则x、y、z间的关系是___________;
(2)已知C是气体,且x+y=z,在增大压强时,若平衡发生移动,则一定向______反应方向移动;x+y=z逆[同类变式] 在一定条件下,
可逆反应 xA + yB zC 达到平衡。
(3)已知B、C是气体,当其他条件不变时,
增大A的物质的量,平衡不移动,则A为__态;(4)加热后C的质量分数减少,则正反应方向是 _______(填“放热”或“吸热” )反应,升高温度时,正反应速率________,逆反应速率_____(填“增大”或“减少” )。固或液放热增大增大[能力提高]
例:在一个体积固定的密闭容器中充入2molSO2和1molO2,一定的条件下建立平衡:2SO2(g)+ O2(g) 2SO3(g),现按如下方式改变条件,对平衡有何影响。
(1)若再充入2molSO2和1molO2,则SO2的转化率将____, SO2浓度将____。(2)若抽出1molSO2和0.5molO2,则SO2的转化率将____, SO2浓度将____。增大增大减小减小[同类变式]:一定量的混合气体在密闭容器中发生反应:aA(g)+bB(g) cC(g)+dD(g) 达到平衡时,测得B气体的浓度为0.6mol/L。恒温下,将密闭容器的容积扩大1倍,重新达到平衡时,测得B气体的浓度为0.4mol/L,则下列叙述中正确的是( )
A.平衡向右移动
B.重新达平衡时D的体积分数增大
C.a+b>c+d
D.重新达平衡时A的转化率增大C(2006年全国高考题)反应2A(g) + B(g)
2C(g);△H>0 。下列反应条件中有利于生成C的是( )
A、低温、低压 B、低温、高压
C、高温、高压 D、高温、低压直击高考c直击高考◆(2007年全国高考题)上图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是( )
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态 I 后,增大反应物浓度,平衡发
生移动,达到平衡态 II
C.该反应达到平衡态 I 后,减小反应物浓度,平衡发
生移动,达到平衡 II
D.同一种反应物在平衡态 I 和平衡态 II 时浓度不相等c◆观察下列图象,分析有何特点。考考你的观察力◆“三看”:一看坐标含义;二看特殊拐点;
三看变化趋势 ◆先拐先平原则:判断温度和压强的大小 ◆“定一议二”原则:确定一个变量,讨论两个变量识别图象题的注意要点:◆(05年高考)右图是温度和压强对 X+Y 2Z反应影响的示意图。图中横坐标表示平衡混合体中Z的体积分数。下列叙述正确的是:( )
A.正反应为放热反应
B. X、Y、Z均为气态
C. X和Y中只有一种为气态,
Z为气态
D. 逆反应的ΔH>0C能力应用:已知可逆反应aA + bB cC 中,物质的含量 A%和 C%随温度的变化曲线如图所示,下列说法正确的是( )
A、该反应在T1温度时达到化学平衡
B、该反应在T2温度时达到化学平衡
C、该反应的正反应是吸热反应
D、升高温度,平衡会向
正反应方向移动变式迁移B原理的应用:
◆下列事实不能用勒夏特列原理解释的是( )
A、久置的氯水变成了稀盐酸
B、用排饱和的食盐水的方法收集氯气
C 、工业生产硫酸的过程中使用过量的空气可
以提高SO2的转化率
D、钢铁在潮湿的空气中容易生锈
返璞归真D同学们再见!2SO2(g)+ O2(g) 2SO3(g) Ar恒
容恒
压2molSO2(g) 1molO2(g)
达到平衡2molSO2(g) 1molO2(g)
达到平衡加1molO2和2molSO2另加一个相同的容器2molO2和4molSO2,已达到平衡1molO2和2molSO2,已达到平衡加1molO2和2molSO2抽去隔板抽出0.5molO2和1molSO20.5molO2、1molSO2达到平衡aA(g)+bB(g) cC(g)+dD(g)假设平衡 不移动逆向 移动压强减小,平衡逆向移动练习:假设A、B是等体积真空容器(如下图),K是开关,活塞可以左右移动。关闭K,向A中充入一定量的NO2,发生反应:
2NO2(g) N2O4(g);△H<0 下列说法正确的是( )综合拔高A、一定温度下,保持活塞位置不变,打开K,体系中气体颜色先变浅,后略加深气体扩散,NO2浓度减小压强减小,平衡向生成NO2方向移动√练习:假设A、B是等体积真空容器(如下图),K是开关,活塞可以左右移动。关闭K,向A中充入一定量的NO2,发生反应:
2NO2(g) N2O4(g);△H<0 下列说法正确的是( )综合拔高B、一定温度下,打开K一段时间,再关闭它,向右推活塞至1/2处,最后A中气体的颜色比B中的浅 压强增大,平衡向生成N2O4方向移动假设平衡不移动,则浓度加倍练习:假设A、B是等体积真空容器(如下图),K是开关,活塞可以左右移动。关闭K,向A中充入一定量的NO2,发生反应:
2NO2(g) N2O4(g);△H<0 下列说法正确的是( )综合拔高C、打开K一段时间,再关闭它,向右推活塞至1/2处,加热A,A中气体颜色变浅温度升高,平衡向生成NO2方向移动练习:假设A、B是等体积真空容器(如下图),K是开关,活塞可以左右移动。关闭K,向A中充入一定量的NO2,发生反应:
2NO2(g) N2O4(g);△H<0 下列说法正确的是( )综合拔高D、打开K一段时间,再关闭它,向右推活塞至1/2处固定,向A中通入氩气,A中气体颜色变浅 浓度不变,平衡不移动
学平衡移动的影响2、理解勒夏特列原理的涵义能否将SO2完全转化为SO3?
接触室硫酸工业中的接触氧化反应原理:
O2(g) + 2SO2(g) 2SO3(g) ;△H < 0 讨论:
(1)往体积固定的密闭容器中加入O2,平衡将向____方向移动,SO2的转化率将________;
(2)往体积固定的密闭容器中加入SO2,平衡将向____方向移动,SO2的转化率将______; 知识重现正增大正减小讨论:
(3)升高温度,平衡将向____方向移动,
(4)增大压强,平衡将向____方向移动, 知识重现逆正硫酸工业中的接触氧化反应原理:
O2(g) + 2SO2(g) 2SO3(g) ;△H < 0 (5)恒温恒容下,充入“惰性”气体,平衡将________ 移动,SO2的转化率将_______;
(6)恒温恒压下,充入“惰性”气体,平衡将______________移动,SO2的转化率将 ______;知识重现不向逆方向不变减小讨论:硫酸工业中的接触氧化反应原理:
O2(g) + 2SO2(g) 2SO3(g) ;△H < 0 知 识 梳 理已知可逆反应N2+3H2 2NH3;△H < 0达到平衡,按要求填表: v’正>v’逆v’正
可逆反应 xA + yB zC 达到平衡。(1)若A、B、C均为气体,减压后平衡不移动,则x、y、z间的关系是___________;
(2)已知C是气体,且x+y=z,在增大压强时,若平衡发生移动,则一定向______反应方向移动;x+y=z逆[同类变式] 在一定条件下,
可逆反应 xA + yB zC 达到平衡。
(3)已知B、C是气体,当其他条件不变时,
增大A的物质的量,平衡不移动,则A为__态;(4)加热后C的质量分数减少,则正反应方向是 _______(填“放热”或“吸热” )反应,升高温度时,正反应速率________,逆反应速率_____(填“增大”或“减少” )。固或液放热增大增大[能力提高]
例:在一个体积固定的密闭容器中充入2molSO2和1molO2,一定的条件下建立平衡:2SO2(g)+ O2(g) 2SO3(g),现按如下方式改变条件,对平衡有何影响。
(1)若再充入2molSO2和1molO2,则SO2的转化率将____, SO2浓度将____。(2)若抽出1molSO2和0.5molO2,则SO2的转化率将____, SO2浓度将____。增大增大减小减小[同类变式]:一定量的混合气体在密闭容器中发生反应:aA(g)+bB(g) cC(g)+dD(g) 达到平衡时,测得B气体的浓度为0.6mol/L。恒温下,将密闭容器的容积扩大1倍,重新达到平衡时,测得B气体的浓度为0.4mol/L,则下列叙述中正确的是( )
A.平衡向右移动
B.重新达平衡时D的体积分数增大
C.a+b>c+d
D.重新达平衡时A的转化率增大C(2006年全国高考题)反应2A(g) + B(g)
2C(g);△H>0 。下列反应条件中有利于生成C的是( )
A、低温、低压 B、低温、高压
C、高温、高压 D、高温、低压直击高考c直击高考◆(2007年全国高考题)上图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是( )
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态 I 后,增大反应物浓度,平衡发
生移动,达到平衡态 II
C.该反应达到平衡态 I 后,减小反应物浓度,平衡发
生移动,达到平衡 II
D.同一种反应物在平衡态 I 和平衡态 II 时浓度不相等c◆观察下列图象,分析有何特点。考考你的观察力◆“三看”:一看坐标含义;二看特殊拐点;
三看变化趋势 ◆先拐先平原则:判断温度和压强的大小 ◆“定一议二”原则:确定一个变量,讨论两个变量识别图象题的注意要点:◆(05年高考)右图是温度和压强对 X+Y 2Z反应影响的示意图。图中横坐标表示平衡混合体中Z的体积分数。下列叙述正确的是:( )
A.正反应为放热反应
B. X、Y、Z均为气态
C. X和Y中只有一种为气态,
Z为气态
D. 逆反应的ΔH>0C能力应用:已知可逆反应aA + bB cC 中,物质的含量 A%和 C%随温度的变化曲线如图所示,下列说法正确的是( )
A、该反应在T1温度时达到化学平衡
B、该反应在T2温度时达到化学平衡
C、该反应的正反应是吸热反应
D、升高温度,平衡会向
正反应方向移动变式迁移B原理的应用:
◆下列事实不能用勒夏特列原理解释的是( )
A、久置的氯水变成了稀盐酸
B、用排饱和的食盐水的方法收集氯气
C 、工业生产硫酸的过程中使用过量的空气可
以提高SO2的转化率
D、钢铁在潮湿的空气中容易生锈
返璞归真D同学们再见!2SO2(g)+ O2(g) 2SO3(g) Ar恒
容恒
压2molSO2(g) 1molO2(g)
达到平衡2molSO2(g) 1molO2(g)
达到平衡加1molO2和2molSO2另加一个相同的容器2molO2和4molSO2,已达到平衡1molO2和2molSO2,已达到平衡加1molO2和2molSO2抽去隔板抽出0.5molO2和1molSO20.5molO2、1molSO2达到平衡aA(g)+bB(g) cC(g)+dD(g)假设平衡 不移动逆向 移动压强减小,平衡逆向移动练习:假设A、B是等体积真空容器(如下图),K是开关,活塞可以左右移动。关闭K,向A中充入一定量的NO2,发生反应:
2NO2(g) N2O4(g);△H<0 下列说法正确的是( )综合拔高A、一定温度下,保持活塞位置不变,打开K,体系中气体颜色先变浅,后略加深气体扩散,NO2浓度减小压强减小,平衡向生成NO2方向移动√练习:假设A、B是等体积真空容器(如下图),K是开关,活塞可以左右移动。关闭K,向A中充入一定量的NO2,发生反应:
2NO2(g) N2O4(g);△H<0 下列说法正确的是( )综合拔高B、一定温度下,打开K一段时间,再关闭它,向右推活塞至1/2处,最后A中气体的颜色比B中的浅 压强增大,平衡向生成N2O4方向移动假设平衡不移动,则浓度加倍练习:假设A、B是等体积真空容器(如下图),K是开关,活塞可以左右移动。关闭K,向A中充入一定量的NO2,发生反应:
2NO2(g) N2O4(g);△H<0 下列说法正确的是( )综合拔高C、打开K一段时间,再关闭它,向右推活塞至1/2处,加热A,A中气体颜色变浅温度升高,平衡向生成NO2方向移动练习:假设A、B是等体积真空容器(如下图),K是开关,活塞可以左右移动。关闭K,向A中充入一定量的NO2,发生反应:
2NO2(g) N2O4(g);△H<0 下列说法正确的是( )综合拔高D、打开K一段时间,再关闭它,向右推活塞至1/2处固定,向A中通入氩气,A中气体颜色变浅 浓度不变,平衡不移动
