金属的化学性质第一课时
图片预览





文档简介
课件17张PPT。人教版化学1第三章第一节
金属的化学性质第一课时
金属与氧气的反应,钠与水的反应 教材分析
教学设计与重、难点的突破——教法学法
学习评价
教学评价与反思一、教材分析1.教学内容及其地位 承上启下 钠与氧气、水的反应
铝与氧气的反应
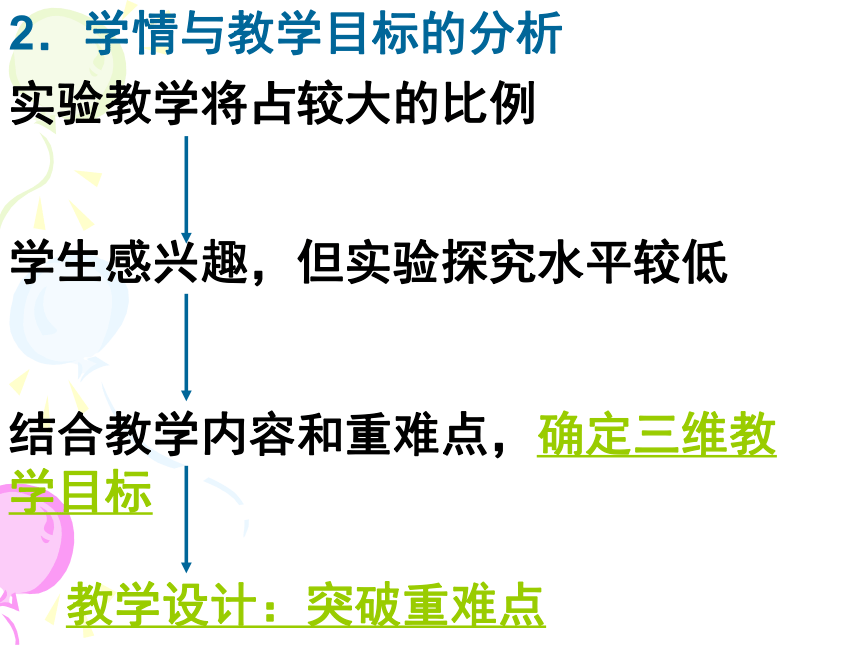
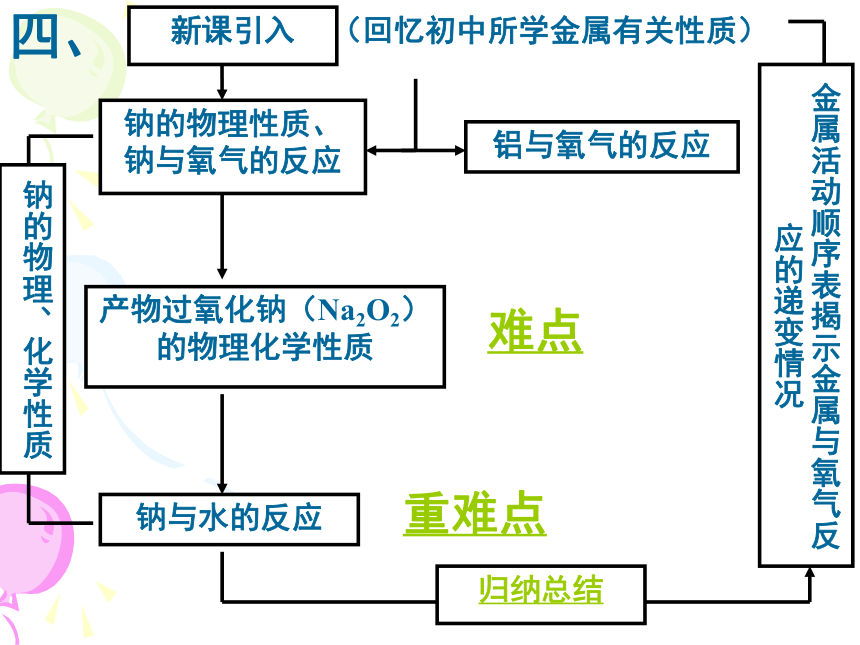
过氧化钠与水、二氧化碳的反应重、难点难点2.学情与教学目标的分析实验教学将占较大的比例学生感兴趣,但实验探究水平较低结合教学内容和重难点,确定三维教学目标教学设计:突破重难点新课引入(回忆初中所学金属有关性质)钠的物理性质、钠与氧气的反应铝与氧气的反应产物过氧化钠(Na2O2)的物理化学性质钠与水的反应钠的物理、化学性质金属活动顺序表揭示金属与氧气反应的递变情况归纳总结难点重难点四、教法学法分析1.引导式实验探究与自主式实验探究法相结合,充分体现了以教师为主导、学生为主体、训练为主线的教育思想。2.由问题引出问题,由问题分析问题3.运用归纳、比较的教学方法五、学习评价从三个维度去评价学生本课时的学习效果六、教学评价与反思1、如何把握好实验的设计与分类?2、如何调控学生的思维,有效地得到学习反馈?问题与练习设计合理吗?3、如何把握科学探究的层次性?谢谢大家1.两个趣味演示实验的设计——过氧化钠与二氧化碳、水的反应降低认知难度,自然过渡到较难的知识 点,激发起学生的求知欲教师演示实验2.Na2O2与H2O、CO2反应后的产物探究——引导探究法学生描述实验现象学生推测结论评价3.Na2O2中元素的价态分析、它和H2O、CO2反应时,电子转移情况的分析——有利于学生对反应的理解和记忆 1、学生独立实验,获取感性认识学生交流实验现象。钠与水好像反应了,似乎有气体生成?但究竟是生成了什么物质呢?2.Na与H2O反应后的产物探究——自主探究法独立设计实验组内交流讨论学生动手实验交流探究结果评价★产生的气体可能是什么?
★如何收集?
★如何检验?2Na + 2H2O =
2NaOH + H2↑ 3.归纳小结4.习题巩固与提升(1)实验室中应如何保存钠?(2)为什么能将钠保存在煤油中?4.习题巩固与提升(3)将一小块钠投入足量的FeCl3溶液中,现象是( )
A.置换出银白色铁
B.产生气体,置换出银白色金属铁
C.生成红褐色沉淀
D.产生气体,生成红褐色沉淀3Na+FeCl3=3NaCl+Fe?×2Na + 2H2O = 2NaOH + H2↑ 3NaOH+FeCl3=Fe(OH)3↓+NaClD知识与技能
了解地壳中一些重要元素(O Si Al Fe Ca)的含量。
掌握Na、Al与O2反应的产物及其用途。
掌握Na与H2O,Na2O2与H2O、CO2反应的特殊性。
了解金属活动顺序表在学习金属的化学性质中的作用。 过程与方法
采用实验探究法 ,启发式教学。
在实验探究的基础上,辅以巩固提升类练习 ,讲练结合
情感态度与价值观
通过介绍金属及其化合物的用途,培养学生对化学学科的热爱之情
通过探究性实验,培养学生勇于探索的科学精神和实事求是的科学态度
金属的化学性质第一课时
金属与氧气的反应,钠与水的反应 教材分析
教学设计与重、难点的突破——教法学法
学习评价
教学评价与反思一、教材分析1.教学内容及其地位 承上启下 钠与氧气、水的反应
铝与氧气的反应
过氧化钠与水、二氧化碳的反应重、难点难点2.学情与教学目标的分析实验教学将占较大的比例学生感兴趣,但实验探究水平较低结合教学内容和重难点,确定三维教学目标教学设计:突破重难点新课引入(回忆初中所学金属有关性质)钠的物理性质、钠与氧气的反应铝与氧气的反应产物过氧化钠(Na2O2)的物理化学性质钠与水的反应钠的物理、化学性质金属活动顺序表揭示金属与氧气反应的递变情况归纳总结难点重难点四、教法学法分析1.引导式实验探究与自主式实验探究法相结合,充分体现了以教师为主导、学生为主体、训练为主线的教育思想。2.由问题引出问题,由问题分析问题3.运用归纳、比较的教学方法五、学习评价从三个维度去评价学生本课时的学习效果六、教学评价与反思1、如何把握好实验的设计与分类?2、如何调控学生的思维,有效地得到学习反馈?问题与练习设计合理吗?3、如何把握科学探究的层次性?谢谢大家1.两个趣味演示实验的设计——过氧化钠与二氧化碳、水的反应降低认知难度,自然过渡到较难的知识 点,激发起学生的求知欲教师演示实验2.Na2O2与H2O、CO2反应后的产物探究——引导探究法学生描述实验现象学生推测结论评价3.Na2O2中元素的价态分析、它和H2O、CO2反应时,电子转移情况的分析——有利于学生对反应的理解和记忆 1、学生独立实验,获取感性认识学生交流实验现象。钠与水好像反应了,似乎有气体生成?但究竟是生成了什么物质呢?2.Na与H2O反应后的产物探究——自主探究法独立设计实验组内交流讨论学生动手实验交流探究结果评价★产生的气体可能是什么?
★如何收集?
★如何检验?2Na + 2H2O =
2NaOH + H2↑ 3.归纳小结4.习题巩固与提升(1)实验室中应如何保存钠?(2)为什么能将钠保存在煤油中?4.习题巩固与提升(3)将一小块钠投入足量的FeCl3溶液中,现象是( )
A.置换出银白色铁
B.产生气体,置换出银白色金属铁
C.生成红褐色沉淀
D.产生气体,生成红褐色沉淀3Na+FeCl3=3NaCl+Fe?×2Na + 2H2O = 2NaOH + H2↑ 3NaOH+FeCl3=Fe(OH)3↓+NaClD知识与技能
了解地壳中一些重要元素(O Si Al Fe Ca)的含量。
掌握Na、Al与O2反应的产物及其用途。
掌握Na与H2O,Na2O2与H2O、CO2反应的特殊性。
了解金属活动顺序表在学习金属的化学性质中的作用。 过程与方法
采用实验探究法 ,启发式教学。
在实验探究的基础上,辅以巩固提升类练习 ,讲练结合
情感态度与价值观
通过介绍金属及其化合物的用途,培养学生对化学学科的热爱之情
通过探究性实验,培养学生勇于探索的科学精神和实事求是的科学态度
