化学:专题一《化学家眼中的物质世界》课件(苏教版必修1)
文档属性
| 名称 | 化学:专题一《化学家眼中的物质世界》课件(苏教版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 385.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-11-30 00:00:00 | ||
图片预览











文档简介
课件43张PPT。化学家眼中的物质世界物质的分类p31、下列物质中前者从属于后者的是( )A、纯净物、混合物 B、氧化物、化合物 C、盐、正盐 D、金属氧化物、碱性氧化物B2、下列说法中,正确的是 ( ) A、非金属氧化物都是酸性氧化物 B、酸性氧化物都是非金属氧化物 C、金属氧化物都是碱性氧化物 D、碱性氧化物都是金属氧化物 E、与水反应生成酸的氧化物,不一定是该酸对 应的酸性氧化物 F、凡是酸性氧化物都可以直接和水反应生成对应的酸2、下列说法中,正确的是 ( )
G、含氧元素的化合物是氧化物
H、单质含有一种元素,由一种元素组成的物质就是单质
I、HCl是纯净物,纯净的盐酸是纯净物
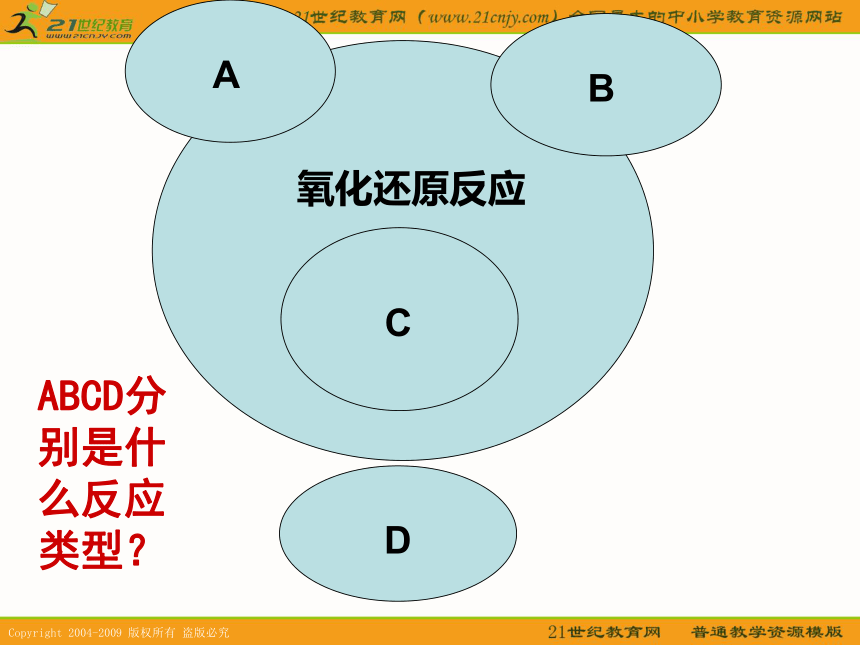
J、凡是在水中电离出H+的物质就是酸DEABCD分别是什么反应类型?1.下面说法正确的是 ( )
A.1mol米是6.02×1023粒米
B.10mol氢所含粒子数为6.02 ×1024
C.摩尔是物质的量的单位
D.阿伏加德罗常数就是6.02×1023mol-E.1H的摩尔质量是1g.mol-1
F.氩气的摩尔质量在数值上等于它的相对原子质量
G.1mol任何物质的质量等于该物质的相对分子质量物质的量CE 1、质量为1.4g,分子数为3.01×1023物质的相对分子质量为多少?2、辩:
(1)H2SO4的摩尔质量是98。
(2)NA个H2SO4的质量在数值上等于硫酸的摩尔质量。
(3)1个12C的质量为 。1、决定体积的因素气体摩尔体积2、标准状况下的气体摩尔体积
对象:
“标准状况”指:
结论:气体(纯净或混合气体)
温度:0oC、压强101KPa
Vm约为22.4L/mol思考1、下列说法正确的是( )
A、1mol氖气和1 mol氧气体积相同
B、0.1molN2在25℃和101kPa时体积约为2.24 L
C、22g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
D、0.3molN2、0.7molO2在标准状况下的总体积约为22.4LCD思考2 、下列说法中,正确的是( )
A、1mol某气体的体积是22.4L,该气 体所处的状况一定是标准状况.
B、通常状况下,1molO2的体积必定是22.4L
C、某物质含有阿伏加德罗常数个微粒,该物质在标准状况下的体积为22.4L
D、标准状况下,1molH2和O2的混合气体的体积不一定为22.4L√思考4
(1)相同物质的量的各固体或液体的体积并不相同,其主要原因是 ( ) (2)相同物质的量的气体的体积并 不相同,其主要原因是 ( )
A、粒子大小不同
B、粒子质量不同
C、粒子间距离不同
D、粒子间作用力不同CA阿伏加德罗定律同温同压下= gNa2CO3.10H2O溶于90g水中,才能使的每100个水分子中溶有一个Na+7.53混合气体的平均相对分子质量2、同温同压下,某容器充满O2时重116 g ,充满CO2时重122 g,现充满某气体时重114 g,则该气体的相对分子质量是:281、在一定温度的压强下,1体积A2气体和 3体积B2气体化合生成2体积C气体,则C的化学式为 ,你的推测依据是:
。AB3或B3A阿伏加德罗定律和质量守恒定律3、在200℃下,物质NH4HCO3、(NH4)2CO3受热分解,计算生成的混合气体的摩尔质量?不同分散系的比较电解质电解质 强电解质: 弱电解质: (电离是一个可逆过程)在水溶液或融化状态下能导电的化合物。在水溶液和融化状态下都不能导电的化合物电解质:非电解质强酸、强碱、盐 弱酸、 NH3·H2O、 H2O1、导电性强弱取决于离子浓度大小而不是看它是强电解质还是弱电解质。3、电解质是强还是弱取决于电离程度,与导电性没有必然联系。4、相同浓度下强电解质的导电性比弱电解质强。强弱电解质与导电性2、电解质只有在溶于水或熔化时才导电。思考:下列物质中
①氢氧化钠固体 ②水银 ③氯化氢气体 ④稀硫酸 ⑤二氧化碳气体 ⑥氨水
⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4·5H2O晶体
⑴上述状态下能导电的是:__________
⑵属于电解质的是:________________
⑶属于非电解质的是:______________②④⑥⑨①③⑦⑨⑩⑤⑧1、蒸馏:定义(见P18)、适用范围、使用仪器名称和蒸馏装置的特点。第二单元 研究物质的实验方法2-1物质的分离与提纯—— 蒸馏、萃取、分液、过滤、结晶等2、萃取:⑴定义(见P18) ⑵萃取剂选择条件:
①溶质在萃取剂中的溶解度比在水中
②萃取剂与水互不相溶
③萃取剂与溶质互不反应 ⑶常见萃取剂:苯、汽油、煤油、 CCl4等。3、分液①操作名称:②使用仪器:③操作要领:分液分液漏斗 振荡、静置、分液(打开上口玻璃塞,慢慢旋转旋塞,使下层液体从下口放出,上层液体从上口倒出。)4、过滤
操作要领:
一贴、二低、三靠。5、结晶 ⑴结晶定义 ⑵结晶方法有哪2种? ⑶结晶方法适用范围?NH4+的检验方法:①取少量试样于试管中, ②加入浓NaOH溶液, ③加热, ④将湿润的红色石蕊试纸靠近试管口,观察试纸是否变蓝。Cl—的检验方法:①取少量试样于试管中, ②滴加AgNO3溶液,若产生白色沉淀, ③再加稀HNO3,观察沉淀是否溶解。2-2常见物质的检验
1、常见离子的检验方法: NH4+、Cl—、SO42—、Na+、K+。SO42—的检验方法:①取少量溶液于试管中, ②加足量盐酸无现象, ③再滴加BaCl2溶液,观察是否产生白色沉淀。Na+的检验方法:①取铂丝放在火焰上灼烧至无色, ②再用铂丝蘸取试样在火焰上灼烧。 观察火焰的颜色。CO32—的检验方法:①取少量试样于试管中, ②加入盐酸,若产生气泡, ③气体通入澄清的石灰水,变浑浊再加稀HNO3,观察沉淀是否溶解。K+的检验方法:①取铂丝放在火焰上灼烧至无色, ②再用铂丝蘸取试样在火焰上灼烧。 透过蓝色的钴玻璃片观察火焰的颜色。 焰色反应实验的操作方法:
(1)洗:用稀盐酸洗铂丝。
(2)烧:将洗过的铂丝在火焰上灼烧到无色。
(3)蘸:用铂丝蘸取试样。
(4)烧:将沾在铂丝上试样在火焰上灼烧。问题1、如何检验下列物质? (1) NH4Cl和NaCl (2) NaOH和KCl (3) Na2SO4和NaCl1、不能引入新的杂质 2、被提纯的物质不能减少 3、除杂试剂应该过量 4、过量试剂必须除去 5、除杂中用到多种物质时,要考虑加入试剂的顺序 6、被提纯或分离的物质要复原物质的分离和提纯的要求1.已知粗盐中含有泥砂、MgCl2、CaCl2、Na2SO4等杂质
设计实验除去以上杂质得到精盐除去Mg(OH)2 、BaSO4、CaCO3沉淀 下面物质的分离方法不正确的是( )AC 物质的量浓度注意事项: 1、用前检漏 2、配液一次完成、不能几次相加,
3、注意容量瓶的规格
4、定容摇匀后液面低于刻度线不能再加水 5、定容时液面超过刻度线重新配置 6、平视读数计算、称量、溶解、转移、洗涤、定容、摇匀配制步骤:量取、稀释下面是配制500mL 0.2 mol/L KCl溶液的操作,请按要求填空:
(1)所需KCl的质量为 。
(2)称量过程中主要用到的仪器是 。
(3)将烧杯中的溶液沿 引流到 中,并用蒸馏水洗涤烧杯2~3次,洗涤液要 ,并摇匀。
(4)加水至距刻度线 处,改用 加水,使液面的凹 液面正好与刻度线相切。
(5)在容量瓶中进行定容时,仰视刻度线,所配的溶液浓度将 (偏高、偏低、无影响)。7.5 g (为什么不是 7.45 g) 天平 玻璃棒 500mL容量瓶 转移到容量瓶中 2~3 cm 胶头滴管 偏低 3、误差分析依据:思考 :引起误差的因素有哪些?分析下列操作对所配得的NaCl浓度有何影响?偏小偏大偏大偏小偏小质量数质子数ClS2-Na+ 3517中子数电子数2312323545181817101616801135粒子原子结构质量数——质子数——
(核电荷数 )——离子的价态——化合价——原子个数数字的位置不同,所表示的意义就不同1、元素:具有相同核电荷数(即质子数)的同一类原子的总称。2、核素:具有一定数目的质子和一定数目的中子的一种原子的总称。3、同位素: 原子核内质子数相同中子数不同的原子互称为同位数。元素、核素、同位素1、某元素的同种同位素,它们的原子具有不同的 ( )
A.质子数 B.质量数
C.核电荷数 D.电子数2.写出(1)核外有10个电子的分子
(2)核外有10个电子的离子
(3)核外有18个电子的分子
(4)核外有18个电子的离子3、由这几种核数共可形成几种水分子?
所得水的相对分子质量最多有几种?5、和Na+具有相同质子数和电子数的微粒是 ( )
A.NH4+ B. F- C. H2O D. NH3 A 4、某元素R的阳离子Rn+核外有x个电子,该元素的质量数为A,则该元素原子核内的中子数 ( ) A. A-x-n B. A-x+n C. A+x-n D. A+x+nA
G、含氧元素的化合物是氧化物
H、单质含有一种元素,由一种元素组成的物质就是单质
I、HCl是纯净物,纯净的盐酸是纯净物
J、凡是在水中电离出H+的物质就是酸DEABCD分别是什么反应类型?1.下面说法正确的是 ( )
A.1mol米是6.02×1023粒米
B.10mol氢所含粒子数为6.02 ×1024
C.摩尔是物质的量的单位
D.阿伏加德罗常数就是6.02×1023mol-E.1H的摩尔质量是1g.mol-1
F.氩气的摩尔质量在数值上等于它的相对原子质量
G.1mol任何物质的质量等于该物质的相对分子质量物质的量CE 1、质量为1.4g,分子数为3.01×1023物质的相对分子质量为多少?2、辩:
(1)H2SO4的摩尔质量是98。
(2)NA个H2SO4的质量在数值上等于硫酸的摩尔质量。
(3)1个12C的质量为 。1、决定体积的因素气体摩尔体积2、标准状况下的气体摩尔体积
对象:
“标准状况”指:
结论:气体(纯净或混合气体)
温度:0oC、压强101KPa
Vm约为22.4L/mol思考1、下列说法正确的是( )
A、1mol氖气和1 mol氧气体积相同
B、0.1molN2在25℃和101kPa时体积约为2.24 L
C、22g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
D、0.3molN2、0.7molO2在标准状况下的总体积约为22.4LCD思考2 、下列说法中,正确的是( )
A、1mol某气体的体积是22.4L,该气 体所处的状况一定是标准状况.
B、通常状况下,1molO2的体积必定是22.4L
C、某物质含有阿伏加德罗常数个微粒,该物质在标准状况下的体积为22.4L
D、标准状况下,1molH2和O2的混合气体的体积不一定为22.4L√思考4
(1)相同物质的量的各固体或液体的体积并不相同,其主要原因是 ( ) (2)相同物质的量的气体的体积并 不相同,其主要原因是 ( )
A、粒子大小不同
B、粒子质量不同
C、粒子间距离不同
D、粒子间作用力不同CA阿伏加德罗定律同温同压下= gNa2CO3.10H2O溶于90g水中,才能使的每100个水分子中溶有一个Na+7.53混合气体的平均相对分子质量2、同温同压下,某容器充满O2时重116 g ,充满CO2时重122 g,现充满某气体时重114 g,则该气体的相对分子质量是:281、在一定温度的压强下,1体积A2气体和 3体积B2气体化合生成2体积C气体,则C的化学式为 ,你的推测依据是:
。AB3或B3A阿伏加德罗定律和质量守恒定律3、在200℃下,物质NH4HCO3、(NH4)2CO3受热分解,计算生成的混合气体的摩尔质量?不同分散系的比较电解质电解质 强电解质: 弱电解质: (电离是一个可逆过程)在水溶液或融化状态下能导电的化合物。在水溶液和融化状态下都不能导电的化合物电解质:非电解质强酸、强碱、盐 弱酸、 NH3·H2O、 H2O1、导电性强弱取决于离子浓度大小而不是看它是强电解质还是弱电解质。3、电解质是强还是弱取决于电离程度,与导电性没有必然联系。4、相同浓度下强电解质的导电性比弱电解质强。强弱电解质与导电性2、电解质只有在溶于水或熔化时才导电。思考:下列物质中
①氢氧化钠固体 ②水银 ③氯化氢气体 ④稀硫酸 ⑤二氧化碳气体 ⑥氨水
⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4·5H2O晶体
⑴上述状态下能导电的是:__________
⑵属于电解质的是:________________
⑶属于非电解质的是:______________②④⑥⑨①③⑦⑨⑩⑤⑧1、蒸馏:定义(见P18)、适用范围、使用仪器名称和蒸馏装置的特点。第二单元 研究物质的实验方法2-1物质的分离与提纯—— 蒸馏、萃取、分液、过滤、结晶等2、萃取:⑴定义(见P18) ⑵萃取剂选择条件:
①溶质在萃取剂中的溶解度比在水中
②萃取剂与水互不相溶
③萃取剂与溶质互不反应 ⑶常见萃取剂:苯、汽油、煤油、 CCl4等。3、分液①操作名称:②使用仪器:③操作要领:分液分液漏斗 振荡、静置、分液(打开上口玻璃塞,慢慢旋转旋塞,使下层液体从下口放出,上层液体从上口倒出。)4、过滤
操作要领:
一贴、二低、三靠。5、结晶 ⑴结晶定义 ⑵结晶方法有哪2种? ⑶结晶方法适用范围?NH4+的检验方法:①取少量试样于试管中, ②加入浓NaOH溶液, ③加热, ④将湿润的红色石蕊试纸靠近试管口,观察试纸是否变蓝。Cl—的检验方法:①取少量试样于试管中, ②滴加AgNO3溶液,若产生白色沉淀, ③再加稀HNO3,观察沉淀是否溶解。2-2常见物质的检验
1、常见离子的检验方法: NH4+、Cl—、SO42—、Na+、K+。SO42—的检验方法:①取少量溶液于试管中, ②加足量盐酸无现象, ③再滴加BaCl2溶液,观察是否产生白色沉淀。Na+的检验方法:①取铂丝放在火焰上灼烧至无色, ②再用铂丝蘸取试样在火焰上灼烧。 观察火焰的颜色。CO32—的检验方法:①取少量试样于试管中, ②加入盐酸,若产生气泡, ③气体通入澄清的石灰水,变浑浊再加稀HNO3,观察沉淀是否溶解。K+的检验方法:①取铂丝放在火焰上灼烧至无色, ②再用铂丝蘸取试样在火焰上灼烧。 透过蓝色的钴玻璃片观察火焰的颜色。 焰色反应实验的操作方法:
(1)洗:用稀盐酸洗铂丝。
(2)烧:将洗过的铂丝在火焰上灼烧到无色。
(3)蘸:用铂丝蘸取试样。
(4)烧:将沾在铂丝上试样在火焰上灼烧。问题1、如何检验下列物质? (1) NH4Cl和NaCl (2) NaOH和KCl (3) Na2SO4和NaCl1、不能引入新的杂质 2、被提纯的物质不能减少 3、除杂试剂应该过量 4、过量试剂必须除去 5、除杂中用到多种物质时,要考虑加入试剂的顺序 6、被提纯或分离的物质要复原物质的分离和提纯的要求1.已知粗盐中含有泥砂、MgCl2、CaCl2、Na2SO4等杂质
设计实验除去以上杂质得到精盐除去Mg(OH)2 、BaSO4、CaCO3沉淀 下面物质的分离方法不正确的是( )AC 物质的量浓度注意事项: 1、用前检漏 2、配液一次完成、不能几次相加,
3、注意容量瓶的规格
4、定容摇匀后液面低于刻度线不能再加水 5、定容时液面超过刻度线重新配置 6、平视读数计算、称量、溶解、转移、洗涤、定容、摇匀配制步骤:量取、稀释下面是配制500mL 0.2 mol/L KCl溶液的操作,请按要求填空:
(1)所需KCl的质量为 。
(2)称量过程中主要用到的仪器是 。
(3)将烧杯中的溶液沿 引流到 中,并用蒸馏水洗涤烧杯2~3次,洗涤液要 ,并摇匀。
(4)加水至距刻度线 处,改用 加水,使液面的凹 液面正好与刻度线相切。
(5)在容量瓶中进行定容时,仰视刻度线,所配的溶液浓度将 (偏高、偏低、无影响)。7.5 g (为什么不是 7.45 g) 天平 玻璃棒 500mL容量瓶 转移到容量瓶中 2~3 cm 胶头滴管 偏低 3、误差分析依据:思考 :引起误差的因素有哪些?分析下列操作对所配得的NaCl浓度有何影响?偏小偏大偏大偏小偏小质量数质子数ClS2-Na+ 3517中子数电子数2312323545181817101616801135粒子原子结构质量数——质子数——
(核电荷数 )——离子的价态——化合价——原子个数数字的位置不同,所表示的意义就不同1、元素:具有相同核电荷数(即质子数)的同一类原子的总称。2、核素:具有一定数目的质子和一定数目的中子的一种原子的总称。3、同位素: 原子核内质子数相同中子数不同的原子互称为同位数。元素、核素、同位素1、某元素的同种同位素,它们的原子具有不同的 ( )
A.质子数 B.质量数
C.核电荷数 D.电子数2.写出(1)核外有10个电子的分子
(2)核外有10个电子的离子
(3)核外有18个电子的分子
(4)核外有18个电子的离子3、由这几种核数共可形成几种水分子?
所得水的相对分子质量最多有几种?5、和Na+具有相同质子数和电子数的微粒是 ( )
A.NH4+ B. F- C. H2O D. NH3 A 4、某元素R的阳离子Rn+核外有x个电子,该元素的质量数为A,则该元素原子核内的中子数 ( ) A. A-x-n B. A-x+n C. A+x-n D. A+x+nA
