化学:第三章《物质在水溶液中的行为》学案(鲁科版选修4)
文档属性
| 名称 | 化学:第三章《物质在水溶液中的行为》学案(鲁科版选修4) |

|
|
| 格式 | rar | ||
| 文件大小 | 26.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-11-30 00:00:00 | ||
图片预览


文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第三章《物质在水溶液中的行为》
一. 教学内容:
《物质在水溶液中的行为》
二. 教学目标:
1. 掌握pH的简单计算及其与溶液酸碱性的关系
2. 理解影响盐类水解的因素以及水解平衡的移动
3. 了解沉淀溶解平衡的概念及其影响因素
4. 会熟练书写常见反应的离子方程式
三. 教学重点、难点
pH的有关计算及离子方程式的书写
四. 知识分析
(一)溶液的酸碱性与pH的计算
1. 溶液的酸碱性
(1)表示方法:H+浓度、OH-浓度、pH.
(2)酸碱性强弱判断标准:〔H+〕和〔OH-〕 相对大小、pH大小、指示剂.
酸性溶液:〔H+〕>〔OH-〕碱性溶液:〔H+〕<〔OH-〕中性溶液:〔H+〕=〔OH-〕
2. 有关溶液pH的求算
(1)单一溶液
①强酸:先求出溶液的H+浓度,再通过pH=-lg〔H+〕求溶液的pH。
②强碱:先求出溶液的OH-浓度,再通过〔H+〕=Kw/〔OH-〕求出溶液的H+浓度,最后求得pH。
(2)溶液的冲稀(强酸或强碱)
①一般冲稀(冲稀后pH ≤6的酸或pH ≥8的碱):不要考虑水电离出的H+(酸溶液中)和OH-(碱溶液中),而酸电离出的H+或碱电离出的OH-的物质的量是主体。
②无限冲稀(冲稀后pH>6的酸或pH<8的碱):需要考虑水电离出的H+和 OH-
(3)溶液的混合(不考虑体积效应)
①强酸和强酸:〔H+〕={[H+]1·V1+[H+]2·V2}/(V1+V2);
pH=-lg〔H+〕。
②强碱和强碱:〔OH-〕={[OH-]1·V1+[OH-]2·V2}/(V1+V2);
〔H+〕=Kw/〔OH-〕;
pH=-lg〔H+〕。
【规律总结】0.3规律:pH不同(差2个单位及以上)的两强酸溶液等体积混合,混合液的pH 值比强的弱0.3;
pH不同(差2个单位及以上)的两强碱溶液等体积混合,混合液的pH 值比强的弱0.3;
③强酸和强碱:
酸过量:〔H+〕={[H+]酸·V酸-[OH-]碱·V碱}/(V酸+V碱)
碱过量:〔OH-〕={[OH-]碱·V碱-[H+]酸·V酸}/(V碱+V酸)
恰好中和:则溶液呈中性
(二)弱电解质的电离平衡
1. 电离平衡
(1)研究对象:弱电解质
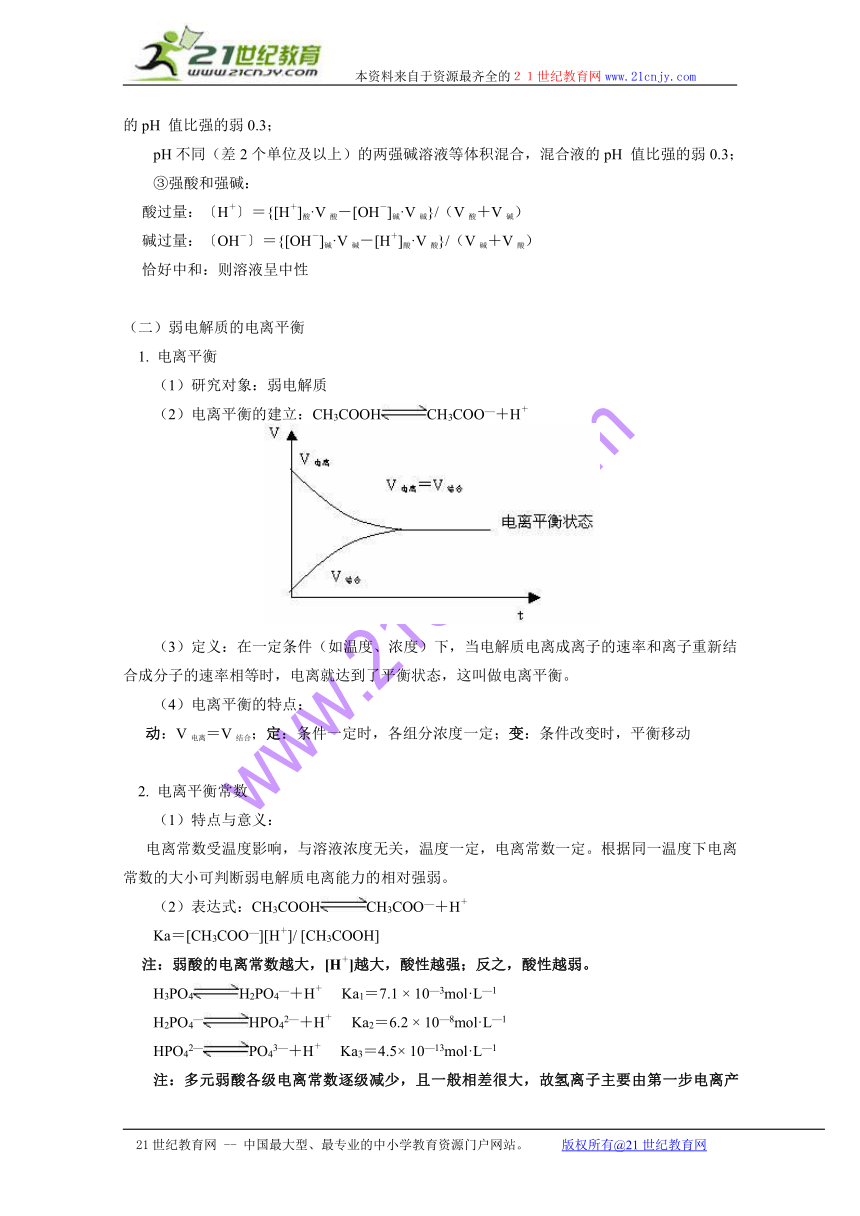
(2)电离平衡的建立:CH3COOHCH3COO—+H+
(3)定义:在一定条件(如温度、浓度)下,当电解质电离成离子的速率和离子重新结合成分子的速率相等时,电离就达到了平衡状态,这叫做电离平衡。
(4)电离平衡的特点:
动:V电离=V结合;定:条件一定时,各组分浓度一定;变:条件改变时,平衡移动
2. 电离平衡常数
(1)特点与意义:
电离常数受温度影响,与溶液浓度无关,温度一定,电离常数一定。根据同一温度下电离常数的大小可判断弱电解质电离能力的相对强弱。
(2)表达式:CH3COOHCH3COO—+H+
Ka=[CH3COO—][H+]/ [CH3COOH]
注:弱酸的电离常数越大,[H+]越大,酸性越强;反之,酸性越弱。
H3PO4H2PO4—+H+ Ka1=7.1 × 10—3mol·L—1
H2PO4—HPO42—+H+ Ka2=6.2 × 10—8mol·L—1
HPO42—PO43—+H+ Ka3=4.5× 10—13mol·L—1
注:多元弱酸各级电离常数逐级减少,且一般相差很大,故氢离子主要由第一步电离产生
弱碱与弱酸具类似规律:NH3·H2O NH4++OH—
Kb=[NH4+][OH—]/[NH3·H2O]
室温:Kb(NH3·H2O)=1.7 × 10—5mol·L—1
3. 电离度
α=已电离的溶质分子数/原始溶质分子总数 × 100%
注:①同温同浓度,不同的电解质的电离度不同
②同一弱电解质,在不同浓度的水溶液中,电离度不同;溶液越稀,电离度越大。
4. 影响电离平衡的因素
内因:电解质本身的性质
外因:(符合勒夏特列原理)
(1)温度:升高温度,电离平衡向电离的方向移动(若温度变化不大,一般不考虑其影响)
(2)浓度:
①加水稀释,电离平衡向电离的方向移动,即溶液浓度越小,弱电解质越易电离。
②加入某强电解质(含弱电解离子),电离平衡向生成弱电解质的方向移动。
③加入某电解质,消耗弱电解质离子,电离平衡向电离的方向移动
(三)盐类的水解
1. 盐类水解的概念
(1)原理:CH3COONa溶液:CH3COONa=Na++CH3COO—;
H2OOH—+H+;CH3COO—+H+CH3COOH
即:CH3COO—+H2O CH3COOH+OH—
故:溶液中[OH—]﹥[H+],溶液显碱性。
NH4Cl溶液:NH4Cl=NH4++Cl—;
H2O OH—+H+;NH4++OH—NH3·H2O
即:NH4++H2O NH3·H2O+H+
故:溶液中[H+]﹥[OH—],溶液呈酸性。
(2)定义:盐电离产生的离子与水电离产生的H+或OH—结合生成弱电解质,从而破坏了水的电离平衡,而使溶液呈现不同程度的酸、碱性,叫盐类的水解。
(3)实质:破坏水的电离平衡。
(4)规律:“有弱才水解,无弱不水解,越弱越水解,谁强显谁性,同强显中性”。
(5)多元弱酸酸根离子的水解分步进行:
CO32—+H2O HCO3—+OH—
HCO3—+H2O H2CO3+OH— (很小,可忽略)
多元弱碱阳离子的水解分步进行复杂,以总反应表示:Al3++3H2O Al(OH)3+3H+
【说明】水解反应一般程度都很小,水解产物很少,无明显沉淀、气体生成。
2. 水解平衡的移动
(1)影响盐类水解平衡的因素
内因:盐本身的性质, 组成盐的酸或碱越弱,盐的水解程度越大。
外因:①温度:升高温度,平衡向水解的方向移动——盐类的水解是吸热反应。
思考:为什么热的纯碱溶液去污效果比冷的好?
②盐溶液的浓度:盐溶液的浓度越小,盐就越易水解,加水稀释促进盐溶液的水解,平衡正方向移动,水解程度增大;如果增大盐的浓度,水解平衡虽然正向移动,但水解程度减小。
③溶液的酸碱性:加酸,抑制弱碱阳离子的水解;加碱,抑制弱酸根离子的水解。
(2)某些弱酸弱碱盐双水解
泡沫灭火器的灭火原理:3HCO3— + Al3+= Al(OH)3↓+3CO2↑
Al2S3:Al2S3+6H2O=2Al(OH)3↓+3H2S↑
(四)沉淀溶解平衡与溶度积
1. 沉淀溶解平衡
定义:在一定条件下,难溶电解质在水溶液中的溶解速率与离子在固体表面结合为沉淀的速率相等时,沉淀质量和溶液中离子浓度保持不变的状态称为沉淀溶解平衡。
特征:动、等、定、变
PbI2 (s)Pb2+(aq)+2I-(aq) K=[Pb2+]×[I-]2/[PbI2]
[PbI2]为常数, 则Ksp=K·[PbI2] Ksp=[Pb2+]×[I-]2
2. 溶度积常数Ksp
定义:达到沉淀溶解平衡时,难溶电解质电离出的离子浓度的系数次方的乘积为一常数,称为溶度积常数或溶度积。
表达式:AmBn(s) mAn+(aq)+nBm- (aq) Ksp=[An+]m×[Bm-]n
单位:有单位,与离子的系数有关
意义:Ksp反映了难溶电解质在水中的溶解能力
当化学式所表示的组成中阴阳离子个数比相同时,Ksp越大,难溶电解质在水中的溶解能力越强。(不同时,不能用Ksp直接比较。需用达平衡时共同离子的浓度比较,浓度越大,溶解能力越强。)
【说明】Ksp只与难溶电解质自身性质和温度有关,与沉淀的量和离子的浓度无关。
3. 影响平衡移动的因素
(1)内因:难溶电解质自身的性质 (影响Ksp)
(2)外因:勒夏特列原理
①温度:一般温度越高,Ksp越大,平衡向沉淀溶解的方向移动。
②浓度:加水稀释,Ksp不变,沉淀溶解平衡向溶解方向移动。
③同离子效应:向平衡体系中加入含有相同离子的易溶电解质,平衡向生成沉淀的方向移动。
(五)离子反应
书写离子方程式的注意事项如下:
(1)原理清、产物准。例如铜分别与浓硝酸、稀硝酸反应还原产物不同。
(2)“拆与不拆”:在水溶液中进行的反应,只有易溶的强电解质才能拆写成离子形式,其它物质(难溶、难电离、易挥发物质、单质、非电解质、氧化物)都写成化学式的形式。
(3)微溶物[如Ca(OH)2、CaSO4、Ag2SO4]要视具体情况而定:浊液写化学式(如石灰乳),澄清液写离子形式(如澄清石灰水)。
(4)多种离子参加反应时,既不要漏写,也不要将系数错误化简。
例如:H2SO4和Ba(OH)2反应的离子方程式:
①Ba2++SO42-=BaSO4↓或 H++OH-=H2O ,错误漏写内容。
②Ba2++SO42-+H++OH-=BaSO4↓+H2O ,错误,化简错误。
③Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O ,正确。
(5)反应物的量不同,离子方程式不同。首先找出参加反应的离子,不足量的物质所提供的离子必定全部反应,所以其比值必定满足其化学式中的系数比,将其按照系数比写出,然后将过量的物质提供的离子按不足量物质离子所需要的数值写出;若出现分数,则在方程式两边同乘以一个数变为整数即可。
例如:NaHSO4 与Ba(OH)2(不足)反应和NaHSO4 与Ba(OH)2(过量)反应。
两反应中参加反应的离子均为H+、OH-、Ba2+、SO42-,前者是Ba(OH)2不足,所以先将Ba2+和OH-按1:2写出,然后1个Ba2+需要1个SO42-,2个OH-需要2个H+,配平产物系数即可:Ba2++2 OH-+SO42-+2H+=BaSO4↓+2H2O。而后者是NaHSO4 不足,所以先将SO42- 和H+按1:1写出,然后1个SO42-需要1个Ba2+,1个H+需要1个OH-,配平产物系数即可:Ba2++SO42-+H++OH-=BaSO4↓+H2O
(6)顺序不同,离子方程式不同。例如:
向Na2CO3溶液中逐滴滴入稀盐酸直至过量:
CO32-+H+==HCO3- HCO3-+H+== CO2↑+ H2O
向盐酸中逐滴滴入Na2CO3溶液直至过量:
CO32-+2H+==CO2↑+ H2O
【典型例题】
例1. 等体积混合0.1mol·L-1的盐酸和0.06mol.L-1·Ba(OH )2溶液,不考虑体积效应,即认为混合溶液的体积等于进行混合的两溶液体积之和,溶液的pH等于( )
A. 2.0 B. 12.3 C. 1.7 D 12.0
解析:该题目是酸碱混合的计算。首先要判断哪种物质过量,盐酸溶液的〔H+〕=0.1mol·L-1,Ba(OH)2溶液的〔OH-〕=0.06 mol·L-1×2=0.12mol·L-1 ,故碱过量。又因为等体积混合,可求出溶液中〔OH-〕的值为:(0.12mol·L-1 -0.1mol·L-1 )/2=0.01 mol·L-1
所以,pH=-lg〔H+〕=14+lg〔OH-〕=14+lg0.01=14-2=12
答案:D
点评:酸碱混合求pH关键是判断反应中什么物质过量,然后确定计算对象。
例2. 在Na2CO3溶液中,下列离子浓度关系不正确的是( )
A. c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
B. c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2 c(CO32-)
C. c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D. c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
解析:在Na2CO3溶液中,Na2CO3全部电离,Na2CO3=2Na++CO32-,且存在着水解平衡:CO32-+H2OHCO3-+OH-,HCO3-+H2O H2CO3+OH-。 因水解是微弱的,故c(Na+)>c(CO32-)>c(OH-)> c(HCO3-),则A错误。
根据溶液中电荷守恒,可得c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2 c(CO32-),故B正确。由元素守恒可得出C正确。溶液中的OH-全来自于H2O的电离,而水电离出的H+在溶液中以H+、HCO3- 和H2CO3的形式存在.由于水电离出的H+和OH-是相等的,水电离出的OH-的浓度为c(H+)、c(HCO3-)和2c(H2CO3)的和,即H+守恒,可知D答案正确。
答案:A
点评:判断离子浓度大小需要综合电离、水解等知识,还要利用各种守恒关系来灵活推断。
例3. 已知Ksp(AgCl)=1.8×10-10mol2·L-2 ,将0.001 mol·L-1 的NaCl溶液 和0.001 mol·.L-1 的AgNO3溶液等体积混合,是否有AgCl沉淀生成?
解析:两溶液等体积混合后,Ag+和Cl- 的浓度都等于原来浓度的1/2:
[Ag+]=[Cl-]=1/2 ×0.001= 0.0005 mol·L-1
在混合溶液中,Q=[ Ag+]·[Cl-]=( 0.0005 mol.L-1 )2
=2.5×10-7mol2·L-2
已知AgCl 的Ksp=1.8×10-10mol2·L-2 ,因为Q>Ksp ,所以有AgCl沉淀生成。
答案:有AgCl沉淀生成。
点评:本题考查溶度积的直接运算。
例4. 下列离子方程式中,正确的是( )
A. FeSO4溶液与H2O2溶液混合:Fe2++2H2O2+4H+== Fe3++4 H2O
B. 小苏打溶液与稀硫酸混合:CO32-+2 H+== CO2↑+ H2O
C. 大理石溶解于醋酸:CaCO3+2 H+==Ca2++ CO2↑+ H2O
D. 明矾溶液水解:Al3++3 H2O Al(OH)3+3 H+
E. 氢氧化铁与氢碘酸反应:Fe(OH)3+3 H+==Fe3++ 3H2O
解析:选项A中电荷不守恒,正确的为2Fe2++H2O2+2H+== 2Fe3++2 H2O。
选项B中小苏打为NaHCO3 , HCO3-在书写方程式时不能拆开写,正确的为:
HCO3-+H+==CO2↑+H2O
选项C中醋酸为弱电解质,在写离子方程式时应写出其化学式,正确的为:
CaCO3+2 CH3COOH ==Ca2++2CH3COO-+CO2↑+ H2O
选项D是正确的。
选项E 中生成的Fe3+还要与I- 发生氧化还原反应,正确的为:
2Fe(OH)3+6H++ 2I-==2 Fe2++ 6H2O+I2
答案:D
点评:正确书写离子方程式需要“观六路、听八方”,不可顾此失彼。
21世纪教育网
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第三章《物质在水溶液中的行为》
一. 教学内容:
《物质在水溶液中的行为》
二. 教学目标:
1. 掌握pH的简单计算及其与溶液酸碱性的关系
2. 理解影响盐类水解的因素以及水解平衡的移动
3. 了解沉淀溶解平衡的概念及其影响因素
4. 会熟练书写常见反应的离子方程式
三. 教学重点、难点
pH的有关计算及离子方程式的书写
四. 知识分析
(一)溶液的酸碱性与pH的计算
1. 溶液的酸碱性
(1)表示方法:H+浓度、OH-浓度、pH.
(2)酸碱性强弱判断标准:〔H+〕和〔OH-〕 相对大小、pH大小、指示剂.
酸性溶液:〔H+〕>〔OH-〕碱性溶液:〔H+〕<〔OH-〕中性溶液:〔H+〕=〔OH-〕
2. 有关溶液pH的求算
(1)单一溶液
①强酸:先求出溶液的H+浓度,再通过pH=-lg〔H+〕求溶液的pH。
②强碱:先求出溶液的OH-浓度,再通过〔H+〕=Kw/〔OH-〕求出溶液的H+浓度,最后求得pH。
(2)溶液的冲稀(强酸或强碱)
①一般冲稀(冲稀后pH ≤6的酸或pH ≥8的碱):不要考虑水电离出的H+(酸溶液中)和OH-(碱溶液中),而酸电离出的H+或碱电离出的OH-的物质的量是主体。
②无限冲稀(冲稀后pH>6的酸或pH<8的碱):需要考虑水电离出的H+和 OH-
(3)溶液的混合(不考虑体积效应)
①强酸和强酸:〔H+〕={[H+]1·V1+[H+]2·V2}/(V1+V2);
pH=-lg〔H+〕。
②强碱和强碱:〔OH-〕={[OH-]1·V1+[OH-]2·V2}/(V1+V2);
〔H+〕=Kw/〔OH-〕;
pH=-lg〔H+〕。
【规律总结】0.3规律:pH不同(差2个单位及以上)的两强酸溶液等体积混合,混合液的pH 值比强的弱0.3;
pH不同(差2个单位及以上)的两强碱溶液等体积混合,混合液的pH 值比强的弱0.3;
③强酸和强碱:
酸过量:〔H+〕={[H+]酸·V酸-[OH-]碱·V碱}/(V酸+V碱)
碱过量:〔OH-〕={[OH-]碱·V碱-[H+]酸·V酸}/(V碱+V酸)
恰好中和:则溶液呈中性
(二)弱电解质的电离平衡
1. 电离平衡
(1)研究对象:弱电解质
(2)电离平衡的建立:CH3COOHCH3COO—+H+
(3)定义:在一定条件(如温度、浓度)下,当电解质电离成离子的速率和离子重新结合成分子的速率相等时,电离就达到了平衡状态,这叫做电离平衡。
(4)电离平衡的特点:
动:V电离=V结合;定:条件一定时,各组分浓度一定;变:条件改变时,平衡移动
2. 电离平衡常数
(1)特点与意义:
电离常数受温度影响,与溶液浓度无关,温度一定,电离常数一定。根据同一温度下电离常数的大小可判断弱电解质电离能力的相对强弱。
(2)表达式:CH3COOHCH3COO—+H+
Ka=[CH3COO—][H+]/ [CH3COOH]
注:弱酸的电离常数越大,[H+]越大,酸性越强;反之,酸性越弱。
H3PO4H2PO4—+H+ Ka1=7.1 × 10—3mol·L—1
H2PO4—HPO42—+H+ Ka2=6.2 × 10—8mol·L—1
HPO42—PO43—+H+ Ka3=4.5× 10—13mol·L—1
注:多元弱酸各级电离常数逐级减少,且一般相差很大,故氢离子主要由第一步电离产生
弱碱与弱酸具类似规律:NH3·H2O NH4++OH—
Kb=[NH4+][OH—]/[NH3·H2O]
室温:Kb(NH3·H2O)=1.7 × 10—5mol·L—1
3. 电离度
α=已电离的溶质分子数/原始溶质分子总数 × 100%
注:①同温同浓度,不同的电解质的电离度不同
②同一弱电解质,在不同浓度的水溶液中,电离度不同;溶液越稀,电离度越大。
4. 影响电离平衡的因素
内因:电解质本身的性质
外因:(符合勒夏特列原理)
(1)温度:升高温度,电离平衡向电离的方向移动(若温度变化不大,一般不考虑其影响)
(2)浓度:
①加水稀释,电离平衡向电离的方向移动,即溶液浓度越小,弱电解质越易电离。
②加入某强电解质(含弱电解离子),电离平衡向生成弱电解质的方向移动。
③加入某电解质,消耗弱电解质离子,电离平衡向电离的方向移动
(三)盐类的水解
1. 盐类水解的概念
(1)原理:CH3COONa溶液:CH3COONa=Na++CH3COO—;
H2OOH—+H+;CH3COO—+H+CH3COOH
即:CH3COO—+H2O CH3COOH+OH—
故:溶液中[OH—]﹥[H+],溶液显碱性。
NH4Cl溶液:NH4Cl=NH4++Cl—;
H2O OH—+H+;NH4++OH—NH3·H2O
即:NH4++H2O NH3·H2O+H+
故:溶液中[H+]﹥[OH—],溶液呈酸性。
(2)定义:盐电离产生的离子与水电离产生的H+或OH—结合生成弱电解质,从而破坏了水的电离平衡,而使溶液呈现不同程度的酸、碱性,叫盐类的水解。
(3)实质:破坏水的电离平衡。
(4)规律:“有弱才水解,无弱不水解,越弱越水解,谁强显谁性,同强显中性”。
(5)多元弱酸酸根离子的水解分步进行:
CO32—+H2O HCO3—+OH—
HCO3—+H2O H2CO3+OH— (很小,可忽略)
多元弱碱阳离子的水解分步进行复杂,以总反应表示:Al3++3H2O Al(OH)3+3H+
【说明】水解反应一般程度都很小,水解产物很少,无明显沉淀、气体生成。
2. 水解平衡的移动
(1)影响盐类水解平衡的因素
内因:盐本身的性质, 组成盐的酸或碱越弱,盐的水解程度越大。
外因:①温度:升高温度,平衡向水解的方向移动——盐类的水解是吸热反应。
思考:为什么热的纯碱溶液去污效果比冷的好?
②盐溶液的浓度:盐溶液的浓度越小,盐就越易水解,加水稀释促进盐溶液的水解,平衡正方向移动,水解程度增大;如果增大盐的浓度,水解平衡虽然正向移动,但水解程度减小。
③溶液的酸碱性:加酸,抑制弱碱阳离子的水解;加碱,抑制弱酸根离子的水解。
(2)某些弱酸弱碱盐双水解
泡沫灭火器的灭火原理:3HCO3— + Al3+= Al(OH)3↓+3CO2↑
Al2S3:Al2S3+6H2O=2Al(OH)3↓+3H2S↑
(四)沉淀溶解平衡与溶度积
1. 沉淀溶解平衡
定义:在一定条件下,难溶电解质在水溶液中的溶解速率与离子在固体表面结合为沉淀的速率相等时,沉淀质量和溶液中离子浓度保持不变的状态称为沉淀溶解平衡。
特征:动、等、定、变
PbI2 (s)Pb2+(aq)+2I-(aq) K=[Pb2+]×[I-]2/[PbI2]
[PbI2]为常数, 则Ksp=K·[PbI2] Ksp=[Pb2+]×[I-]2
2. 溶度积常数Ksp
定义:达到沉淀溶解平衡时,难溶电解质电离出的离子浓度的系数次方的乘积为一常数,称为溶度积常数或溶度积。
表达式:AmBn(s) mAn+(aq)+nBm- (aq) Ksp=[An+]m×[Bm-]n
单位:有单位,与离子的系数有关
意义:Ksp反映了难溶电解质在水中的溶解能力
当化学式所表示的组成中阴阳离子个数比相同时,Ksp越大,难溶电解质在水中的溶解能力越强。(不同时,不能用Ksp直接比较。需用达平衡时共同离子的浓度比较,浓度越大,溶解能力越强。)
【说明】Ksp只与难溶电解质自身性质和温度有关,与沉淀的量和离子的浓度无关。
3. 影响平衡移动的因素
(1)内因:难溶电解质自身的性质 (影响Ksp)
(2)外因:勒夏特列原理
①温度:一般温度越高,Ksp越大,平衡向沉淀溶解的方向移动。
②浓度:加水稀释,Ksp不变,沉淀溶解平衡向溶解方向移动。
③同离子效应:向平衡体系中加入含有相同离子的易溶电解质,平衡向生成沉淀的方向移动。
(五)离子反应
书写离子方程式的注意事项如下:
(1)原理清、产物准。例如铜分别与浓硝酸、稀硝酸反应还原产物不同。
(2)“拆与不拆”:在水溶液中进行的反应,只有易溶的强电解质才能拆写成离子形式,其它物质(难溶、难电离、易挥发物质、单质、非电解质、氧化物)都写成化学式的形式。
(3)微溶物[如Ca(OH)2、CaSO4、Ag2SO4]要视具体情况而定:浊液写化学式(如石灰乳),澄清液写离子形式(如澄清石灰水)。
(4)多种离子参加反应时,既不要漏写,也不要将系数错误化简。
例如:H2SO4和Ba(OH)2反应的离子方程式:
①Ba2++SO42-=BaSO4↓或 H++OH-=H2O ,错误漏写内容。
②Ba2++SO42-+H++OH-=BaSO4↓+H2O ,错误,化简错误。
③Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O ,正确。
(5)反应物的量不同,离子方程式不同。首先找出参加反应的离子,不足量的物质所提供的离子必定全部反应,所以其比值必定满足其化学式中的系数比,将其按照系数比写出,然后将过量的物质提供的离子按不足量物质离子所需要的数值写出;若出现分数,则在方程式两边同乘以一个数变为整数即可。
例如:NaHSO4 与Ba(OH)2(不足)反应和NaHSO4 与Ba(OH)2(过量)反应。
两反应中参加反应的离子均为H+、OH-、Ba2+、SO42-,前者是Ba(OH)2不足,所以先将Ba2+和OH-按1:2写出,然后1个Ba2+需要1个SO42-,2个OH-需要2个H+,配平产物系数即可:Ba2++2 OH-+SO42-+2H+=BaSO4↓+2H2O。而后者是NaHSO4 不足,所以先将SO42- 和H+按1:1写出,然后1个SO42-需要1个Ba2+,1个H+需要1个OH-,配平产物系数即可:Ba2++SO42-+H++OH-=BaSO4↓+H2O
(6)顺序不同,离子方程式不同。例如:
向Na2CO3溶液中逐滴滴入稀盐酸直至过量:
CO32-+H+==HCO3- HCO3-+H+== CO2↑+ H2O
向盐酸中逐滴滴入Na2CO3溶液直至过量:
CO32-+2H+==CO2↑+ H2O
【典型例题】
例1. 等体积混合0.1mol·L-1的盐酸和0.06mol.L-1·Ba(OH )2溶液,不考虑体积效应,即认为混合溶液的体积等于进行混合的两溶液体积之和,溶液的pH等于( )
A. 2.0 B. 12.3 C. 1.7 D 12.0
解析:该题目是酸碱混合的计算。首先要判断哪种物质过量,盐酸溶液的〔H+〕=0.1mol·L-1,Ba(OH)2溶液的〔OH-〕=0.06 mol·L-1×2=0.12mol·L-1 ,故碱过量。又因为等体积混合,可求出溶液中〔OH-〕的值为:(0.12mol·L-1 -0.1mol·L-1 )/2=0.01 mol·L-1
所以,pH=-lg〔H+〕=14+lg〔OH-〕=14+lg0.01=14-2=12
答案:D
点评:酸碱混合求pH关键是判断反应中什么物质过量,然后确定计算对象。
例2. 在Na2CO3溶液中,下列离子浓度关系不正确的是( )
A. c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
B. c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2 c(CO32-)
C. c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D. c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
解析:在Na2CO3溶液中,Na2CO3全部电离,Na2CO3=2Na++CO32-,且存在着水解平衡:CO32-+H2OHCO3-+OH-,HCO3-+H2O H2CO3+OH-。 因水解是微弱的,故c(Na+)>c(CO32-)>c(OH-)> c(HCO3-),则A错误。
根据溶液中电荷守恒,可得c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2 c(CO32-),故B正确。由元素守恒可得出C正确。溶液中的OH-全来自于H2O的电离,而水电离出的H+在溶液中以H+、HCO3- 和H2CO3的形式存在.由于水电离出的H+和OH-是相等的,水电离出的OH-的浓度为c(H+)、c(HCO3-)和2c(H2CO3)的和,即H+守恒,可知D答案正确。
答案:A
点评:判断离子浓度大小需要综合电离、水解等知识,还要利用各种守恒关系来灵活推断。
例3. 已知Ksp(AgCl)=1.8×10-10mol2·L-2 ,将0.001 mol·L-1 的NaCl溶液 和0.001 mol·.L-1 的AgNO3溶液等体积混合,是否有AgCl沉淀生成?
解析:两溶液等体积混合后,Ag+和Cl- 的浓度都等于原来浓度的1/2:
[Ag+]=[Cl-]=1/2 ×0.001= 0.0005 mol·L-1
在混合溶液中,Q=[ Ag+]·[Cl-]=( 0.0005 mol.L-1 )2
=2.5×10-7mol2·L-2
已知AgCl 的Ksp=1.8×10-10mol2·L-2 ,因为Q>Ksp ,所以有AgCl沉淀生成。
答案:有AgCl沉淀生成。
点评:本题考查溶度积的直接运算。
例4. 下列离子方程式中,正确的是( )
A. FeSO4溶液与H2O2溶液混合:Fe2++2H2O2+4H+== Fe3++4 H2O
B. 小苏打溶液与稀硫酸混合:CO32-+2 H+== CO2↑+ H2O
C. 大理石溶解于醋酸:CaCO3+2 H+==Ca2++ CO2↑+ H2O
D. 明矾溶液水解:Al3++3 H2O Al(OH)3+3 H+
E. 氢氧化铁与氢碘酸反应:Fe(OH)3+3 H+==Fe3++ 3H2O
解析:选项A中电荷不守恒,正确的为2Fe2++H2O2+2H+== 2Fe3++2 H2O。
选项B中小苏打为NaHCO3 , HCO3-在书写方程式时不能拆开写,正确的为:
HCO3-+H+==CO2↑+H2O
选项C中醋酸为弱电解质,在写离子方程式时应写出其化学式,正确的为:
CaCO3+2 CH3COOH ==Ca2++2CH3COO-+CO2↑+ H2O
选项D是正确的。
选项E 中生成的Fe3+还要与I- 发生氧化还原反应,正确的为:
2Fe(OH)3+6H++ 2I-==2 Fe2++ 6H2O+I2
答案:D
点评:正确书写离子方程式需要“观六路、听八方”,不可顾此失彼。
21世纪教育网
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
