化学:专题三《溶液中的离子反应》课件(苏教版选修4)
文档属性
| 名称 | 化学:专题三《溶液中的离子反应》课件(苏教版选修4) |

|
|
| 格式 | rar | ||
| 文件大小 | 113.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-11-30 00:00:00 | ||
图片预览








文档简介
课件23张PPT。溶液中的离子反应考纲要求 ①了解电解质的概念。了解强电解质和弱电解质的概念。
②了解电解质在水溶液中的电离,以及电解质溶液的导电性。
③了解弱电解质在水溶液中的电离平衡。
④了解水的电离,离子积常数。
⑤了解溶液pH的定义。了解测定溶液pH的方法,能进行pH的简单计算。例1.(07高考广东)下列说法正确的是( )
(A)硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
(B)蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
(C)Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
(D)天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源BD一.电解质 1. 在水溶液中或熔化状态下能导电的化合物2.非电解质:在水溶液中和熔化状态下都不能导电的化合物常见的非电解质:非金属氧化物、部分非金属氢化物(如:NH3)、大部分有机化合物常见的电解质:酸、 碱 、盐 、水、
活泼金属氧化物3.在水溶液中能完全电离的电解质叫强电解质。如:强酸、强碱、大多数盐、活泼金属氧化物4.在水溶液中部分电离的电解质(难电离)叫弱电解质。如:弱酸、弱碱和水练习1.下列说法正确的是( )
A.强电解质的导电能力一定大于弱电解质的导电能力。
B.溶于水能导电化合物都是电解质。
C.25℃时,0.1mol/L的盐酸中氢离子浓度大于0.1mol/L的醋酸中氢离子浓度。
D.BaSO4属于强电解质,所以其水溶液导电能力很强。C辨析:强电解质溶液的导电能力一定比弱电解质溶液的强吗? P188T1、P191T4例2.(2007年高考上海化学卷)已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/
c(CH3COOH)值增大,可以采取的措施是( )
(A)加少量烧碱溶液 (B)升高温度
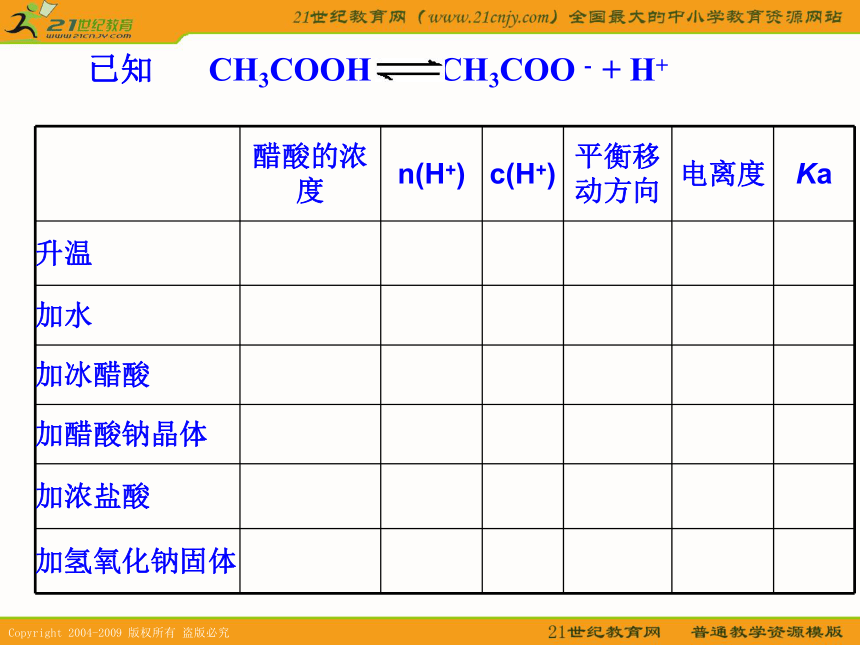
(C)加少量冰醋酸 (D)加水BD 二.电离平衡 1.定义:在一定条件下,当电解质分子电离成离子的速率和离子结合成分子的速率相等时,电离过程就达到了平衡状态。2.电离平衡状态的特点:
①逆②动③等④定⑤变.3.外界条件对电离平衡的影响① 温度:电离是一个吸热过程,升高温度,平衡右移。② 浓度:当改变平衡中某种微粒的浓度时,平衡将向着能够减弱这种改变的方向移动。4.电离度(用α表示)及Ka、Kb⑵影响因素① 温度:升高温度,电离度变大② 浓度:浓度越大,电离度越小;浓度越小,电离度越大。练习2:(2007年高考上海化学卷)下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
(A)相同浓度的两溶液中c(H+)相同
(B)100 mL 0.1 mol/L的两溶液能中和等物质的量的氢氧化钠
(C)pH=3的两溶液稀释100倍,pH都为5
(D)两溶液中分别加入少量对应的钠盐,c(H+)均明显减小B 证明醋酸为弱酸的常用方法:
1.0.1mol/L的醋酸溶液,测其pH大于1。
2.测醋酸钠溶液的pH大于7。
3.取pH=3的醋酸溶液1mL,用水稀释到100mL后,测其pH小于5。
4.分别测同体积0.1mL的醋酸溶液和盐酸溶液的导电性,盐酸强于醋酸。例3.(2007年高考理综天津卷)25 ℃时,水的电离达到平衡:H2O H++OH-;?H>0,下列叙述正确的是( )
(A)向水中加入稀氨水,平衡逆向移动,c(OH-)降低
(B)向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
(C)向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
(D)将水加热,KW增大,pH不变。B1.水的电离方程式:2.水的离子积:Kw== C(OH—) · C(H+)25℃时,Kw为1.0 × 10-14,纯水和稀溶液中都有上述关系存在。3.影响水电离的因素:⑴温度:水电离是一个吸热过程,升高温度,平衡右移,Kw变大。⑵加入酸或碱:水的电离受到抑制,平衡左移,Kw不变。三.水的电离⑶加入可水解的盐:水的电离受到促进,平衡左移,Kw不变。练习3. (2007年高考理综山东卷)氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
(A)再通入少量氯气,c(H+)/c(ClO-)减小
(B)通入少量SO2,溶液漂白性增强
(C)加入少量固体NaOH,一定有
c(Na+)=c(Cl-)+c(ClO-)
(D)加入少量水,水的电离平衡向正反应方向移动D[提示]原反应为:Cl2+H2O H++Cl-+HClO,再通入少量氯气后,c(H+)与c(HClO)同等程度增大,若HClO的电离度不变,c(H+)/c(ClO-)应该相等,但实际上HClO的电离度减小,使c(ClO-)增大倍数不够,所以c(H+)/c(ClO-)增大,A错。SO2与Cl2反应,二者的漂白性都减弱,B错。据电荷守恒有:c(Na+)+c(H+) = c(Cl-)+c(ClO-)+c(OH-),当溶液呈中性时,c(H+) = c(OH-),才有c(Na+)=c(Cl-)+c(ClO-),C错。例4.下列溶液一定呈中性的是( )
A.PH=6的氯化钠水溶液
B.0.1mol/L的醋酸与0.1mol/L的NaOH溶液等体积混合
C. 酸与碱恰好发生中和反应
D. 0.1mol/L的NaHCO3溶液A四.溶液的酸碱性1.溶液的酸碱性与c(H+) 与c(OH-)的关系=7>7<72.测定溶液酸碱性的方法酸碱指示剂、PH试纸、PH计3.有关PH的简单计算溶液的稀释:已知25℃时,CH3COOH溶液的Ka=1.8×10-5
(1)0.5mol/L的醋酸溶液的PH?
(2)将(1)中溶液稀释为原来的100倍时的PH。PH=8的NaOH溶液与PH=10的NaOH溶液等体积混合,求混合溶液的PH练习4:0.1mol/L的NaHSO4溶液呈 性,
原因是 .酸NaHSO4=Na++H++SO42-,使溶液中的c(H+) >c(OH-),所以溶液呈酸性.练习5.(2007年高考理综重庆卷)用食用白醋(醋酸浓度约为1 mol/L)进行下列实验,能证明醋酸为弱电解质的是( )
(A)白醋中滴入石蕊试液呈红色
(B)白醋加入豆浆中有沉淀产生
(C)蛋壳浸泡在白醋中有气体放出
(D)pH试纸显示醋酸的pH为2~3D练习6.(2007年高考海南化学卷)下列叙述正确的是( )
(A)95 ℃纯水的pH<7,说明加热可导致水呈酸性
(B)pH = 3的醋酸溶液,稀释至10倍后pH = 4
(C)0.2 mol·L-1的盐酸,与等体积水混合后pH = 1
(D)pH = 3的醋酸溶液,与pH = 11的氢氧化钠溶液等体积混合后pH = 7C4.酸碱中和滴定中和滴定的关键:1)准确测定体积 2)准确判断反应终点仪器: 锥形瓶 烧杯 铁架台 滴定管 滴定管夹关键步骤:
⑴验漏:转动活塞,观察是否漏水
⑵洗涤:用蒸馏水洗涤滴定管
⑶润洗:用待装液润洗2-3次.
⑷装液:至“0”刻度以上2-3mL⑸固定
⑹调“0”:ⅰ排气泡.ⅱ调至“0”或“0” 以下.
⑺记读数:v0
⑻取液: ⑼滴定:左手 右手 眼睛
⑽记读数v1,计算体积:v=v1-v0
⑾重复平行滴定2-3次
⑿计算:取其中合理数据求平均值,再计算。中和滴定的误差分析:
②了解电解质在水溶液中的电离,以及电解质溶液的导电性。
③了解弱电解质在水溶液中的电离平衡。
④了解水的电离,离子积常数。
⑤了解溶液pH的定义。了解测定溶液pH的方法,能进行pH的简单计算。例1.(07高考广东)下列说法正确的是( )
(A)硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
(B)蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
(C)Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
(D)天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源BD一.电解质 1. 在水溶液中或熔化状态下能导电的化合物2.非电解质:在水溶液中和熔化状态下都不能导电的化合物常见的非电解质:非金属氧化物、部分非金属氢化物(如:NH3)、大部分有机化合物常见的电解质:酸、 碱 、盐 、水、
活泼金属氧化物3.在水溶液中能完全电离的电解质叫强电解质。如:强酸、强碱、大多数盐、活泼金属氧化物4.在水溶液中部分电离的电解质(难电离)叫弱电解质。如:弱酸、弱碱和水练习1.下列说法正确的是( )
A.强电解质的导电能力一定大于弱电解质的导电能力。
B.溶于水能导电化合物都是电解质。
C.25℃时,0.1mol/L的盐酸中氢离子浓度大于0.1mol/L的醋酸中氢离子浓度。
D.BaSO4属于强电解质,所以其水溶液导电能力很强。C辨析:强电解质溶液的导电能力一定比弱电解质溶液的强吗? P188T1、P191T4例2.(2007年高考上海化学卷)已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/
c(CH3COOH)值增大,可以采取的措施是( )
(A)加少量烧碱溶液 (B)升高温度
(C)加少量冰醋酸 (D)加水BD 二.电离平衡 1.定义:在一定条件下,当电解质分子电离成离子的速率和离子结合成分子的速率相等时,电离过程就达到了平衡状态。2.电离平衡状态的特点:
①逆②动③等④定⑤变.3.外界条件对电离平衡的影响① 温度:电离是一个吸热过程,升高温度,平衡右移。② 浓度:当改变平衡中某种微粒的浓度时,平衡将向着能够减弱这种改变的方向移动。4.电离度(用α表示)及Ka、Kb⑵影响因素① 温度:升高温度,电离度变大② 浓度:浓度越大,电离度越小;浓度越小,电离度越大。练习2:(2007年高考上海化学卷)下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
(A)相同浓度的两溶液中c(H+)相同
(B)100 mL 0.1 mol/L的两溶液能中和等物质的量的氢氧化钠
(C)pH=3的两溶液稀释100倍,pH都为5
(D)两溶液中分别加入少量对应的钠盐,c(H+)均明显减小B 证明醋酸为弱酸的常用方法:
1.0.1mol/L的醋酸溶液,测其pH大于1。
2.测醋酸钠溶液的pH大于7。
3.取pH=3的醋酸溶液1mL,用水稀释到100mL后,测其pH小于5。
4.分别测同体积0.1mL的醋酸溶液和盐酸溶液的导电性,盐酸强于醋酸。例3.(2007年高考理综天津卷)25 ℃时,水的电离达到平衡:H2O H++OH-;?H>0,下列叙述正确的是( )
(A)向水中加入稀氨水,平衡逆向移动,c(OH-)降低
(B)向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
(C)向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
(D)将水加热,KW增大,pH不变。B1.水的电离方程式:2.水的离子积:Kw== C(OH—) · C(H+)25℃时,Kw为1.0 × 10-14,纯水和稀溶液中都有上述关系存在。3.影响水电离的因素:⑴温度:水电离是一个吸热过程,升高温度,平衡右移,Kw变大。⑵加入酸或碱:水的电离受到抑制,平衡左移,Kw不变。三.水的电离⑶加入可水解的盐:水的电离受到促进,平衡左移,Kw不变。练习3. (2007年高考理综山东卷)氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
(A)再通入少量氯气,c(H+)/c(ClO-)减小
(B)通入少量SO2,溶液漂白性增强
(C)加入少量固体NaOH,一定有
c(Na+)=c(Cl-)+c(ClO-)
(D)加入少量水,水的电离平衡向正反应方向移动D[提示]原反应为:Cl2+H2O H++Cl-+HClO,再通入少量氯气后,c(H+)与c(HClO)同等程度增大,若HClO的电离度不变,c(H+)/c(ClO-)应该相等,但实际上HClO的电离度减小,使c(ClO-)增大倍数不够,所以c(H+)/c(ClO-)增大,A错。SO2与Cl2反应,二者的漂白性都减弱,B错。据电荷守恒有:c(Na+)+c(H+) = c(Cl-)+c(ClO-)+c(OH-),当溶液呈中性时,c(H+) = c(OH-),才有c(Na+)=c(Cl-)+c(ClO-),C错。例4.下列溶液一定呈中性的是( )
A.PH=6的氯化钠水溶液
B.0.1mol/L的醋酸与0.1mol/L的NaOH溶液等体积混合
C. 酸与碱恰好发生中和反应
D. 0.1mol/L的NaHCO3溶液A四.溶液的酸碱性1.溶液的酸碱性与c(H+) 与c(OH-)的关系=7>7<72.测定溶液酸碱性的方法酸碱指示剂、PH试纸、PH计3.有关PH的简单计算溶液的稀释:已知25℃时,CH3COOH溶液的Ka=1.8×10-5
(1)0.5mol/L的醋酸溶液的PH?
(2)将(1)中溶液稀释为原来的100倍时的PH。PH=8的NaOH溶液与PH=10的NaOH溶液等体积混合,求混合溶液的PH练习4:0.1mol/L的NaHSO4溶液呈 性,
原因是 .酸NaHSO4=Na++H++SO42-,使溶液中的c(H+) >c(OH-),所以溶液呈酸性.练习5.(2007年高考理综重庆卷)用食用白醋(醋酸浓度约为1 mol/L)进行下列实验,能证明醋酸为弱电解质的是( )
(A)白醋中滴入石蕊试液呈红色
(B)白醋加入豆浆中有沉淀产生
(C)蛋壳浸泡在白醋中有气体放出
(D)pH试纸显示醋酸的pH为2~3D练习6.(2007年高考海南化学卷)下列叙述正确的是( )
(A)95 ℃纯水的pH<7,说明加热可导致水呈酸性
(B)pH = 3的醋酸溶液,稀释至10倍后pH = 4
(C)0.2 mol·L-1的盐酸,与等体积水混合后pH = 1
(D)pH = 3的醋酸溶液,与pH = 11的氢氧化钠溶液等体积混合后pH = 7C4.酸碱中和滴定中和滴定的关键:1)准确测定体积 2)准确判断反应终点仪器: 锥形瓶 烧杯 铁架台 滴定管 滴定管夹关键步骤:
⑴验漏:转动活塞,观察是否漏水
⑵洗涤:用蒸馏水洗涤滴定管
⑶润洗:用待装液润洗2-3次.
⑷装液:至“0”刻度以上2-3mL⑸固定
⑹调“0”:ⅰ排气泡.ⅱ调至“0”或“0” 以下.
⑺记读数:v0
⑻取液: ⑼滴定:左手 右手 眼睛
⑽记读数v1,计算体积:v=v1-v0
⑾重复平行滴定2-3次
⑿计算:取其中合理数据求平均值,再计算。中和滴定的误差分析:
