化学:8.1《应用广泛的金属材料-钢铁》教案(2)(第1课时)(沪科版高二第一学期)
文档属性
| 名称 | 化学:8.1《应用广泛的金属材料-钢铁》教案(2)(第1课时)(沪科版高二第一学期) |  | |
| 格式 | rar | ||
| 文件大小 | 17.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-12-01 12:59:00 | ||
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
8.1《应用广泛的金属材料——钢铁》
教师活动 内容 学生活动 目的
1 从石器、青铜器到铁器
讲述、投影图片 关于石器:“石器时代”的称呼被考古学家用来表示冶金时代以前的漫长时期,在这段时期中种石制工具的使用远比用其它(更软的)材料所制的工具来的多。最早的石器来自天然成型的石块,恰好满足某方面需要,后来发现人为的摔打也可能产生形状合适的石块,再后来是原地的敲打,直至历史性的进步——有目的性的磨制,史称新石器时代。在新石器时代诞生了制陶技术。关于青铜器:在对石块的研究中,人们发现了一些与众不同的个体,韧性好,难碎裂,带有光泽……自然界存在含有杂质的红铜矿,与锡矿石合炼获得青铜,硬度大、熔点低、制造性能好。关于铁器:铁在自然界中只以化合物的形式存在,所以直至掌握了炼制技术,人们才能获得纯度较大的铁(生铁)。煅打与百炼成钢:战国时期,即便兵器的主体是青铜,枪尖刀刃上也要使用另一种金属,可见这种金属在当时的贵重与性能优越。煅打可减少合金中的杂质含量,质地更加坚硬,接近现代意义上的钢。(注意:纯铁质软,不适合制作锅具、兵器;感磁性好,用作电器元件) 注意:合金的特点。了解青铜的主要成分。思考:为什么青铜器时代在铁器时代之前?思考:生铁、钢是不是金属纯净物? 利用化学史,为金属的通性、合金的性质做好铺垫。
2 金属的通性与金属键
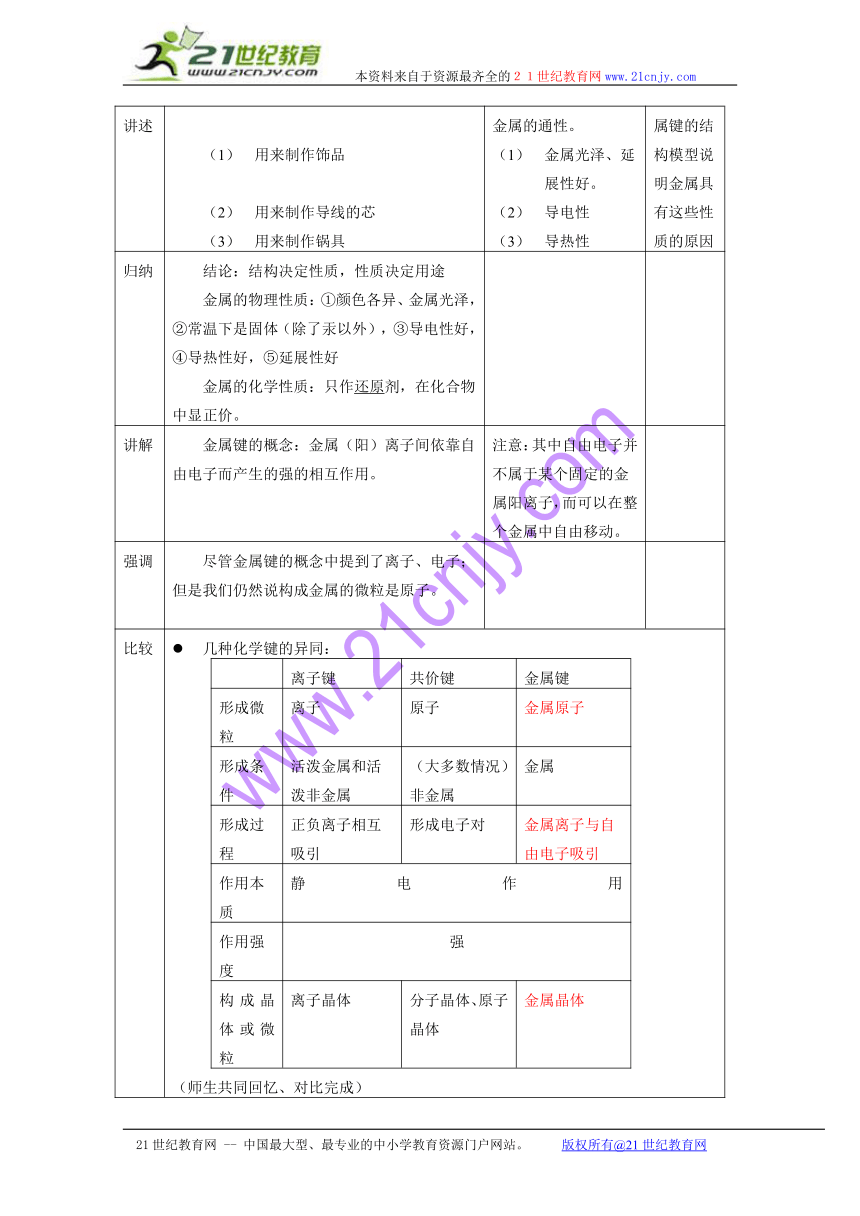
投影讲述 投影反应金属用途的图片。用来制作饰品用来制作导线的芯用来制作锅具 思考决定这些用途的金属的通性。金属光泽、延展性好。导电性导热性 开始用金属键的结构模型说明金属具有这些性质的原因
归纳 结论:结构决定性质,性质决定用途金属的物理性质:①颜色各异、金属光泽,②常温下是固体(除了汞以外),③导电性好,④导热性好,⑤延展性好金属的化学性质:只作还原剂,在化合物中显正价。
讲解 金属键的概念:金属(阳)离子间依靠自由电子而产生的强的相互作用。 注意:其中自由电子并不属于某个固定的金属阳离子,而可以在整个金属中自由移动。
强调 尽管金属键的概念中提到了离子、电子;但是我们仍然说构成金属的微粒是原子。
比较 几种化学键的异同:离子键共价键金属键形成微粒离子原子金属原子形成条件活泼金属和活泼非金属(大多数情况)非金属金属形成过程正负离子相互吸引形成电子对金属离子与自由电子吸引作用本质静电作用作用强度强构成晶体或微粒离子晶体分子晶体、原子晶体金属晶体(师生共同回忆、对比完成)决定各种化学键键能大小的因素*离子键:离子电荷数越大,离子半径越小,键能越大共价键:原子半径越小,键长越短,键能越大金属键:金属阳离子电荷数越大,半径越小,键能越大结构微粒、晶体类型和物质类型的关系
思考题 分子晶体的沸腾,破坏分子间作用力(范德化力),成为分散的分子;原子晶体的沸腾,破坏共价键,成为分散的原子;金属晶体的沸腾,破坏金属键,成为分散的原子,破坏金属键。已知金属的熔沸点、硬度高低取决于金属键的强弱,硬度Al>Mg>Na,这三种金属的金属键强弱为_____,沸点高低顺序为__________。
探究 从下面生产实例中体会金属晶体、离子晶体的熔沸点大致范围:原子晶体>离子晶体>金属晶体>分子晶体金刚石 NaCl K、Na、Fe CO2、O2 欣赏:工业生产金属钾Na+KCl——K+NaCl NaCl熔点为801℃ 沸点为1412℃KCl的熔点为773 ℃ 沸点为1420℃钾熔点为97.8℃,沸点为774 ℃钠熔点为63.7℃,沸点是882.9℃思考1:推测出大概的生产温度,建议借助数轴【钾的沸点最低,在774℃左右时,钾可以通过蒸汽导出,平衡向右移动,工业上生产钾的方法之一】思考2:钾单质是否算是廉价易得?理由1、2
21世纪教育网
www.
离子晶体
阴阳离子
离子化合物
(离子键)
结构微粒
晶体类型
物质类型
大量原子
(共价键)
原子晶体
非金属单质
共价化合物
分子晶体
分子
一些原子
(共价键)
范……
金属阳离子和自由电子
金属晶体
金属单质
某些合金
(金属键)
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
8.1《应用广泛的金属材料——钢铁》
教师活动 内容 学生活动 目的
1 从石器、青铜器到铁器
讲述、投影图片 关于石器:“石器时代”的称呼被考古学家用来表示冶金时代以前的漫长时期,在这段时期中种石制工具的使用远比用其它(更软的)材料所制的工具来的多。最早的石器来自天然成型的石块,恰好满足某方面需要,后来发现人为的摔打也可能产生形状合适的石块,再后来是原地的敲打,直至历史性的进步——有目的性的磨制,史称新石器时代。在新石器时代诞生了制陶技术。关于青铜器:在对石块的研究中,人们发现了一些与众不同的个体,韧性好,难碎裂,带有光泽……自然界存在含有杂质的红铜矿,与锡矿石合炼获得青铜,硬度大、熔点低、制造性能好。关于铁器:铁在自然界中只以化合物的形式存在,所以直至掌握了炼制技术,人们才能获得纯度较大的铁(生铁)。煅打与百炼成钢:战国时期,即便兵器的主体是青铜,枪尖刀刃上也要使用另一种金属,可见这种金属在当时的贵重与性能优越。煅打可减少合金中的杂质含量,质地更加坚硬,接近现代意义上的钢。(注意:纯铁质软,不适合制作锅具、兵器;感磁性好,用作电器元件) 注意:合金的特点。了解青铜的主要成分。思考:为什么青铜器时代在铁器时代之前?思考:生铁、钢是不是金属纯净物? 利用化学史,为金属的通性、合金的性质做好铺垫。
2 金属的通性与金属键
投影讲述 投影反应金属用途的图片。用来制作饰品用来制作导线的芯用来制作锅具 思考决定这些用途的金属的通性。金属光泽、延展性好。导电性导热性 开始用金属键的结构模型说明金属具有这些性质的原因
归纳 结论:结构决定性质,性质决定用途金属的物理性质:①颜色各异、金属光泽,②常温下是固体(除了汞以外),③导电性好,④导热性好,⑤延展性好金属的化学性质:只作还原剂,在化合物中显正价。
讲解 金属键的概念:金属(阳)离子间依靠自由电子而产生的强的相互作用。 注意:其中自由电子并不属于某个固定的金属阳离子,而可以在整个金属中自由移动。
强调 尽管金属键的概念中提到了离子、电子;但是我们仍然说构成金属的微粒是原子。
比较 几种化学键的异同:离子键共价键金属键形成微粒离子原子金属原子形成条件活泼金属和活泼非金属(大多数情况)非金属金属形成过程正负离子相互吸引形成电子对金属离子与自由电子吸引作用本质静电作用作用强度强构成晶体或微粒离子晶体分子晶体、原子晶体金属晶体(师生共同回忆、对比完成)决定各种化学键键能大小的因素*离子键:离子电荷数越大,离子半径越小,键能越大共价键:原子半径越小,键长越短,键能越大金属键:金属阳离子电荷数越大,半径越小,键能越大结构微粒、晶体类型和物质类型的关系
思考题 分子晶体的沸腾,破坏分子间作用力(范德化力),成为分散的分子;原子晶体的沸腾,破坏共价键,成为分散的原子;金属晶体的沸腾,破坏金属键,成为分散的原子,破坏金属键。已知金属的熔沸点、硬度高低取决于金属键的强弱,硬度Al>Mg>Na,这三种金属的金属键强弱为_____,沸点高低顺序为__________。
探究 从下面生产实例中体会金属晶体、离子晶体的熔沸点大致范围:原子晶体>离子晶体>金属晶体>分子晶体金刚石 NaCl K、Na、Fe CO2、O2 欣赏:工业生产金属钾Na+KCl——K+NaCl NaCl熔点为801℃ 沸点为1412℃KCl的熔点为773 ℃ 沸点为1420℃钾熔点为97.8℃,沸点为774 ℃钠熔点为63.7℃,沸点是882.9℃思考1:推测出大概的生产温度,建议借助数轴【钾的沸点最低,在774℃左右时,钾可以通过蒸汽导出,平衡向右移动,工业上生产钾的方法之一】思考2:钾单质是否算是廉价易得?理由1、2
21世纪教育网
www.
离子晶体
阴阳离子
离子化合物
(离子键)
结构微粒
晶体类型
物质类型
大量原子
(共价键)
原子晶体
非金属单质
共价化合物
分子晶体
分子
一些原子
(共价键)
范……
金属阳离子和自由电子
金属晶体
金属单质
某些合金
(金属键)
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
