第1节 碳的多样性
图片预览











文档简介
课件30张PPT。第一课时碳单质和化合物
课前延伸学案答案【自我检测】
1.B 2.D3.AC4.C第1节 碳的多样性 安丘市实验中学
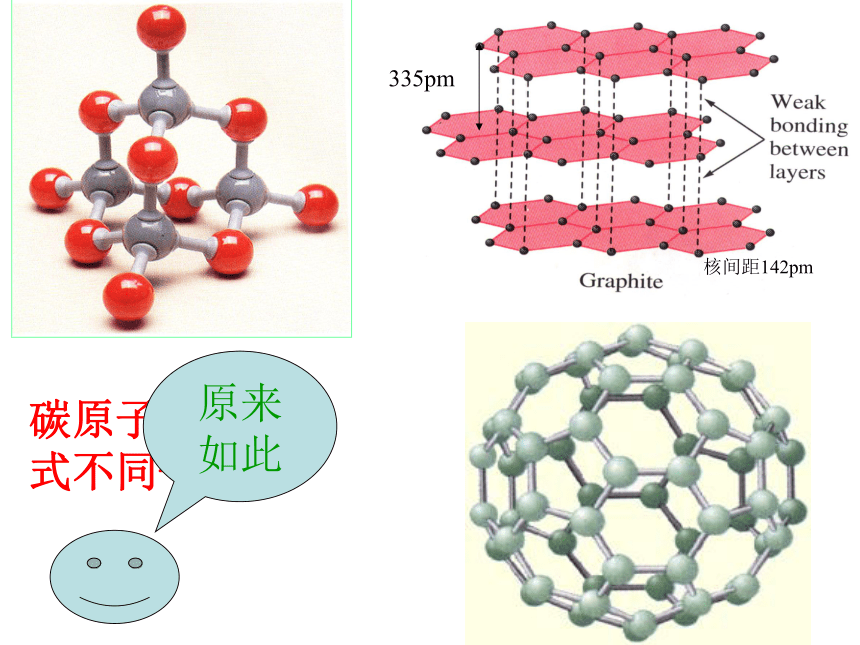
李廷勋阅读P62 第一部分:多种多样的碳单质金刚石1、这些物质都含有什么元素,以什么形态存在?2、你身边还有什么物质含有这种元素?一、多种多样的碳单质石 墨 深灰色、硬度小、不透明、易导电的片状固体,熔点极高。金刚石 金刚石是硬度极高,熔点极高的单质,无色透明的晶体,不导电。C60 灰黑色的固体,不导电,又名富勒烯、足球烯 C60分子模型组成原子相同的单质,性质咋就差别这么的呢?碳原子的排列方式不同--?!原来如此碳的单质:C20 、C40 、C70C20C40C70 由同一种元素组成的性质不同的几种单质,叫做该元素的同素异形体。 金刚石、石墨、和C60 是碳元素
的同素异形体。
同素异形体[活动探究]
(1)同是碳元素组成的这些单质物理性质为什么不同?化学性质相同吗?
(2)同学们还知道哪些物质之间属于同素异形体的关系?
物理性质不同化学性质基本相同氧气和 O3 是氧元素的同素异形体。白磷和红磷是磷元素的同素异形体。[体验1] 下列叙述中,正确的是 ( )A、由碳元素组成的物质一定是纯净物
B、金刚石和石墨有相同的元素组成
C、石墨转变为金刚石的反应属于氧化还原反应
D、C60是新发现的一种碳的单质B二、广泛存在的含碳化合物有机物:天然气、淀粉、蛋白质等无机物:二氧化碳
大理石、方解石、白云石、菱镁矿、
菱锌矿、菱铁矿
碳元素在自然界中主要以化合物的形式存在纯碱或苏打小苏打Na2CO3.10H2O——白色 固体白色固体碳酸钠比碳酸氢钠易溶于水碳酸钠、碳酸氢钠比较活动探究 预测碳酸钠和碳酸氢钠有哪些化学性质并设计实验探究
试剂:
碳酸钠、碳酸氢钠、盐酸、澄清石灰水、Ba(OH)2溶液、CaCl2溶液、
BaCl2溶液、NaOH 溶液碳酸钠、碳酸氢钠的化学性质与酸反应与某些碱反应与某些盐反应热稳定性与 酸 反 应 结论:
碳酸钠和碳酸氢钠都易与酸反应,但是
碳酸氢钠与酸反应比碳酸钠更剧烈。能与所有可溶碱反应生成碳酸正盐和水NaHCO3+NaOH=Na2CO3+H2OHCO3-+OH -=CO32-+H2O 易与Ba2+、Ca2+的碱反应生成碳酸盐沉淀和NaOH 与某些碱反应与 某些盐 反 应与可溶性的钙盐、钡盐反应生成沉淀也可与某些盐反应碳酸氢钠受热分解实验装置:结论:
加热时,碳酸钠不分解,而碳酸氢钠则分解。即:碳酸钠比碳酸氢钠更稳定。碳酸钠受热不分解 所以可以利用它们对热的稳定性来鉴别它们。热稳定性Na2CO3与NaHCO3的化学性质比较产生气泡CO32-+2H+= CO2↑ + H2O
HCO3-+H+= CO2↑ +H2O无明显现象Na2CO3不反应
HCO3-+OH-= CO32- +H2O产生白色沉淀CO32-+Ca2+= Ca CO3↓
Ca2+ +HCO3-+OH- =
Ca CO3 ↓ +H2ONa2CO3产生白色沉淀
NaHCO3无现象CO32-+Ca2+= Ca CO3↓
NaHCO3不反应Na2CO3无现象
NaHCO3分解产生CO2Na2CO3与NaHCO3的相互转变
⒈ Na2CO3转变成 NaHCO3
_____________________________
⒉ NaHCO3转变成Na2CO3
①______________________________
②_______________________________如何鉴别碳酸钠和碳酸氢钠
[活动探究]: 方法一:分别取少量固体加热,能产生使澄清石灰水变浑浊的气体的为碳酸氢钠 方法二: 先让固体溶于水配成溶液再加入可溶性的钙盐或钡盐,生成白色沉淀的是碳酸钠。如何鉴别碳酸钠溶液和碳酸氢钠溶液
[活动探究]: 方法一:分别取少量溶液加热,能产生使澄清石灰水变浑浊的气体的为碳酸氢钠 方法二: 加入可溶性的钙盐或钡盐,生成白色沉淀的是碳酸钠。如何证明碳酸氢钠与碱发生了反应
[活动探究]: 方法: 向溶液加入可溶性的钙盐或钡盐,若有生成白色沉淀证明发生了反应练习1.写出以下转化的化学方程式
Na2CO3 NaHCO3CO2和H2ONa2OH或加热2.如何除去Na2CO3固体中的NaHCO3
如何除去NaHCO3溶液中的Na2CO3【巩固检测】答案1.A2.D3.A4B5.D6.D【巩固检测】答案1D2C3 ad cf g e
D
本节小结1、碳单质—同素异形体概念及其性质最常见的碳单质有:金刚石、石墨、C60 2、 Na2CO3 和NaHCO3
1.B 2.D3.AC4.C第1节 碳的多样性 安丘市实验中学
李廷勋阅读P62 第一部分:多种多样的碳单质金刚石1、这些物质都含有什么元素,以什么形态存在?2、你身边还有什么物质含有这种元素?一、多种多样的碳单质石 墨 深灰色、硬度小、不透明、易导电的片状固体,熔点极高。金刚石 金刚石是硬度极高,熔点极高的单质,无色透明的晶体,不导电。C60 灰黑色的固体,不导电,又名富勒烯、足球烯 C60分子模型组成原子相同的单质,性质咋就差别这么的呢?碳原子的排列方式不同--?!原来如此碳的单质:C20 、C40 、C70C20C40C70 由同一种元素组成的性质不同的几种单质,叫做该元素的同素异形体。 金刚石、石墨、和C60 是碳元素
的同素异形体。
同素异形体[活动探究]
(1)同是碳元素组成的这些单质物理性质为什么不同?化学性质相同吗?
(2)同学们还知道哪些物质之间属于同素异形体的关系?
物理性质不同化学性质基本相同氧气和 O3 是氧元素的同素异形体。白磷和红磷是磷元素的同素异形体。[体验1] 下列叙述中,正确的是 ( )A、由碳元素组成的物质一定是纯净物
B、金刚石和石墨有相同的元素组成
C、石墨转变为金刚石的反应属于氧化还原反应
D、C60是新发现的一种碳的单质B二、广泛存在的含碳化合物有机物:天然气、淀粉、蛋白质等无机物:二氧化碳
大理石、方解石、白云石、菱镁矿、
菱锌矿、菱铁矿
碳元素在自然界中主要以化合物的形式存在纯碱或苏打小苏打Na2CO3.10H2O——白色 固体白色固体碳酸钠比碳酸氢钠易溶于水碳酸钠、碳酸氢钠比较活动探究 预测碳酸钠和碳酸氢钠有哪些化学性质并设计实验探究
试剂:
碳酸钠、碳酸氢钠、盐酸、澄清石灰水、Ba(OH)2溶液、CaCl2溶液、
BaCl2溶液、NaOH 溶液碳酸钠、碳酸氢钠的化学性质与酸反应与某些碱反应与某些盐反应热稳定性与 酸 反 应 结论:
碳酸钠和碳酸氢钠都易与酸反应,但是
碳酸氢钠与酸反应比碳酸钠更剧烈。能与所有可溶碱反应生成碳酸正盐和水NaHCO3+NaOH=Na2CO3+H2OHCO3-+OH -=CO32-+H2O 易与Ba2+、Ca2+的碱反应生成碳酸盐沉淀和NaOH 与某些碱反应与 某些盐 反 应与可溶性的钙盐、钡盐反应生成沉淀也可与某些盐反应碳酸氢钠受热分解实验装置:结论:
加热时,碳酸钠不分解,而碳酸氢钠则分解。即:碳酸钠比碳酸氢钠更稳定。碳酸钠受热不分解 所以可以利用它们对热的稳定性来鉴别它们。热稳定性Na2CO3与NaHCO3的化学性质比较产生气泡CO32-+2H+= CO2↑ + H2O
HCO3-+H+= CO2↑ +H2O无明显现象Na2CO3不反应
HCO3-+OH-= CO32- +H2O产生白色沉淀CO32-+Ca2+= Ca CO3↓
Ca2+ +HCO3-+OH- =
Ca CO3 ↓ +H2ONa2CO3产生白色沉淀
NaHCO3无现象CO32-+Ca2+= Ca CO3↓
NaHCO3不反应Na2CO3无现象
NaHCO3分解产生CO2Na2CO3与NaHCO3的相互转变
⒈ Na2CO3转变成 NaHCO3
_____________________________
⒉ NaHCO3转变成Na2CO3
①______________________________
②_______________________________如何鉴别碳酸钠和碳酸氢钠
[活动探究]: 方法一:分别取少量固体加热,能产生使澄清石灰水变浑浊的气体的为碳酸氢钠 方法二: 先让固体溶于水配成溶液再加入可溶性的钙盐或钡盐,生成白色沉淀的是碳酸钠。如何鉴别碳酸钠溶液和碳酸氢钠溶液
[活动探究]: 方法一:分别取少量溶液加热,能产生使澄清石灰水变浑浊的气体的为碳酸氢钠 方法二: 加入可溶性的钙盐或钡盐,生成白色沉淀的是碳酸钠。如何证明碳酸氢钠与碱发生了反应
[活动探究]: 方法: 向溶液加入可溶性的钙盐或钡盐,若有生成白色沉淀证明发生了反应练习1.写出以下转化的化学方程式
Na2CO3 NaHCO3CO2和H2ONa2OH或加热2.如何除去Na2CO3固体中的NaHCO3
如何除去NaHCO3溶液中的Na2CO3【巩固检测】答案1.A2.D3.A4B5.D6.D【巩固检测】答案1D2C3 ad cf g e
D
本节小结1、碳单质—同素异形体概念及其性质最常见的碳单质有:金刚石、石墨、C60 2、 Na2CO3 和NaHCO3
