质量守恒定律
图片预览






文档简介
课件24张PPT。§5 化学方程式 课题1 质量守恒定律
一天,福尔摩斯象往常一样滋滋有味地 抽着他的烟斗,房间里充满了刺鼻的烟味。华生问道:“敬爱的先生,别人都说你很聪明,那么你能告诉我你吐出的这些烟和气体有多重吗?”你猜得着吗福尔摩斯慢条斯理地说:“这个问题很简单,我只要称出抽烟前烟斗和烟丝的总重量,再减去抽完烟后烟斗和剩余烟灰的总重量,不就是我吐出烟和气体的重量了么!”1.提出问题
化学反应前后各物质的质量和是否会发生变化呢?科学探究 2 .猜想与假设
(1)参加反应的各物质的质量之和大于生成的各物质的质量之和。
(2)参加反应的各物质的质量之和等于生成的各物质的质量之和。
(3)参加反应的各物质的质量之和小于生成的各物质的质量之和。 让我们用实验和智慧来求证吧!实验1:
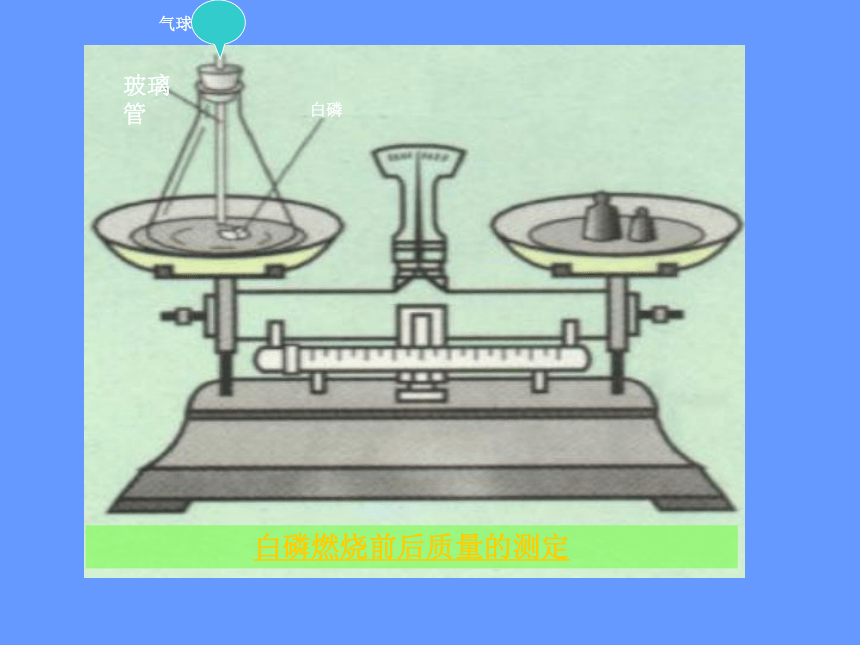
白磷燃烧前后质量的测定问题:1、白磷燃烧前,锥形瓶中沙子的作用?
2、为什么不能打开橡皮塞后再称量?
实验探究:
1.白磷燃烧前后质量总和如何变化?
注意:
观察老师操作,积极总结出实验时的注意事项。
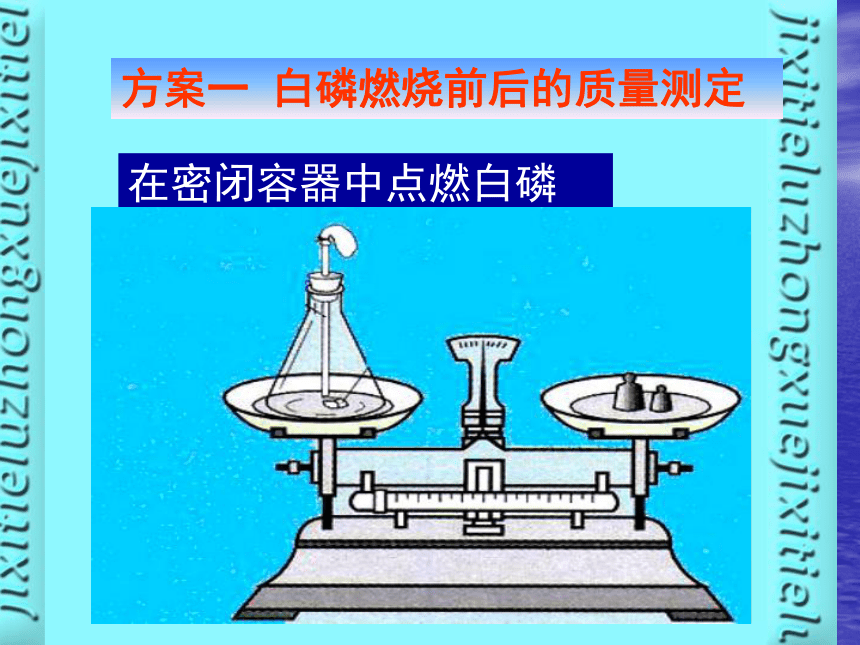
方案一 白磷燃烧前后的质量测定在密闭容器中点燃白磷注意事项:1.称量时天平应注意调平;
2.白磷燃烧时,锥形瓶底部应预先装一部分沙子;
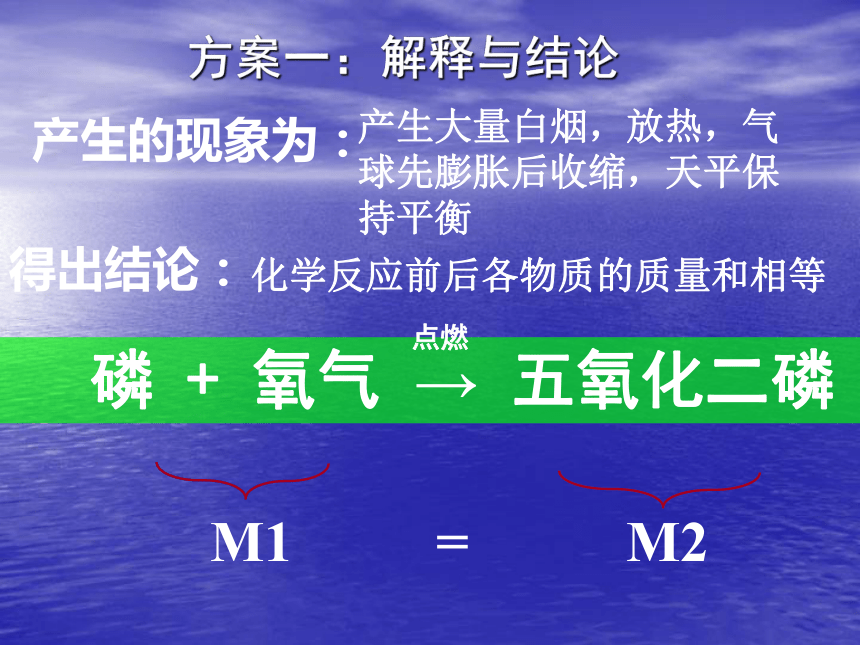
3.玻璃棒烧红后往锥形瓶中塞时动作要快,塞子要塞紧,不能漏气; M1 = M2产生的现象为:得出结论:
磷 + 氧气 → 五氧化二磷化学反应前后各物质的质量和相等产生大量白烟,放热,气球先膨胀后收缩,天平保持平衡
方案一:解释与结论点燃对比思考:反应前物质(或物体)反应后物质(或物体)锥形瓶细砂橡皮塞细铁丝(空气)氧气氮气白磷锥形瓶细砂橡皮塞细铁丝五氧化二磷(剩余气体)氮气白磷质量+氧气质量=五氧化二磷质量稀有气体等稀有气体等白磷五氧化二磷氧气结论: 发生化学反应时反应物的质量总和与生成物的质量总和存在相等的关系。思考:
在白磷燃烧的实验中,若玻璃管上端没有系小气球,将会出现什么结果?方案二:铁与硫酸铜溶液反应前后质量的测定资料:1、铁钉表面有一层氧化薄膜
2、硫酸铜溶液在空气一般不会变质;但是它有毒性,使用的时候不要用手接触到该溶液
(3)将试管内的溶液倒入烧杯(试管仍留在烧杯中),
使二者反应,观察实验现象产生蓝色沉淀(4)称量烧杯及烧杯内物质的总质量(1)将铁钉浸入装有蓝色硫酸铜溶液的烧杯中(2)称量烧杯及烧杯内物质的总质量(5)比较反应前后物质总质量的变化实验2:硫酸铜溶液和铁反应前后质量的测定蓝化学反应前后物质的质量总和没有改变方案二:解释与结论方案二:解释与结论产生的现象:铁钉表面覆盖一层红色物质,溶液由蓝色变成浅绿色,天平保持平衡铁+硫酸铜→铜 +硫酸亚铁得出结论:化学反应前后物质的质量和相等质量守恒定律参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
参加反应的
各物质的质
量总 和
生成的各物质的质量总和
资料链接:质量守恒定律的发现波义耳的实验(1673年)拉瓦锡的实验(1777年)失败成功查阅资料拉瓦锡使用的实验仪器如果设计在密闭容器中进行实验,杜绝反应系统与环境之间的物质交换,天平指针就不会偏转了。无论是密闭还是敞口系统,质量守恒的规律都客观存在。1673年,英国化学家波义耳就是在一只敞口容器中加热金属,结果与质量守恒擦肩而过。 1777年法国化学家拉瓦锡使用 比较精密的天平,用定量研究法, 在密闭容器中研究氧化汞的分解与合成中各物质之间的关系,发现了质量守恒关系,于是得出结论: “无论是人工的或自然的作用都没有创造出什么东西,物质在每一反应前的质量等于反应后的质量,这可认为是一个公理。”拉瓦锡把近代化学推进到定量研究的水平,被后人称为“定量化学之父”。质量守恒定律的发现1673年,英国化学家波义耳做了这样一个实验,他将金属汞放在一敞口容器里煅烧,冷却后进行称量,得出的结论是固体物质的质增加了。该实验导致波义耳与质量守恒定律擦肩而过。1、是什么原因导致波义耳未能发现质量守恒定律?2、说说你得到了什么启示?1.加热2.45g氯酸钾和0.8g二氧化锰的混合物,
完全反应后得氯化钾1.49g,同时生成氧气的质量
为 g。
2. 将3g镁在足量的氧气中完全燃烧,生成5g
氧化镁,参加反应的氧气的质量为 g。
0.9624.现有A、B、C、D四种物质在反应前后的质量关系如下表所示:参加反应的C质量为 克;反应后D的质量为 克,生成D的质量为 克。
一天,福尔摩斯象往常一样滋滋有味地 抽着他的烟斗,房间里充满了刺鼻的烟味。华生问道:“敬爱的先生,别人都说你很聪明,那么你能告诉我你吐出的这些烟和气体有多重吗?”你猜得着吗福尔摩斯慢条斯理地说:“这个问题很简单,我只要称出抽烟前烟斗和烟丝的总重量,再减去抽完烟后烟斗和剩余烟灰的总重量,不就是我吐出烟和气体的重量了么!”1.提出问题
化学反应前后各物质的质量和是否会发生变化呢?科学探究 2 .猜想与假设
(1)参加反应的各物质的质量之和大于生成的各物质的质量之和。
(2)参加反应的各物质的质量之和等于生成的各物质的质量之和。
(3)参加反应的各物质的质量之和小于生成的各物质的质量之和。 让我们用实验和智慧来求证吧!实验1:
白磷燃烧前后质量的测定问题:1、白磷燃烧前,锥形瓶中沙子的作用?
2、为什么不能打开橡皮塞后再称量?
实验探究:
1.白磷燃烧前后质量总和如何变化?
注意:
观察老师操作,积极总结出实验时的注意事项。
方案一 白磷燃烧前后的质量测定在密闭容器中点燃白磷注意事项:1.称量时天平应注意调平;
2.白磷燃烧时,锥形瓶底部应预先装一部分沙子;
3.玻璃棒烧红后往锥形瓶中塞时动作要快,塞子要塞紧,不能漏气; M1 = M2产生的现象为:得出结论:
磷 + 氧气 → 五氧化二磷化学反应前后各物质的质量和相等产生大量白烟,放热,气球先膨胀后收缩,天平保持平衡
方案一:解释与结论点燃对比思考:反应前物质(或物体)反应后物质(或物体)锥形瓶细砂橡皮塞细铁丝(空气)氧气氮气白磷锥形瓶细砂橡皮塞细铁丝五氧化二磷(剩余气体)氮气白磷质量+氧气质量=五氧化二磷质量稀有气体等稀有气体等白磷五氧化二磷氧气结论: 发生化学反应时反应物的质量总和与生成物的质量总和存在相等的关系。思考:
在白磷燃烧的实验中,若玻璃管上端没有系小气球,将会出现什么结果?方案二:铁与硫酸铜溶液反应前后质量的测定资料:1、铁钉表面有一层氧化薄膜
2、硫酸铜溶液在空气一般不会变质;但是它有毒性,使用的时候不要用手接触到该溶液
(3)将试管内的溶液倒入烧杯(试管仍留在烧杯中),
使二者反应,观察实验现象产生蓝色沉淀(4)称量烧杯及烧杯内物质的总质量(1)将铁钉浸入装有蓝色硫酸铜溶液的烧杯中(2)称量烧杯及烧杯内物质的总质量(5)比较反应前后物质总质量的变化实验2:硫酸铜溶液和铁反应前后质量的测定蓝化学反应前后物质的质量总和没有改变方案二:解释与结论方案二:解释与结论产生的现象:铁钉表面覆盖一层红色物质,溶液由蓝色变成浅绿色,天平保持平衡铁+硫酸铜→铜 +硫酸亚铁得出结论:化学反应前后物质的质量和相等质量守恒定律参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
参加反应的
各物质的质
量总 和
生成的各物质的质量总和
资料链接:质量守恒定律的发现波义耳的实验(1673年)拉瓦锡的实验(1777年)失败成功查阅资料拉瓦锡使用的实验仪器如果设计在密闭容器中进行实验,杜绝反应系统与环境之间的物质交换,天平指针就不会偏转了。无论是密闭还是敞口系统,质量守恒的规律都客观存在。1673年,英国化学家波义耳就是在一只敞口容器中加热金属,结果与质量守恒擦肩而过。 1777年法国化学家拉瓦锡使用 比较精密的天平,用定量研究法, 在密闭容器中研究氧化汞的分解与合成中各物质之间的关系,发现了质量守恒关系,于是得出结论: “无论是人工的或自然的作用都没有创造出什么东西,物质在每一反应前的质量等于反应后的质量,这可认为是一个公理。”拉瓦锡把近代化学推进到定量研究的水平,被后人称为“定量化学之父”。质量守恒定律的发现1673年,英国化学家波义耳做了这样一个实验,他将金属汞放在一敞口容器里煅烧,冷却后进行称量,得出的结论是固体物质的质增加了。该实验导致波义耳与质量守恒定律擦肩而过。1、是什么原因导致波义耳未能发现质量守恒定律?2、说说你得到了什么启示?1.加热2.45g氯酸钾和0.8g二氧化锰的混合物,
完全反应后得氯化钾1.49g,同时生成氧气的质量
为 g。
2. 将3g镁在足量的氧气中完全燃烧,生成5g
氧化镁,参加反应的氧气的质量为 g。
0.9624.现有A、B、C、D四种物质在反应前后的质量关系如下表所示:参加反应的C质量为 克;反应后D的质量为 克,生成D的质量为 克。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
