化学:1.1.2《化学反应的焓变》课件(鲁科版选修4)
文档属性
| 名称 | 化学:1.1.2《化学反应的焓变》课件(鲁科版选修4) |

|
|
| 格式 | rar | ||
| 文件大小 | 381.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-12-02 00:00:00 | ||
图片预览




文档简介
课件11张PPT。第一章化学反应与能量转化第1节化学反应的热效应二、化学反应的焓变 1.焓(H):是与体系的内能、压强、体积有关的一个物理量
2.焓变(△H) : △H=H生成物-H反应物
在等温等压条件下的化学反应,如果不做非体积功(即没有转化为电能、光能等其他形式的能),则该反应的反应热等于反应前后物质的焓变。即:Qp= △H
∵ Qp>0为吸热反应,Qp<0为放热反应
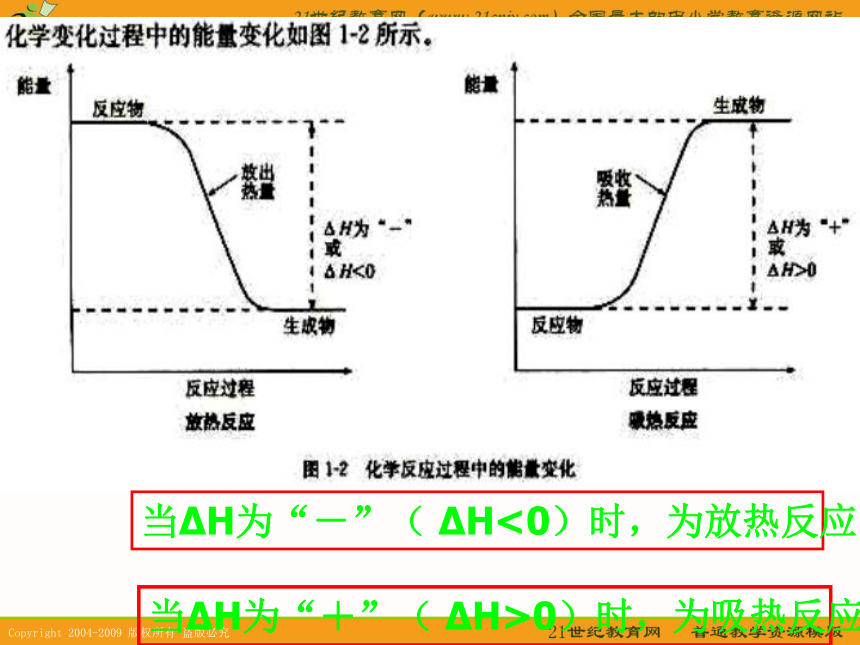
∴ 当ΔH >0时,为吸热反应。
当ΔH <0时,为放热反应。当?H为“-”( ?H<0)时,为放热反应当?H为“+”( ?H>0)时,为吸热反应与化学方程式相比,热化学方程式有哪些不同?
正确书写热化学方程式应注意哪几点?交流研讨 下列方程式属于热化学方程式: 意义:热化学方程式不仅表明了化学反应中的物质变化,
也表明了化学反应中的能量变化。1.定义:可表示参加反应物质的量和反应热的关系的方程式,叫做热化学方程式。
2.写法:
1)热化学方程式要注明反应的温度、压强(298 K,101 kPa时不写)一般不写其他反应条件;不标明生成沉淀或气体符号。
2)要注明反应物和生成物的聚集状态,常用s、l、g表示固体、液体、气体。三、热化学方程式3) ΔH后要注明反应温度,ΔH的单位为J·mol-1或KJ·mol-1
4)ΔH的值必须与方程式的化学计量数对应。计量数加倍时, ΔH也要加倍。当反应逆向进行时, 其ΔH与正反应的数值相等,符号相反。
5)方程式中的化学计量数以“mol”为单位,不表示分子数,因此可以是整数,也可以是小数或分数。
6) 可逆反应的ΔH表明的是完全反应时的数据。例 题1、当1mol气态H2与1mol气态Cl2反应
生成2mol气态HCl,放出184.6KJ的热
量,请写出该反应的热化学方程式。H2(g) + Cl2(g) =2HCl(g) ?H =-184.6KJ/mol写出下列反应的热化学方程式课堂练习1、1molN2(g)与适量O2(g)反应生成NO (g),需吸收68kJ的热量;
2、2molCu(s)与适量O2(g)反应生成CuO(s),放出314kJ热量;A2、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
( )A. H2O(g)=H2(g)+1/2O2(g);ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l);ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g);ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g);ΔH=+484kJ·mol-1 3、(2003·江苏)已知在25℃、101kPa下,1g
C8H18(辛烷)燃烧生成二氧化碳和液态水时放
出48.40kJ 热量。表示上述反应的热化学方程
式正确的是 ( )
A、C8H18(l)+25/2O2(g)=8CO2(g) +9H2O(g)
△H= - 48.40kJ·mol -1
B、C8H18(l)+25/2O2(g)=8CO2 (g) +9H2O(l)
△H= - 5518kJ·mol -1
C、C8H18(l)+25/2O2(g)=8CO2(g) + 9H2O(l)
△H= + 5518kJ·mol -1
D、C8H18(l)+25/2O2(g)=8CO2 (g)+ 9H2O(l)
△H= - 48.40kJ·mol -1B
2.焓变(△H) : △H=H生成物-H反应物
在等温等压条件下的化学反应,如果不做非体积功(即没有转化为电能、光能等其他形式的能),则该反应的反应热等于反应前后物质的焓变。即:Qp= △H
∵ Qp>0为吸热反应,Qp<0为放热反应
∴ 当ΔH >0时,为吸热反应。
当ΔH <0时,为放热反应。当?H为“-”( ?H<0)时,为放热反应当?H为“+”( ?H>0)时,为吸热反应与化学方程式相比,热化学方程式有哪些不同?
正确书写热化学方程式应注意哪几点?交流研讨 下列方程式属于热化学方程式: 意义:热化学方程式不仅表明了化学反应中的物质变化,
也表明了化学反应中的能量变化。1.定义:可表示参加反应物质的量和反应热的关系的方程式,叫做热化学方程式。
2.写法:
1)热化学方程式要注明反应的温度、压强(298 K,101 kPa时不写)一般不写其他反应条件;不标明生成沉淀或气体符号。
2)要注明反应物和生成物的聚集状态,常用s、l、g表示固体、液体、气体。三、热化学方程式3) ΔH后要注明反应温度,ΔH的单位为J·mol-1或KJ·mol-1
4)ΔH的值必须与方程式的化学计量数对应。计量数加倍时, ΔH也要加倍。当反应逆向进行时, 其ΔH与正反应的数值相等,符号相反。
5)方程式中的化学计量数以“mol”为单位,不表示分子数,因此可以是整数,也可以是小数或分数。
6) 可逆反应的ΔH表明的是完全反应时的数据。例 题1、当1mol气态H2与1mol气态Cl2反应
生成2mol气态HCl,放出184.6KJ的热
量,请写出该反应的热化学方程式。H2(g) + Cl2(g) =2HCl(g) ?H =-184.6KJ/mol写出下列反应的热化学方程式课堂练习1、1molN2(g)与适量O2(g)反应生成NO (g),需吸收68kJ的热量;
2、2molCu(s)与适量O2(g)反应生成CuO(s),放出314kJ热量;A2、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
( )A. H2O(g)=H2(g)+1/2O2(g);ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l);ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g);ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g);ΔH=+484kJ·mol-1 3、(2003·江苏)已知在25℃、101kPa下,1g
C8H18(辛烷)燃烧生成二氧化碳和液态水时放
出48.40kJ 热量。表示上述反应的热化学方程
式正确的是 ( )
A、C8H18(l)+25/2O2(g)=8CO2(g) +9H2O(g)
△H= - 48.40kJ·mol -1
B、C8H18(l)+25/2O2(g)=8CO2 (g) +9H2O(l)
△H= - 5518kJ·mol -1
C、C8H18(l)+25/2O2(g)=8CO2(g) + 9H2O(l)
△H= + 5518kJ·mol -1
D、C8H18(l)+25/2O2(g)=8CO2 (g)+ 9H2O(l)
△H= - 48.40kJ·mol -1B
