化学:第一章《认识化学科学》课件(鲁科版必修1)
文档属性
| 名称 | 化学:第一章《认识化学科学》课件(鲁科版必修1) |  | |
| 格式 | rar | ||
| 文件大小 | 114.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-12-04 13:59:00 | ||
图片预览






文档简介
课件15张PPT。第一章 认识化学科学
小结与复习高一化学知识结构图一、化学是一门科学
1 化学是创造性的、实用的科学
2 化学科学的形成发展
3 化学科学的探索空间化学的定义 化学就是在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。
化学的特征就是认识分子和制造分子,它是一门具有创造性的、实用的科学。化学科学的形成发展古代化学
近代化学
近代化学的发展里程碑
(1)1661年,英国化学家、物理学家波义耳提出化学元素的概念,标志着近代化学的诞生。
(2)1771年,法国化学家拉瓦锡建立燃烧现象的氧化学说,使近代化学取得了革命性的进步。
(3)1803年,英国物理学家、化学家道尔顿提出原子学说,为近代化学的发展奠定了坚实的基础。
(4)1869年,俄国化学家门捷列夫发现元素周期律,把化学元素及其化合物纳入一个统一的理论体系。
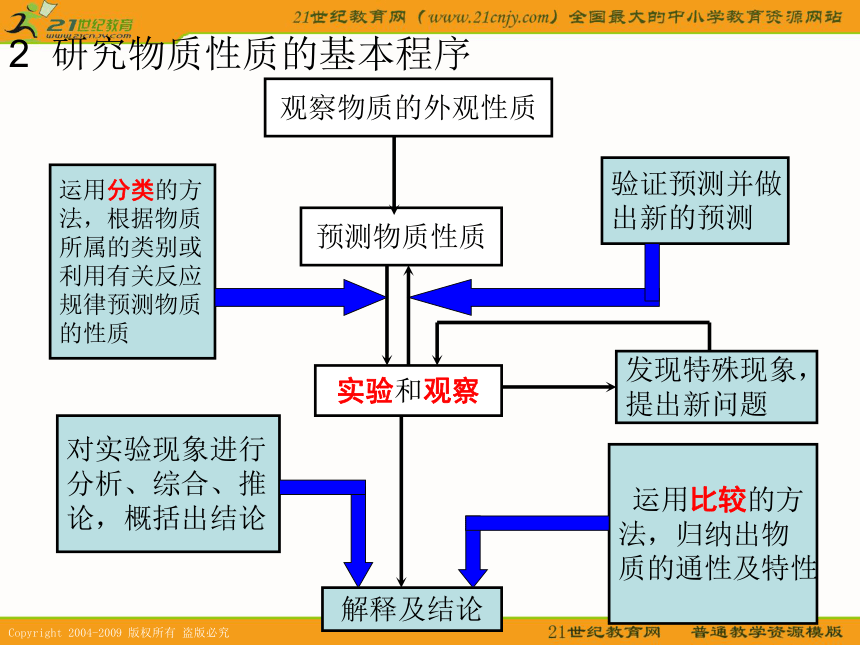
现代化学研究物质性质的方法和程序1 研究物质性质的基本方法观察法实验法分类法比较法2 研究物质性质的基本程序观察物质的外观性质预测物质性质实验和观察解释及结论发现特殊现象,
提出新问题钠的化学反应规律(1)化合反应
2Na+S==Na2S 2Na+Cl2==2NaCl
2Na+O2==Na2O2 4Na+O2==2Na2O
(2)置换反应
①置换出水中的氢,生成氢气和氢氧化钠。
2Na+H2O==2NaOH+H2↑
②将钠加入到碱或水溶液中,发生的反应首先是钠与水反应,然后再看是否有氢氧化钠的再反应,或溶液的组成是否受溶剂减少、温度升高等的影响。
如将钠加入到硫酸铜溶液中,首先发生的反应是钠与水的反应,再是生成的氢氧化钠与硫酸铜反应。
③置换酸中的氢,生成氢气和盐。
④置换某些熔融盐中的金属生成金属单质和盐。
如4Na+TiCl4==Ti+4NaCl
氯气的性质物理性质
黄绿色气体,刺激性气味,有毒,密度大与空气密度,易溶于水(久置氯水与新制氯水的区别)。
化学性质
跟金属反应(变价金属,生成高价)
跟氢气、磷等非金属反应
跟水反应(次氯酸HClO,具有漂白性)
跟碱反应四个概念的解析化学中常用的物理量—物质的量物质的质量(g)气体的体积
(标况)(L)物质的量(mol)气体物质
的分子数物质的
微粒数溶质的
质量( g )溶质的
微粒数物质的量浓度(mol/L)溶质的质量分数溶质的物质的量
(mol)摩尔质量(g/mol)摩尔质量(g/mol)NANANA溶液体积(L)摩尔体积(L/mol)气体密度(g/L)溶质的摩尔质量、密度一定体积溶液的配制(1)常用主要的仪器
(2)主要操作
(3)误差分析主要操作1 计算
2 量取
3 溶解和冷却
4 转移
5 洗涤
6 旋摇
7 定容
8 摇匀
9 装瓶
1 计算过程要精确
2 固体药品要称取
液体药品要量取
3 溶解之后要冷却
4 转移用玻璃棒,放在容量瓶刻度线下
5 洗涤2~3次,洗涤液也要注入容量瓶中
6 旋摇,晃动底部,是初步的混匀
7 定容要平视,最后用胶头滴灌加至刻度线
8 摇匀要上下反复
9 容量瓶中的溶液要及时转移误差分析1 浓度误差
常见造成浓度偏高的有:
①定容时俯视刻度线;
②量取液体溶质时仰视刻度线;
③将洗涤量筒的洗涤液转入容量瓶中;
④溶质溶解后未冷却就转入容量瓶中。
2 体积误差
常见造成浓度偏低的有:
①定容时仰视刻度线;
②量取液体溶质时仰视刻度线;
③转移时未洗涤烧杯或未将洗涤液转入容量瓶中;
④固体溶质已吸水;
⑤定容振荡摇匀后发现液面低于刻度线又加水至刻度线溶液等体积混合规律当浓度越大其密度越大的同溶质水溶液等体积相混合(密度>1g/mL),所得混合后溶液溶质的质量分数大于混合前两溶液溶质质量分数的平均值。如H2SO4、 NaCl NaOH等溶液。当浓度越大其密度越小的同溶质水溶液等体积相混合(密度<1g/mL),所得混合后溶液溶质的质量分数小于混合前两溶液溶质质量分数的平均值。如CH3CH2OH 、 NH3等溶液。
1 化学是创造性的、实用的科学
2 化学科学的形成发展
3 化学科学的探索空间化学的定义 化学就是在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。
化学的特征就是认识分子和制造分子,它是一门具有创造性的、实用的科学。化学科学的形成发展古代化学
近代化学
近代化学的发展里程碑
(1)1661年,英国化学家、物理学家波义耳提出化学元素的概念,标志着近代化学的诞生。
(2)1771年,法国化学家拉瓦锡建立燃烧现象的氧化学说,使近代化学取得了革命性的进步。
(3)1803年,英国物理学家、化学家道尔顿提出原子学说,为近代化学的发展奠定了坚实的基础。
(4)1869年,俄国化学家门捷列夫发现元素周期律,把化学元素及其化合物纳入一个统一的理论体系。
现代化学研究物质性质的方法和程序1 研究物质性质的基本方法观察法实验法分类法比较法2 研究物质性质的基本程序观察物质的外观性质预测物质性质实验和观察解释及结论发现特殊现象,
提出新问题钠的化学反应规律(1)化合反应
2Na+S==Na2S 2Na+Cl2==2NaCl
2Na+O2==Na2O2 4Na+O2==2Na2O
(2)置换反应
①置换出水中的氢,生成氢气和氢氧化钠。
2Na+H2O==2NaOH+H2↑
②将钠加入到碱或水溶液中,发生的反应首先是钠与水反应,然后再看是否有氢氧化钠的再反应,或溶液的组成是否受溶剂减少、温度升高等的影响。
如将钠加入到硫酸铜溶液中,首先发生的反应是钠与水的反应,再是生成的氢氧化钠与硫酸铜反应。
③置换酸中的氢,生成氢气和盐。
④置换某些熔融盐中的金属生成金属单质和盐。
如4Na+TiCl4==Ti+4NaCl
氯气的性质物理性质
黄绿色气体,刺激性气味,有毒,密度大与空气密度,易溶于水(久置氯水与新制氯水的区别)。
化学性质
跟金属反应(变价金属,生成高价)
跟氢气、磷等非金属反应
跟水反应(次氯酸HClO,具有漂白性)
跟碱反应四个概念的解析化学中常用的物理量—物质的量物质的质量(g)气体的体积
(标况)(L)物质的量(mol)气体物质
的分子数物质的
微粒数溶质的
质量( g )溶质的
微粒数物质的量浓度(mol/L)溶质的质量分数溶质的物质的量
(mol)摩尔质量(g/mol)摩尔质量(g/mol)NANANA溶液体积(L)摩尔体积(L/mol)气体密度(g/L)溶质的摩尔质量、密度一定体积溶液的配制(1)常用主要的仪器
(2)主要操作
(3)误差分析主要操作1 计算
2 量取
3 溶解和冷却
4 转移
5 洗涤
6 旋摇
7 定容
8 摇匀
9 装瓶
1 计算过程要精确
2 固体药品要称取
液体药品要量取
3 溶解之后要冷却
4 转移用玻璃棒,放在容量瓶刻度线下
5 洗涤2~3次,洗涤液也要注入容量瓶中
6 旋摇,晃动底部,是初步的混匀
7 定容要平视,最后用胶头滴灌加至刻度线
8 摇匀要上下反复
9 容量瓶中的溶液要及时转移误差分析1 浓度误差
常见造成浓度偏高的有:
①定容时俯视刻度线;
②量取液体溶质时仰视刻度线;
③将洗涤量筒的洗涤液转入容量瓶中;
④溶质溶解后未冷却就转入容量瓶中。
2 体积误差
常见造成浓度偏低的有:
①定容时仰视刻度线;
②量取液体溶质时仰视刻度线;
③转移时未洗涤烧杯或未将洗涤液转入容量瓶中;
④固体溶质已吸水;
⑤定容振荡摇匀后发现液面低于刻度线又加水至刻度线溶液等体积混合规律当浓度越大其密度越大的同溶质水溶液等体积相混合(密度>1g/mL),所得混合后溶液溶质的质量分数大于混合前两溶液溶质质量分数的平均值。如H2SO4、 NaCl NaOH等溶液。当浓度越大其密度越小的同溶质水溶液等体积相混合(密度<1g/mL),所得混合后溶液溶质的质量分数小于混合前两溶液溶质质量分数的平均值。如CH3CH2OH 、 NH3等溶液。
