化学:1.1.2《混合物的分离和提纯》课件(新人教版必修1)
文档属性
| 名称 | 化学:1.1.2《混合物的分离和提纯》课件(新人教版必修1) |  | |
| 格式 | rar | ||
| 文件大小 | 179.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-12-07 19:36:00 | ||
图片预览





文档简介
课件13张PPT。第一单元 化学实验基本方法我们从实验推开高中化学的大门(1)分离和提纯有什么不同? 分离:是通过适当的方法,把混合物中的几种物质分开,分别得到纯净的物质.
提纯:是通过适当的方法把混合物中的杂质除去,以得到纯净物质.(2)分离和提纯常用的方法有:
物理方法:过滤、蒸发、蒸馏、萃取
化学方法: 请思考书本P5第二个思考与交流,你还能举出几种生活中混合物分离和提纯的例子吗?它们是怎么分开的? 二、基本实验操作方法 —— 混合物的分离和提纯一、请回忆粗盐提纯的方法粗盐成分:
NaCl[CaCl2、MgCl2、硫酸盐、不溶性杂质]
操作过程:
溶解——过滤——蒸发
(将不溶性杂质除去)(重新得到NaCl)
▲过滤操作要领:
一贴、二低、三靠
▲蒸发操作要领:
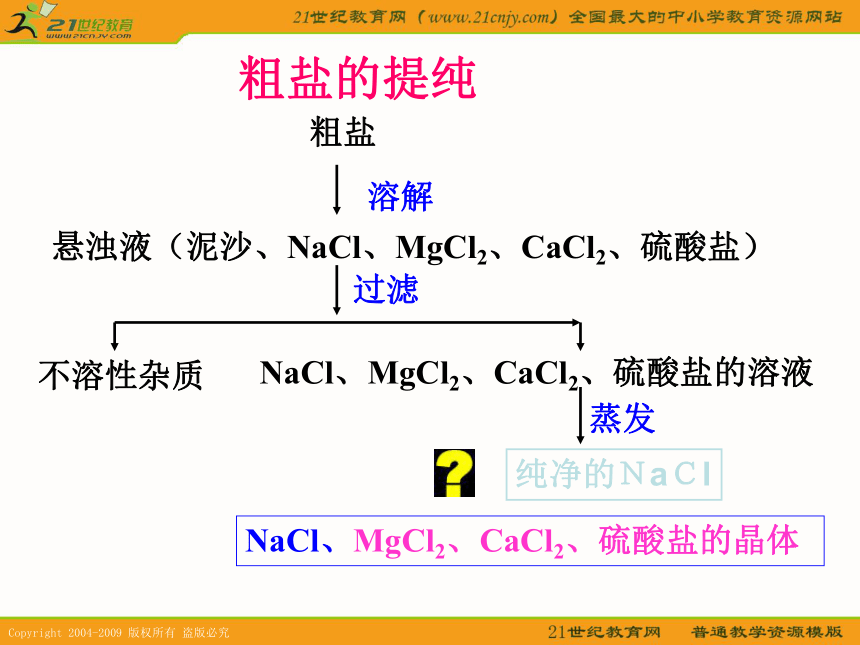
(1)玻璃棒要不停的搅拌,(2)防止局部沸腾;(3)出现较多固体时停止加热请动手填写书本P6的表格,注意文字表达粗盐的提纯粗盐溶解悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)过滤不溶性杂质NaCl、MgCl2、CaCl2、硫酸盐的溶液蒸发NaCl、MgCl2、CaCl2、硫酸盐的晶体纯净的NaCl二、如何检验NaCl中的SO42- 检验物时应取少量待测液的样品,不要
直接在待测液中检验. ▲SO42-的检验方法:先加入稀HNO3或稀HCl酸化,再加入可溶性钡盐溶液,如果出现不溶于稀酸的白色沉淀,则存在硫酸根离子。 注意排除CO32-等离子的干扰,酸和钡盐的选择应该视具体情况而定,不能一成不变表述时应说明:
选用什么试剂+出现什么现象+得出什么结论三、如何除去NaCl的杂质要除去可溶杂质离子是:Ca2+ Mg2+ SO42- 选择要加入的除杂试剂:为了能完全除去杂质离子,加入的除杂试剂必须过量引入了新的离子: CO3 2- OH - Ba 2+如何除去新引入的杂质?请思考书本P7第二个问题用哪些试剂来Ca2+ 、Mg2+、 SO42-、除去等离子。请思考书本P7第一个问题加入试剂顺序1.BaCl2→NaOH →Na2CO3 →HCl
2. BaCl2→ Na2CO3 → NaOH →HCl
3. NaOH →BaCl2→ Na2CO3 →HCl 加入除杂试剂的顺序可以是:1、只要Na2CO3加在BaCl2之后便合理
2、最后加入的盐酸只能适量一、物质的分离与提纯:
分离:是通过适当的方法,把混合物中的几种物质分开,分别得到纯净的物质.
提纯:是通过适当的方法把混合物中的杂质除去,以得到纯净物质
二、化学实验基本操作:
(1)溶解:(2)过滤 (3)蒸发 (4)结晶:课堂小结:三、提纯物质(除杂)的基本思路
(1)确定物质的组成,即含有哪些杂质
(2)选择最适当的方法进行提纯[物理还是化学方法(把杂质转化成沉淀、气体或是水)
(3)选择适当的除杂试剂,尽量不引入新杂质;否则要求生成新杂质后要易于再次除去
(4)充分考虑除杂过程中各种试剂的用量,以在最终不引入新杂质为原则
课堂练习1、分离下列混合物,按溶解、过滤、蒸发顺序进行的是( )
A、氧化铜、木炭 B、碳酸钙、氯化钠
C、硝酸钾、氯化钠 D、乙醇、水B2、实验室里用氯酸钾和二氧化锰制取氧气,请问
如何把反应后剩下的物质分离开?先溶解,然后过滤,最后蒸发D3、为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,然后先后加入KOH、K2CO3 、Ba(NO3)2 等试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序正确的是( )
A、K2CO3—Ba(NO3)2—KOH—HNO3
B、Ba(NO3)2—KOH—HNO3—K2CO3
C、KOH—K2CO3—Ba(NO3)2—HNO3
D、Ba(NO3)2—KOH—K2CO3—HNO3
4、提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法( )
A、加入过量碳酸钠溶液,过滤,再加适量硝酸
B、加入过量硫酸钾溶液,过滤,再加适量硝酸
C、加入过量硫酸钠溶液,过滤,再加适量硝酸
D、加入过量碳酸钾溶液,过滤,再加适量硝酸D
提纯:是通过适当的方法把混合物中的杂质除去,以得到纯净物质.(2)分离和提纯常用的方法有:
物理方法:过滤、蒸发、蒸馏、萃取
化学方法: 请思考书本P5第二个思考与交流,你还能举出几种生活中混合物分离和提纯的例子吗?它们是怎么分开的? 二、基本实验操作方法 —— 混合物的分离和提纯一、请回忆粗盐提纯的方法粗盐成分:
NaCl[CaCl2、MgCl2、硫酸盐、不溶性杂质]
操作过程:
溶解——过滤——蒸发
(将不溶性杂质除去)(重新得到NaCl)
▲过滤操作要领:
一贴、二低、三靠
▲蒸发操作要领:
(1)玻璃棒要不停的搅拌,(2)防止局部沸腾;(3)出现较多固体时停止加热请动手填写书本P6的表格,注意文字表达粗盐的提纯粗盐溶解悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)过滤不溶性杂质NaCl、MgCl2、CaCl2、硫酸盐的溶液蒸发NaCl、MgCl2、CaCl2、硫酸盐的晶体纯净的NaCl二、如何检验NaCl中的SO42- 检验物时应取少量待测液的样品,不要
直接在待测液中检验. ▲SO42-的检验方法:先加入稀HNO3或稀HCl酸化,再加入可溶性钡盐溶液,如果出现不溶于稀酸的白色沉淀,则存在硫酸根离子。 注意排除CO32-等离子的干扰,酸和钡盐的选择应该视具体情况而定,不能一成不变表述时应说明:
选用什么试剂+出现什么现象+得出什么结论三、如何除去NaCl的杂质要除去可溶杂质离子是:Ca2+ Mg2+ SO42- 选择要加入的除杂试剂:为了能完全除去杂质离子,加入的除杂试剂必须过量引入了新的离子: CO3 2- OH - Ba 2+如何除去新引入的杂质?请思考书本P7第二个问题用哪些试剂来Ca2+ 、Mg2+、 SO42-、除去等离子。请思考书本P7第一个问题加入试剂顺序1.BaCl2→NaOH →Na2CO3 →HCl
2. BaCl2→ Na2CO3 → NaOH →HCl
3. NaOH →BaCl2→ Na2CO3 →HCl 加入除杂试剂的顺序可以是:1、只要Na2CO3加在BaCl2之后便合理
2、最后加入的盐酸只能适量一、物质的分离与提纯:
分离:是通过适当的方法,把混合物中的几种物质分开,分别得到纯净的物质.
提纯:是通过适当的方法把混合物中的杂质除去,以得到纯净物质
二、化学实验基本操作:
(1)溶解:(2)过滤 (3)蒸发 (4)结晶:课堂小结:三、提纯物质(除杂)的基本思路
(1)确定物质的组成,即含有哪些杂质
(2)选择最适当的方法进行提纯[物理还是化学方法(把杂质转化成沉淀、气体或是水)
(3)选择适当的除杂试剂,尽量不引入新杂质;否则要求生成新杂质后要易于再次除去
(4)充分考虑除杂过程中各种试剂的用量,以在最终不引入新杂质为原则
课堂练习1、分离下列混合物,按溶解、过滤、蒸发顺序进行的是( )
A、氧化铜、木炭 B、碳酸钙、氯化钠
C、硝酸钾、氯化钠 D、乙醇、水B2、实验室里用氯酸钾和二氧化锰制取氧气,请问
如何把反应后剩下的物质分离开?先溶解,然后过滤,最后蒸发D3、为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,然后先后加入KOH、K2CO3 、Ba(NO3)2 等试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序正确的是( )
A、K2CO3—Ba(NO3)2—KOH—HNO3
B、Ba(NO3)2—KOH—HNO3—K2CO3
C、KOH—K2CO3—Ba(NO3)2—HNO3
D、Ba(NO3)2—KOH—K2CO3—HNO3
4、提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法( )
A、加入过量碳酸钠溶液,过滤,再加适量硝酸
B、加入过量硫酸钾溶液,过滤,再加适量硝酸
C、加入过量硫酸钠溶液,过滤,再加适量硝酸
D、加入过量碳酸钾溶液,过滤,再加适量硝酸D
