硝酸的性质
图片预览





文档简介
课件17张PPT。硝 酸纯硝酸
颜色:
气味:
状态:
密度:
溶解性:
挥发性:让我
好好想想
???无色
有刺激性气味
液体
密度比水大溶于水放热
可溶于水
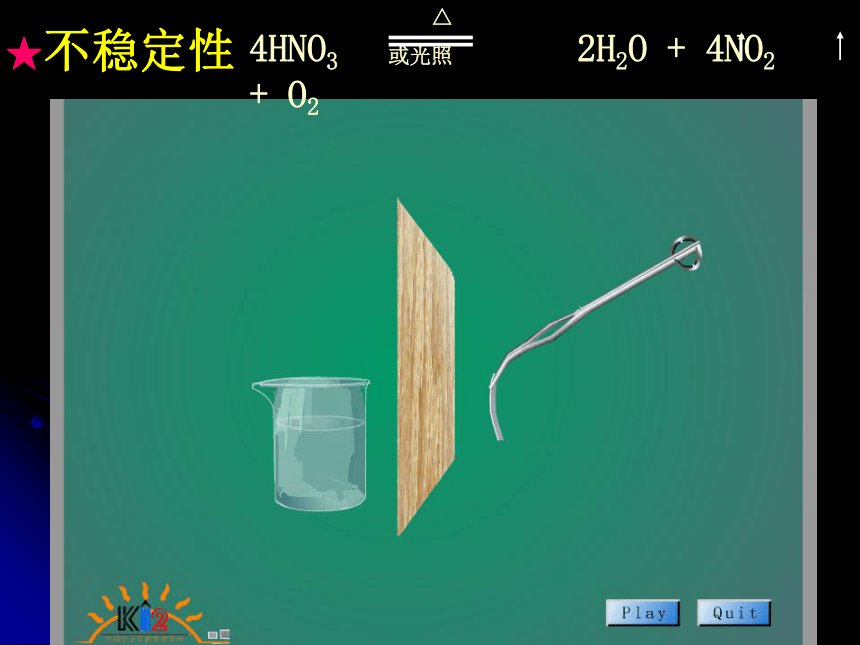
易挥发硝酸的物理性质类似盐酸参考:是雾,因硝酸具有挥发性,挥发出来的硝酸与空气中的水蒸气形成硝酸小液滴。硝酸的化学性质 ★强酸性 ★不稳定性 ★强氧化性 ★强酸性(HNO3 = H+ + NO3-具有酸的通性)1、使指示剂变色:2、与活泼金属反应放出氢气:3、与碱发生中和反应:4、与碱性氧化物反应:稀硝酸使紫色石蕊试液变红,加热不褪色.HNO3+ NaOH = NaNO3 + H2O2HNO3+ CuO = Cu(NO3)2 + H2O5、与某些盐反应:?★不稳定性 ★强氧化性㈠ 现象:
铜与浓硝酸反应激烈,产生红棕色气体,溶液由无色变为绿色。
铜与稀硝酸反应较缓慢,产生无色气体,逸至试管口变为红棕色, 溶液由无色变为蓝色。Cu+4HNO3(浓) = Cu(NO3)2+2NO2 ↑+2H2O3Cu+8HNO3(稀) =3Cu(NO3)2+2NO ↑+4H2O结论:硝酸具有强的氧化性,几乎可以使所有金属(金、铂 除外)氧化而生成硝酸盐。浓硝酸和铜.swf浓稀注
意⑵常温下,浓硝酸使铁、铝等金属钝化⑶ 氧化性:浓硝酸>稀硝酸⑷ 一般情况下:浓硝酸被还原为NO2 稀硝酸被还原为NO启迪思考:如何书写浓硝酸与银反应的化学方程式?⑴ 硝酸与金属反应不放出氢气⑸浓硝酸使石蕊试液变红,加热褪色小知识 3体积浓盐酸与1体积浓硝酸的混合物叫做王水,它的氧化能力更强,金(Au )和 铂(Pt )不溶于硝酸,但溶于王水。帮
你
记
忆(3:1) ★强氧化性㈡ 硝酸具有强的氧化性,能使许多非金属(如碳、硫、磷),某些有机物(如松节油,锯末等)及还原剂 (如H2S、HI、HBr、 SO2、 Na2SO3等)氧化。启迪思考:硫与浓硝酸反应为什么不
生成二氧化硫或亚硫酸?硝酸能把二氧化硫或亚硫酸继续氧化。知 识 总 结 物理性质:色、味、态、溶解度和挥发性 ★化学性质:不稳定性
强酸性
强氧化性用途:是重要的化工原料;在实验室是重要的化学试剂随堂测试1.硝酸应如何贮存? 2.解释为什么实验室制H2可用稀
盐酸或稀硫酸,而不能用稀的硝酸? 答:应放于棕色瓶中,储存于阴暗处. 答:因为硝酸不论浓稀都具有强氧化性。
用金属与硝酸反应时,H+不能得到电子,
只能是HNO3中的N得到电子,故不能得到
氢气! 3.填空酸的通性不稳定性强氧化性稀硝酸使紫色石蕊试液变红热的浓硝酸使红热的碳燃烧久置的浓硝
酸呈黄色事实化学方程式 性质 5.下列关于硝酸正确的是( )
A.稀硝酸能与Fe反应,而浓硝酸不能
B.浓硝酸和稀硝酸都是强氧化剂
C.稀硝酸是弱酸,浓硝酸是强酸
D. 稀硝酸与Cu反应,生成NO2,而浓硝
酸与Cu反应只生成NO,稀硝酸得电子
更多,故稀硝酸氧化性大于浓硝酸4.常温下能用铝制容器盛放的是( )
A.浓盐酸 B.浓硝酸
C.浓硫酸 D.稀硝酸BCB足量的Cu中加入少量的浓硝酸,可能会
发生什么反应? 反应停止后,如果在溶液中再加入足量盐酸,会出现什么情况?溶液中存在NO3-,它遇到H+后,会继续
氧化铜,当然此时NO3- /H+的溶度较稀.思考题思考题1、工业上拟用Cu与适量的硝酸来制
备Cu(NO3)2 ,下面是三位同学提出的
三个方案:甲: 铜浓硝酸乙: 铜稀硝酸丙: 铜空气△硝酸请问:那一种方案最好?为什么?Cu(NO3)2Cu(NO3)2Cu(NO3)2CuO再见化学必修①复习完成
颜色:
气味:
状态:
密度:
溶解性:
挥发性:让我
好好想想
???无色
有刺激性气味
液体
密度比水大溶于水放热
可溶于水
易挥发硝酸的物理性质类似盐酸参考:是雾,因硝酸具有挥发性,挥发出来的硝酸与空气中的水蒸气形成硝酸小液滴。硝酸的化学性质 ★强酸性 ★不稳定性 ★强氧化性 ★强酸性(HNO3 = H+ + NO3-具有酸的通性)1、使指示剂变色:2、与活泼金属反应放出氢气:3、与碱发生中和反应:4、与碱性氧化物反应:稀硝酸使紫色石蕊试液变红,加热不褪色.HNO3+ NaOH = NaNO3 + H2O2HNO3+ CuO = Cu(NO3)2 + H2O5、与某些盐反应:?★不稳定性 ★强氧化性㈠ 现象:
铜与浓硝酸反应激烈,产生红棕色气体,溶液由无色变为绿色。
铜与稀硝酸反应较缓慢,产生无色气体,逸至试管口变为红棕色, 溶液由无色变为蓝色。Cu+4HNO3(浓) = Cu(NO3)2+2NO2 ↑+2H2O3Cu+8HNO3(稀) =3Cu(NO3)2+2NO ↑+4H2O结论:硝酸具有强的氧化性,几乎可以使所有金属(金、铂 除外)氧化而生成硝酸盐。浓硝酸和铜.swf浓稀注
意⑵常温下,浓硝酸使铁、铝等金属钝化⑶ 氧化性:浓硝酸>稀硝酸⑷ 一般情况下:浓硝酸被还原为NO2 稀硝酸被还原为NO启迪思考:如何书写浓硝酸与银反应的化学方程式?⑴ 硝酸与金属反应不放出氢气⑸浓硝酸使石蕊试液变红,加热褪色小知识 3体积浓盐酸与1体积浓硝酸的混合物叫做王水,它的氧化能力更强,金(Au )和 铂(Pt )不溶于硝酸,但溶于王水。帮
你
记
忆(3:1) ★强氧化性㈡ 硝酸具有强的氧化性,能使许多非金属(如碳、硫、磷),某些有机物(如松节油,锯末等)及还原剂 (如H2S、HI、HBr、 SO2、 Na2SO3等)氧化。启迪思考:硫与浓硝酸反应为什么不
生成二氧化硫或亚硫酸?硝酸能把二氧化硫或亚硫酸继续氧化。知 识 总 结 物理性质:色、味、态、溶解度和挥发性 ★化学性质:不稳定性
强酸性
强氧化性用途:是重要的化工原料;在实验室是重要的化学试剂随堂测试1.硝酸应如何贮存? 2.解释为什么实验室制H2可用稀
盐酸或稀硫酸,而不能用稀的硝酸? 答:应放于棕色瓶中,储存于阴暗处. 答:因为硝酸不论浓稀都具有强氧化性。
用金属与硝酸反应时,H+不能得到电子,
只能是HNO3中的N得到电子,故不能得到
氢气! 3.填空酸的通性不稳定性强氧化性稀硝酸使紫色石蕊试液变红热的浓硝酸使红热的碳燃烧久置的浓硝
酸呈黄色事实化学方程式 性质 5.下列关于硝酸正确的是( )
A.稀硝酸能与Fe反应,而浓硝酸不能
B.浓硝酸和稀硝酸都是强氧化剂
C.稀硝酸是弱酸,浓硝酸是强酸
D. 稀硝酸与Cu反应,生成NO2,而浓硝
酸与Cu反应只生成NO,稀硝酸得电子
更多,故稀硝酸氧化性大于浓硝酸4.常温下能用铝制容器盛放的是( )
A.浓盐酸 B.浓硝酸
C.浓硫酸 D.稀硝酸BCB足量的Cu中加入少量的浓硝酸,可能会
发生什么反应? 反应停止后,如果在溶液中再加入足量盐酸,会出现什么情况?溶液中存在NO3-,它遇到H+后,会继续
氧化铜,当然此时NO3- /H+的溶度较稀.思考题思考题1、工业上拟用Cu与适量的硝酸来制
备Cu(NO3)2 ,下面是三位同学提出的
三个方案:甲: 铜浓硝酸乙: 铜稀硝酸丙: 铜空气△硝酸请问:那一种方案最好?为什么?Cu(NO3)2Cu(NO3)2Cu(NO3)2CuO再见化学必修①复习完成
