离子反应复习
图片预览








文档简介
课件27张PPT。离子反应问题教学目标1、 理解离子反应概念和认识反应条件的
2 、熟练离子反应方程式的书写,
3、 掌握基本的离子共存问题
4、 学会对一般的离子方程式做出正误判断本部分高考考点:1、基本概念的应用
2、离子共存与离子方程式正误的判断通过巩固离子反应一、几组概念1、电解质:在水溶液里或熔融状态下能导电的化合物。例如:HCl、NaOH、K2SO4。4、弱电解质:在水溶液里部分电离成离子的电解质。如:醋酸、氨水
2、非电解质:无论是在水溶液与熔融状态下都不导电的化合物。例如:蔗糖、酒精。3、强电解质:在水溶液里全部电离成离子的电解质。如:NaCl、HCl注意事项:
1、电解质、非电解质应是化合物;
2、电解质导电须有外界条件:水溶液或熔化状态;
3、电解质应是一定条件下本身电离而导电的化合物;CO2、SO2、SO3、NH3属于非电解质。
4、电解质的强弱由物质的内部结构决定,与其溶解性无关,某些难溶于水的化合物。如BaSO4、AgCl。由于他们溶解度太小,测不出(难测)其水溶液的导电性,但他们溶解的部分是完全电离的,所以是电解质。练习:1、下列物质中,
属于电解质的是 ,
属于非电解质的是 :
A 二氧化硫 B 氨气 C 铜 D 硫酸钡晶体 E 无水硫酸 F 氯化氢气体 G 饱和食盐水 H 蔗糖 I 酒精水溶液 J 熔融的氯化钠D E F JA B H 2、下列物质中属于强电解质的是?
属于弱电解质的是?
水溶液能导电但属于非电解质的是? A.氯化钠 B硫酸 C醋酸 D水银 E酒精 F蔗糖 G氨气 H三氧化硫 I 铜
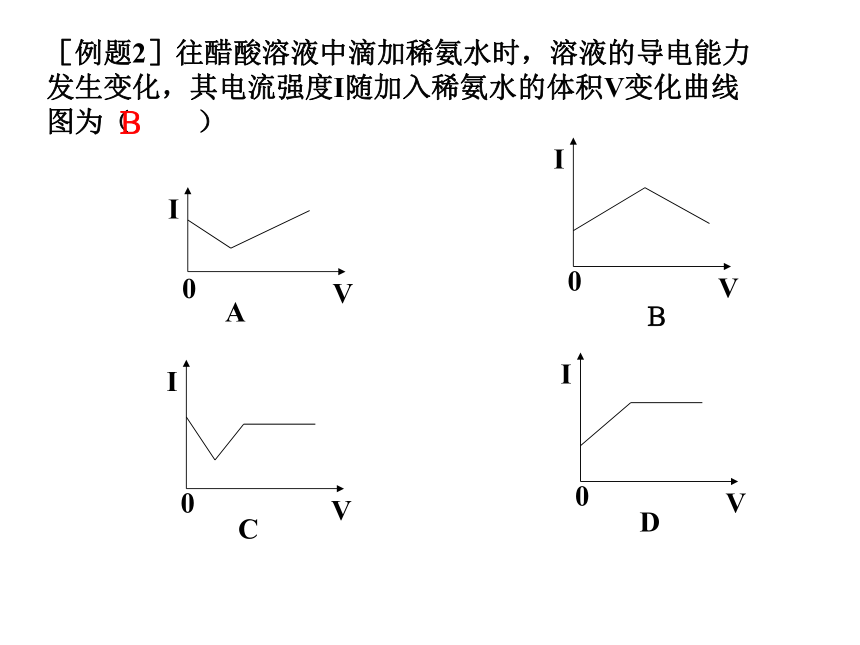
J 硫酸钡 K 硝酸钠溶液A B JCG H溶液的导电相关问题:(1)溶液的导电能力决定于溶液中离子的总浓度和所带的电荷数,而与溶液中离子总数没直接关系。(2)溶液的导电能力与电解质强弱没直接关系,导电性强的溶液不一定是强电解质溶液;强电解质溶液的导电能力不一定强于弱电解质。例 1、同浓度的下列溶液导电性最强的是A 氯化钠溶液 B 醋酸溶液 C 氨水 D 硫酸镁溶液D[例题2]往醋酸溶液中滴加稀氨水时,溶液的导电能力发生变化,其电流强度I随加入稀氨水的体积V变化曲线图为( )B二 、电离方程式电解质的电离可用电离方程式表示 强电解质的电离:
NaHCO3=Na++HCO3-
NaHSO4=Na++H++SO42-
弱电解质的电离:
CH3COOH CH3COO- + H+
NH3?H2O NH4+ + OH-离子方程式的定义:用实际参加反应的离子的符号来表示离子反应的式子叫离子方程式。1、离子方程式的书写方法:1、写:写出正确的化学方程式;
2、拆:把易溶于水易电离的物质拆写成离子形式
3、删:将不参加反应的离子从方程式两端删除;
三 、离子反应:有离子参加的反应称为离子反应写出下列物质间反应的离子方程式1、把氢氧化镁放投入硫酸中:Mg(OH) 2+2H+=Mg2++2H2O5.氢氧化钡溶液跟硫酸反应: 2I-+Br2=I2+2Br-Ba2 ++2OH-+2H+ + SO42-
= BaSO4 ↓ +2H2O4.碘化钾溶液跟适量溴水反应:3.二氧化碳通入碳酸钠溶液中: CO2+CO32-+H2O=2HCO3-2、小苏打溶液跟烧碱溶液反应: HCO3-+OH- =CO32-+H2O6、碳酸钡溶于盐酸:
BaCO3+2H+= Ba2++H2O+CO2↑2、判断离子方程式正误的主要依据原则1、尊重事实:物质反应必须符合的客观事实。
2、拆写准确 : 拆的是可溶性的强电解质
3、两个守衡 :必须遵从质量守恒和电荷守恒的原则练习 .离子方程式的正误判断1、下列离子方程式中正确的是(??? )
(上海高考试题)
A.铁跟稀硫酸反应:2Fe+6H+==2Fe3++3H2↑
B.碳酸氢钙溶液跟盐酸反应:
Ca(HCO3)2+2H+ ==Ca2++2H2O+2CO2↑
C.醋酸跟氢氧化钾溶液反应:
CH3COOH+OH- == CH3COO-+H2O
D.铁粉可以溶解在氯化铁溶液中Fe +Fe3+ ==2Fe2+
C2.下列反应的离子方程式正确的是(??? )
铁丝在氯气中燃烧:
2Fe+3Cl2 == 2Fe3++6Cl-
B.饱和石灰水跟稀硝酸反应:
Ca(OH)2+2H+=Ca2++2H2O
C.向稀氨水中加入稀盐酸:
NH3·H2O+H+=NH4++H2O
D.碳酸钙溶于醋酸中:
CaCO3+2H+=Ca2++H2O+CO2↑
C3.下列离子方程式不正确的是A.氨气通入稀硫酸溶液中 NH3+H+====NH4+B.二氧化碳通入碳酸钠溶液中CO2+CO32- +H2O====2HCO3-.氯气通入氢氧化钠溶液中
2Cl2+2OH-====3Cl-+ClO-+H2O C.在硫酸铜溶液中加入过量氢氧化钡溶液
Ba2++SO42- ====BaSO4↓C D(1)条件:①复分解反应的条件,即反应中有难溶的物质或难电离的物质或挥发性的物质生成。②氧化还原反应:两强相遇必反应 …….三、离子共存:(2)离子反应的类型:
离子间发生复分解反应
离子间发生氧化还原反应
……..(不是完全不能共存,而是不能大量共存)1、下列各组离子,在强碱性溶液中可以大量共存的是(??? )
A.Cu2+、Cl-、NO3-、Na+
B.Na+、K+、NH4+、Ba2+
C.Br-、S2-、Cl-、CO32-?????????????????????????????
D.SO32-、NO3-、SO42-、HCO3-
c练习2、下列各组离子能在PH=1的无色溶液中大量共存的是
(A)Ba2+、Na+、I- 、ClO-
(B)Mg2+、Cl- 、Al3+、SO42-
(C)K+、Cl-、HCO3-、NO3-
(D)Ca2+、Na+、Fe3+、 SO42- BA各为K2CO3、K2SO4、H2SO4、Ba(NO3)2中的一种,分别取少量样品进行下列实验,现象为:
在A中加C,无明显变化;
在A中加D,无明显变化;
在B中加D,生成沉淀E,并得到一种溶液;
在B中加C,生成沉淀并得到溶液F;
将少量E加入到过量F中,有气体放出.
(1)写化学式,B是??????????? ___,C是??????????? ___.
(2)如果将A和B混合,有关反应的离子方程式为??????????????????????? _________,将E加入过量F中,有关离子方程式??????????????????????? __________.
离子反应推断题有A、B、C、D四种溶液,它们Ba(NO3)2H2SO4 SO42-+Ba2+ == BaSO4_BaCO3+2H+==Ba2++H2O+O2↑写出与下列每一离子方程式对应2个化学反应方程式
(1) HCO3-+H+=CO2+H2O
(2)H++OH- =H2O
(3)Mg+2 H+ =Mg2++H2↑
(4)BaCO3+2H+=Ba2++H2O +CO2 ↑离子方程式的意义:不仅可以表示一个反应,而且可以表示所有同一类型的离子反应作业: 通过自己书写 判断 下列物质间反应的离子方程式是否正确11.醋酸与氨水溶液混合: CH3COOH + NH3·H2O =CH3COONH4 + H2O
2.铜片插入硝酸银溶液: Cu + Ag+ = Cu2+ + Ag
3.碳酸钙加入醋酸溶液中: CO32- + 2CH3COOH = CO2↑+ 2CH3COO-+H2O4.氯气跟水反应:
Cl2 + H2O = 2H+ + Cl- + ClO -
5.钠跟水反应:
Na + 2H2O = Na+ + 2OH - + H2↑
6.硫酸铜溶液跟氢氧化钡溶液反应:
Ba2+ + SO42- = BaSO4↓下列物质间反应的离子方程式是否正确27. 在碳酸氢钠溶液中加入盐酸
HCO3-+H+=CO2↑+H2O
8.把金属铁放入稀硫酸中:
2Fe+6H+=2Fe3++3H2↑9.碳酸氢钙溶液跟盐酸反应:
Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
10.碘化钾溶液跟适量溴水反应:
2I-+Br2=I2+2Br-
11.氢氧化钡溶液跟盐酸反应:
OH-+H+=H2O下列物质间反应的离子方程式是否正确312.小苏打溶液跟烧碱溶液反应:
HCO3-+OH-=CO32-+H2O
13.氨气通入稀硫酸溶液中:
NH3+H+=NH4+
14.二氧化碳通入碳酸钠溶液中:
CO2+CO32-+H2O=2HCO3-
15.氯气通入冷的氢氧化钠溶液中:
2Cl2+2OH-=3Cl-+ClO-+H2O下列物质间反应的离子方程式是否正确416.氨气通入醋酸溶液中:
CH3COOH+NH3=CH3COONH4
17.澄清的石灰水跟盐酸反应:
H++OH-=H2O
18碳酸钡溶于醋酸:
BaCO3+2H+=Ba2++H2O+CO2↑
19.次氯酸钙溶液中通入过量二氧化碳:
Ca2++2ClO-+H2O+CO2= CaCO3↓+2HClO 例题3、在一个烧杯中盛放一种液体a,向其中逐滴加入(或通入)另一物质b,在此过程中烧杯中液体的导电能力如何变化? a bA 水 NaOH溶液
B 醋酸溶液 NaOH溶液
C 冰醋酸 水
D Ba(OH)2溶液 稀硫酸
E 澄清的石灰水 二氧化碳气体
F 氨水 醋酸溶液祝大家学习愉快
2 、熟练离子反应方程式的书写,
3、 掌握基本的离子共存问题
4、 学会对一般的离子方程式做出正误判断本部分高考考点:1、基本概念的应用
2、离子共存与离子方程式正误的判断通过巩固离子反应一、几组概念1、电解质:在水溶液里或熔融状态下能导电的化合物。例如:HCl、NaOH、K2SO4。4、弱电解质:在水溶液里部分电离成离子的电解质。如:醋酸、氨水
2、非电解质:无论是在水溶液与熔融状态下都不导电的化合物。例如:蔗糖、酒精。3、强电解质:在水溶液里全部电离成离子的电解质。如:NaCl、HCl注意事项:
1、电解质、非电解质应是化合物;
2、电解质导电须有外界条件:水溶液或熔化状态;
3、电解质应是一定条件下本身电离而导电的化合物;CO2、SO2、SO3、NH3属于非电解质。
4、电解质的强弱由物质的内部结构决定,与其溶解性无关,某些难溶于水的化合物。如BaSO4、AgCl。由于他们溶解度太小,测不出(难测)其水溶液的导电性,但他们溶解的部分是完全电离的,所以是电解质。练习:1、下列物质中,
属于电解质的是 ,
属于非电解质的是 :
A 二氧化硫 B 氨气 C 铜 D 硫酸钡晶体 E 无水硫酸 F 氯化氢气体 G 饱和食盐水 H 蔗糖 I 酒精水溶液 J 熔融的氯化钠D E F JA B H 2、下列物质中属于强电解质的是?
属于弱电解质的是?
水溶液能导电但属于非电解质的是? A.氯化钠 B硫酸 C醋酸 D水银 E酒精 F蔗糖 G氨气 H三氧化硫 I 铜
J 硫酸钡 K 硝酸钠溶液A B JCG H溶液的导电相关问题:(1)溶液的导电能力决定于溶液中离子的总浓度和所带的电荷数,而与溶液中离子总数没直接关系。(2)溶液的导电能力与电解质强弱没直接关系,导电性强的溶液不一定是强电解质溶液;强电解质溶液的导电能力不一定强于弱电解质。例 1、同浓度的下列溶液导电性最强的是A 氯化钠溶液 B 醋酸溶液 C 氨水 D 硫酸镁溶液D[例题2]往醋酸溶液中滴加稀氨水时,溶液的导电能力发生变化,其电流强度I随加入稀氨水的体积V变化曲线图为( )B二 、电离方程式电解质的电离可用电离方程式表示 强电解质的电离:
NaHCO3=Na++HCO3-
NaHSO4=Na++H++SO42-
弱电解质的电离:
CH3COOH CH3COO- + H+
NH3?H2O NH4+ + OH-离子方程式的定义:用实际参加反应的离子的符号来表示离子反应的式子叫离子方程式。1、离子方程式的书写方法:1、写:写出正确的化学方程式;
2、拆:把易溶于水易电离的物质拆写成离子形式
3、删:将不参加反应的离子从方程式两端删除;
三 、离子反应:有离子参加的反应称为离子反应写出下列物质间反应的离子方程式1、把氢氧化镁放投入硫酸中:Mg(OH) 2+2H+=Mg2++2H2O5.氢氧化钡溶液跟硫酸反应: 2I-+Br2=I2+2Br-Ba2 ++2OH-+2H+ + SO42-
= BaSO4 ↓ +2H2O4.碘化钾溶液跟适量溴水反应:3.二氧化碳通入碳酸钠溶液中: CO2+CO32-+H2O=2HCO3-2、小苏打溶液跟烧碱溶液反应: HCO3-+OH- =CO32-+H2O6、碳酸钡溶于盐酸:
BaCO3+2H+= Ba2++H2O+CO2↑2、判断离子方程式正误的主要依据原则1、尊重事实:物质反应必须符合的客观事实。
2、拆写准确 : 拆的是可溶性的强电解质
3、两个守衡 :必须遵从质量守恒和电荷守恒的原则练习 .离子方程式的正误判断1、下列离子方程式中正确的是(??? )
(上海高考试题)
A.铁跟稀硫酸反应:2Fe+6H+==2Fe3++3H2↑
B.碳酸氢钙溶液跟盐酸反应:
Ca(HCO3)2+2H+ ==Ca2++2H2O+2CO2↑
C.醋酸跟氢氧化钾溶液反应:
CH3COOH+OH- == CH3COO-+H2O
D.铁粉可以溶解在氯化铁溶液中Fe +Fe3+ ==2Fe2+
C2.下列反应的离子方程式正确的是(??? )
铁丝在氯气中燃烧:
2Fe+3Cl2 == 2Fe3++6Cl-
B.饱和石灰水跟稀硝酸反应:
Ca(OH)2+2H+=Ca2++2H2O
C.向稀氨水中加入稀盐酸:
NH3·H2O+H+=NH4++H2O
D.碳酸钙溶于醋酸中:
CaCO3+2H+=Ca2++H2O+CO2↑
C3.下列离子方程式不正确的是A.氨气通入稀硫酸溶液中 NH3+H+====NH4+B.二氧化碳通入碳酸钠溶液中CO2+CO32- +H2O====2HCO3-.氯气通入氢氧化钠溶液中
2Cl2+2OH-====3Cl-+ClO-+H2O C.在硫酸铜溶液中加入过量氢氧化钡溶液
Ba2++SO42- ====BaSO4↓C D(1)条件:①复分解反应的条件,即反应中有难溶的物质或难电离的物质或挥发性的物质生成。②氧化还原反应:两强相遇必反应 …….三、离子共存:(2)离子反应的类型:
离子间发生复分解反应
离子间发生氧化还原反应
……..(不是完全不能共存,而是不能大量共存)1、下列各组离子,在强碱性溶液中可以大量共存的是(??? )
A.Cu2+、Cl-、NO3-、Na+
B.Na+、K+、NH4+、Ba2+
C.Br-、S2-、Cl-、CO32-?????????????????????????????
D.SO32-、NO3-、SO42-、HCO3-
c练习2、下列各组离子能在PH=1的无色溶液中大量共存的是
(A)Ba2+、Na+、I- 、ClO-
(B)Mg2+、Cl- 、Al3+、SO42-
(C)K+、Cl-、HCO3-、NO3-
(D)Ca2+、Na+、Fe3+、 SO42- BA各为K2CO3、K2SO4、H2SO4、Ba(NO3)2中的一种,分别取少量样品进行下列实验,现象为:
在A中加C,无明显变化;
在A中加D,无明显变化;
在B中加D,生成沉淀E,并得到一种溶液;
在B中加C,生成沉淀并得到溶液F;
将少量E加入到过量F中,有气体放出.
(1)写化学式,B是??????????? ___,C是??????????? ___.
(2)如果将A和B混合,有关反应的离子方程式为??????????????????????? _________,将E加入过量F中,有关离子方程式??????????????????????? __________.
离子反应推断题有A、B、C、D四种溶液,它们Ba(NO3)2H2SO4 SO42-+Ba2+ == BaSO4_BaCO3+2H+==Ba2++H2O+O2↑写出与下列每一离子方程式对应2个化学反应方程式
(1) HCO3-+H+=CO2+H2O
(2)H++OH- =H2O
(3)Mg+2 H+ =Mg2++H2↑
(4)BaCO3+2H+=Ba2++H2O +CO2 ↑离子方程式的意义:不仅可以表示一个反应,而且可以表示所有同一类型的离子反应作业: 通过自己书写 判断 下列物质间反应的离子方程式是否正确11.醋酸与氨水溶液混合: CH3COOH + NH3·H2O =CH3COONH4 + H2O
2.铜片插入硝酸银溶液: Cu + Ag+ = Cu2+ + Ag
3.碳酸钙加入醋酸溶液中: CO32- + 2CH3COOH = CO2↑+ 2CH3COO-+H2O4.氯气跟水反应:
Cl2 + H2O = 2H+ + Cl- + ClO -
5.钠跟水反应:
Na + 2H2O = Na+ + 2OH - + H2↑
6.硫酸铜溶液跟氢氧化钡溶液反应:
Ba2+ + SO42- = BaSO4↓下列物质间反应的离子方程式是否正确27. 在碳酸氢钠溶液中加入盐酸
HCO3-+H+=CO2↑+H2O
8.把金属铁放入稀硫酸中:
2Fe+6H+=2Fe3++3H2↑9.碳酸氢钙溶液跟盐酸反应:
Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
10.碘化钾溶液跟适量溴水反应:
2I-+Br2=I2+2Br-
11.氢氧化钡溶液跟盐酸反应:
OH-+H+=H2O下列物质间反应的离子方程式是否正确312.小苏打溶液跟烧碱溶液反应:
HCO3-+OH-=CO32-+H2O
13.氨气通入稀硫酸溶液中:
NH3+H+=NH4+
14.二氧化碳通入碳酸钠溶液中:
CO2+CO32-+H2O=2HCO3-
15.氯气通入冷的氢氧化钠溶液中:
2Cl2+2OH-=3Cl-+ClO-+H2O下列物质间反应的离子方程式是否正确416.氨气通入醋酸溶液中:
CH3COOH+NH3=CH3COONH4
17.澄清的石灰水跟盐酸反应:
H++OH-=H2O
18碳酸钡溶于醋酸:
BaCO3+2H+=Ba2++H2O+CO2↑
19.次氯酸钙溶液中通入过量二氧化碳:
Ca2++2ClO-+H2O+CO2= CaCO3↓+2HClO 例题3、在一个烧杯中盛放一种液体a,向其中逐滴加入(或通入)另一物质b,在此过程中烧杯中液体的导电能力如何变化? a bA 水 NaOH溶液
B 醋酸溶液 NaOH溶液
C 冰醋酸 水
D Ba(OH)2溶液 稀硫酸
E 澄清的石灰水 二氧化碳气体
F 氨水 醋酸溶液祝大家学习愉快
